
- •Миколаїв 2008
- •Рецензент: д.Ф.-м.Н., професор і.О. Муленко Вступ
- •1. Механіка
- •1.1 Кінематика поступального і обертального руху Система відліку. Траєкторія, шлях, переміщення.
- •Лінійна швидкість.
- •Лінійне прискорення.
- •Види поступального руху:
- •Кінематика обертального руху.
- •Зв'язок лінійних і кутових характеристик руху.
- •Приклади розв'язування задач.
- •Задачі для самостійної роботи.
- •1.2. Динаміка матеріальної точки. Перший закон Ньютона.
- •Механічні системи.
- •Імпульс.
- •Другий закон Ньютона.
- •Принцип незалежності дії сил.
- •Третій закон Ньютона.
- •Закон збереження імпульсу.
- •Закон руху центру мас.
- •Сили в механіці.
- •Робота, енергія, потужність.
- •Кінетична енергія.
- •Потенціальна енергія.
- •Закон збереження енергії.
- •Зіткнення.
- •Поле сил тяжіння.
- •Космічні швидкості.
- •Приклади розв'язування задач.
- •Задачі для самостійної роботи.
- •Робота сили. Закони збереження
- •1.3. Механіка твердого тіла Момент інерції.
- •Момент сили.
- •Момент імпульсу.
- •Основний закон динаміки обертального руху.
- •Кінетична енергія обертання.
- •Основні величини і співвідношення для поступального і обертального руху.
- •Приклади розв'язування задач.
- •Задачі для самостійної роботи. Основний закон динаміки твердого тіла.
- •Енергія обертального руху. Закони збереження
- •2. Молекулярна фізика та термодинаміка
- •2.1 Молекулярно-кінетична теорія ідеальних газів. Рівняння стану ідеального газу. Перший закон термодинаміки. Статистичний і термодинамічний методи дослідження.
- •Термодинамічна система.
- •Ідеальний газ.
- •Закон Бойля-Маріотта.
- •Закон Авогадро.
- •Закон Дальтона.
- •Закон Гей-Люссака.
- •Рівняння стану ідеального газу.
- •Основне рівняння молекулярно-кінетичної теорії ідеальних газів.
- •Закон Максвелла про розподіл молекул ідеального газу по швидкостям.
- •Барометрична формула.
- •Внутрішня енергія термодинамічної системи.
- •Число степенів вільності.
- •Перший закон термодинаміки.
- •Теплоємність.
- •Приклади розв'язання задач.
- •Задачі для самостійної роботи.
- •2.2 Адіабатний процес. Робота газу при різних процесах Явища переносу. Робота газу при його розширенні.
- •Адіабатичний процес. Рівняння Пуассона.
- •Робота газу в адіабатичному процесі.
- •Політропічні процеси.
- •Середня довжина вільного пробігу молекул.
- •Явища переносу.
- •Теплопровідність.
- •Дифузія.
- •Внутрішнє тертя (в’язкість).
- •К руговий процес (цикл).
- •Ккд кругового процесу. Цикл Карно.
- •Приклади розв'язання задач.
- •Задачі для самостійної роботи.
- •2.3 Другий закон термодинаміки. Рідини. Ентропія.
- •Статистичне тлумачення ентропії.
- •Другий закон термодинаміки.
- •Третій закон термодинаміки.
- •Реальні гази, рідини та тверді тіла.
- •Рівняння Ван-дер-Ваальса.
- •Внутрішня енергія реального газу.
- •Рідини та їх опис.
- •Поверхневий натяг.
- •Змочування.
- •Тиск під скривленою поверхнею рідини.
- •Капілярні явища.
- •Приклади розв'язання задач.
- •Задачі для самостійної роботи.
- •Додатки
- •1. Вектор.
- •9. Градієнт.
- •Основні фізичні постійні
Ккд кругового процесу. Цикл Карно.
В
результаті кругового процесу система
повертається в початковий стан,
відповідно, повна зміна внутрішньої
енергії дорівнює нулю. Тому
![]() ,
тобто робота, яка здійснюється за цикл,
дорівнює кількості отриманої зокола
теплоти. Якщо в ході кругового процесу
система не тільки отримує кількість
теплоти Q1,
але і втрачає (віддає) кількість теплоти
Q2,
то Q = Q1 – Q2.
,
тобто робота, яка здійснюється за цикл,
дорівнює кількості отриманої зокола
теплоти. Якщо в ході кругового процесу
система не тільки отримує кількість
теплоти Q1,
але і втрачає (віддає) кількість теплоти
Q2,
то Q = Q1 – Q2.
Термічний коефіцієнт корисної дії (ККД) для кругового процесу – це величина, яка дорівнює відношенню роботи, яку здійснює система, і кількість теплоти, яку отримає в цьому циклі система:
![]() .
.
Цикл Карно – це цикл який складається з чотирьох оборотних процесів: двох ізотермічних та двох адіабатичних. Термічний ККД циклу Карно:
![]() .
.
Приклади розв'язання задач.
Приклад 1. Ефективний діаметр молекули повітря дорівнює 2,9∙10–10 м. Визначити середню довжину вільного шляху і середню частоту зіткнень молекули повітря z при температурі 273 К і тиску 1,01 Па.
d = 2,9∙10–10 м T0 = 273 К p = 1,01 Па K = 1,38 ∙ 10–23 Дж/К R = 8,31 Дж/(мольК) µ = 29 ∙ 10–3 кг/моль |
– ?, z – ? |
За 1 с молекула повітря зазнає в середньому зіткнень з іншими молекулами повітря.
Середня довжина вільного пробігу молекули між двома послідовними зіткненнями
![]() . (1)
. (1)
де n – концентрація молекул (відношення числа молекул до об’єму газу, в якому вони знаходяться).
Для визначення невідомої концентрації молекул повітря скористаємося основним рівнянням молекулярно-кінетичної теорії:
![]() , (2)
, (2)
де р – тиск газу, 0 – середня енергія поступального руху молекул газу, яка дорівнює
![]() , (3)
, (3)
де k – стала Больцмана; Т – термодинамічна температура газу.
Підставимо (3) в (2) і знайдемо концентрацію молекул:
![]() . (4)
. (4)
Підставивши (4) в (1), одержимо
![]() .
.
Перевіримо розмірність невідомої величини:
![]() .
.
Обчислимо невідому довжину вільного пробігу молекули повітря:
![]()
Середня частота зіткнень молекул повітря пов’язана з довжиною вільного пробігу співвідношенням
![]() , (5)
, (5)
де – середня арифметична швидкість молекул. Її можна визначити за формулою
![]() , (6)
, (6)
де R – універсальна газова стала; µ - молярна маса повітря.
Підставимо (6) у (5), після перетворення одержимо
![]() . (7)
. (7)
Перевіримо розмірність середньої частоти зіткнень молекул повітря:
![]() .
.
Обчислимо невідому частоту зіткнень:
![]() с–1.
с–1.
Відповідь: = 10–2 м; z = 4,47∙104 с–1.
Приклад 2. Користуючись загальним рівнянням політропи, знайти вираз для роботи ідеального газу при політропічному процесі зміни параметрів від р1, V1, Т1 до р2, V2, Т2.
Розглянемо окремі випадки: 1) С = Ср; 2) С = СV; 3) С = 0; 4) С = ∞.
Аналіз і розв’язання задачі у загальному вигляді
Рівняння політропічного процесу, який відбувається зі сталою теплоємністю, має вигляд
![]() ,
,
де
![]() – показник політропи, тобто
– показник політропи, тобто
![]() .
.
Із
загального рівняння політропи випливає,
що
![]() ,
де
р
і V
– будь-які проміжні значення параметрів
в інтервалі
,
де
р
і V
– будь-які проміжні значення параметрів
в інтервалі
![]() .
Отже,
.
Отже,
![]() .
.
У загальному випадку будь-якого переходу ідеального газу зі стану 1 до стану 2
![]() ,
,
значить,
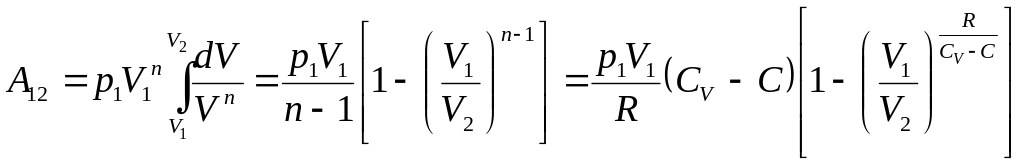 .
.
Як легко переконатися, дана загальна формула роботи політропічного процесу перетворюється в окремі формули при відповідних значеннях теплоємності С. Справді:
якщо С = Ср, тобто при ізобарному процесі,
![]() ;
;
якщо С = СV, тобто при ізохорному процесі,
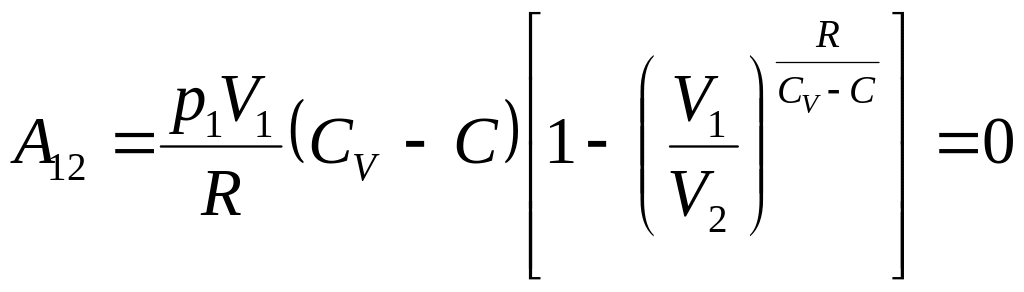 ;
;
якщо С = 0, тобто при адіабатному процесі,
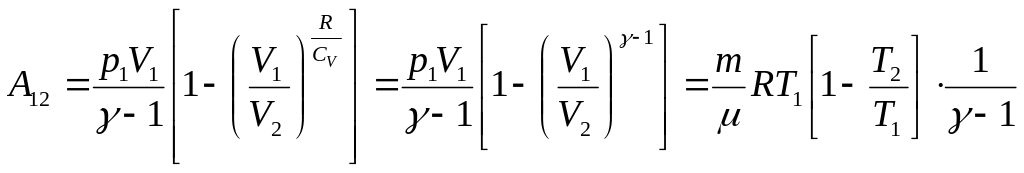 ;
;
якщо С = ∞, тобто при ізотермічному процесі,
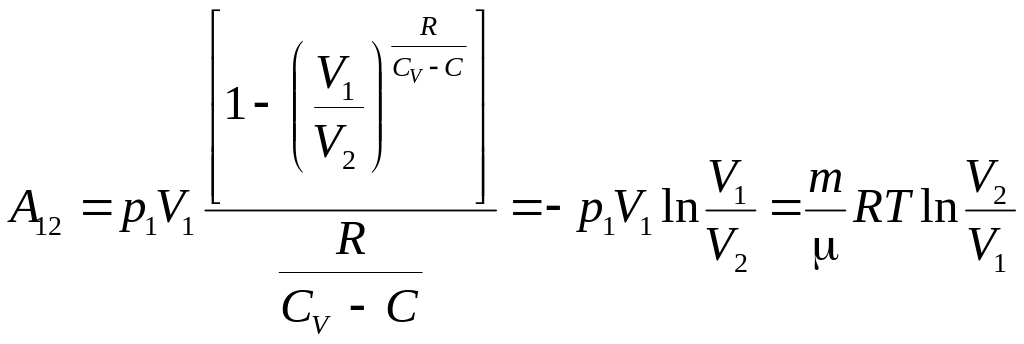 .
.
В останній формулі застосовано відому теорему, згідно з якою
![]() .
.
