
- •Миколаїв 2008
- •Рецензент: д.Ф.-м.Н., професор і.О. Муленко Вступ
- •1. Механіка
- •1.1 Кінематика поступального і обертального руху Система відліку. Траєкторія, шлях, переміщення.
- •Лінійна швидкість.
- •Лінійне прискорення.
- •Види поступального руху:
- •Кінематика обертального руху.
- •Зв'язок лінійних і кутових характеристик руху.
- •Приклади розв'язування задач.
- •Задачі для самостійної роботи.
- •1.2. Динаміка матеріальної точки. Перший закон Ньютона.
- •Механічні системи.
- •Імпульс.
- •Другий закон Ньютона.
- •Принцип незалежності дії сил.
- •Третій закон Ньютона.
- •Закон збереження імпульсу.
- •Закон руху центру мас.
- •Сили в механіці.
- •Робота, енергія, потужність.
- •Кінетична енергія.
- •Потенціальна енергія.
- •Закон збереження енергії.
- •Зіткнення.
- •Поле сил тяжіння.
- •Космічні швидкості.
- •Приклади розв'язування задач.
- •Задачі для самостійної роботи.
- •Робота сили. Закони збереження
- •1.3. Механіка твердого тіла Момент інерції.
- •Момент сили.
- •Момент імпульсу.
- •Основний закон динаміки обертального руху.
- •Кінетична енергія обертання.
- •Основні величини і співвідношення для поступального і обертального руху.
- •Приклади розв'язування задач.
- •Задачі для самостійної роботи. Основний закон динаміки твердого тіла.
- •Енергія обертального руху. Закони збереження
- •2. Молекулярна фізика та термодинаміка
- •2.1 Молекулярно-кінетична теорія ідеальних газів. Рівняння стану ідеального газу. Перший закон термодинаміки. Статистичний і термодинамічний методи дослідження.
- •Термодинамічна система.
- •Ідеальний газ.
- •Закон Бойля-Маріотта.
- •Закон Авогадро.
- •Закон Дальтона.
- •Закон Гей-Люссака.
- •Рівняння стану ідеального газу.
- •Основне рівняння молекулярно-кінетичної теорії ідеальних газів.
- •Закон Максвелла про розподіл молекул ідеального газу по швидкостям.
- •Барометрична формула.
- •Внутрішня енергія термодинамічної системи.
- •Число степенів вільності.
- •Перший закон термодинаміки.
- •Теплоємність.
- •Приклади розв'язання задач.
- •Задачі для самостійної роботи.
- •2.2 Адіабатний процес. Робота газу при різних процесах Явища переносу. Робота газу при його розширенні.
- •Адіабатичний процес. Рівняння Пуассона.
- •Робота газу в адіабатичному процесі.
- •Політропічні процеси.
- •Середня довжина вільного пробігу молекул.
- •Явища переносу.
- •Теплопровідність.
- •Дифузія.
- •Внутрішнє тертя (в’язкість).
- •К руговий процес (цикл).
- •Ккд кругового процесу. Цикл Карно.
- •Приклади розв'язання задач.
- •Задачі для самостійної роботи.
- •2.3 Другий закон термодинаміки. Рідини. Ентропія.
- •Статистичне тлумачення ентропії.
- •Другий закон термодинаміки.
- •Третій закон термодинаміки.
- •Реальні гази, рідини та тверді тіла.
- •Рівняння Ван-дер-Ваальса.
- •Внутрішня енергія реального газу.
- •Рідини та їх опис.
- •Поверхневий натяг.
- •Змочування.
- •Тиск під скривленою поверхнею рідини.
- •Капілярні явища.
- •Приклади розв'язання задач.
- •Задачі для самостійної роботи.
- •Додатки
- •1. Вектор.
- •9. Градієнт.
- •Основні фізичні постійні
Закон Максвелла про розподіл молекул ідеального газу по швидкостям.
В газі, який знаходиться у стані рівноваги при даній температурі, встановлюється деякий стаціонарний розподіл молекул по швидкостям, який не змінюється з часом.
Цей розподіл описується функцією f(υ), яка називається функцією розподілу молекул по швидкостям, яка визначає відносне число молекул, швидкості яких лежать в інтервалі від υ до υ + dυ, тобто
![]() .
.
Закон Максвелла:
![]() .
.
Я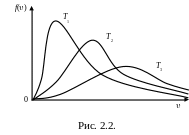 кщо
по осі абсцис відкласти швидкості ,
а по осі ординат – функцію f(),
то для різних температур T1T2T3
криві
розподілу молекул за швидкостями будуть
мати вигляд, зображений на рис.2.2.
кщо
по осі абсцис відкласти швидкості ,
а по осі ординат – функцію f(),
то для різних температур T1T2T3
криві
розподілу молекул за швидкостями будуть
мати вигляд, зображений на рис.2.2.
Функція
розподілу задовольняє умові нормування:
![]() .
.
Швидкість, при якій функція розподілу молекул ідеального газу за швидкостями максимальна, називається найбільш ймовірною швидкістю υв.
Прирівняв
![]() нулю, отримаємо:
нулю, отримаємо:
![]() .
.
Середньоарифметична швидкість:
![]() .
.
Барометрична формула.
Розподіл Максвелла передбачає, що на молекули газу не діють зовнішні сили. Фактично молекули газів перебувають в однорідному полі тяжіння Землі. Тепловий рух молекул призводить до деякого стаціонарного стану газу, при якому тиск газу з висотою зменшується. Рівняння, яке дає змогу визначити зміну тиску повітря з висотою, називають барометричною формулою. Припускаючи, що T=const та g=const барометрична формула має вигляд:
![]() ,
,
де p0 – тиск газу на висоті h0.
Використовуючи
співвідношення
![]() ,
,
![]() ,
,
![]() ,
отримуємо розподіл Больцмана:
,
отримуємо розподіл Больцмана:
![]() .
.
Так як
![]() – потенціальна енергія молекули в полі
тяжіння, відповідно:
– потенціальна енергія молекули в полі
тяжіння, відповідно:
![]() ;
;
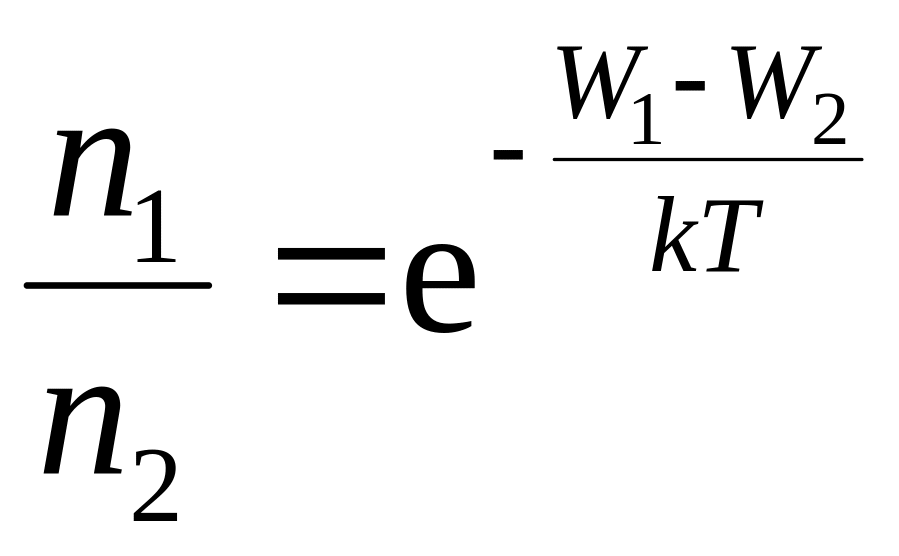 .
.
Такий розподіл називають розподілом Больцмана (розподіл частинок за значенням потенціальної енергії) для зовнішнього потенціального поля.
Із нього виходить, що при постійній температурі густина газу більша там, де менша потенціальна енергія його молекул. Якщо частинки мають однакову масу і знаходяться в стані хаотичного теплового руху, то розподіл Больцмана справедливий в будь-якому зовнішньому потенціальному полі, а не тільки в полі сил тяжіння.
Внутрішня енергія термодинамічної системи.
Внутрішня енергія U – це енергія хаотичного (теплового) руху мікрочастинок системи (молекул, атомів, електронів, ядер і т.д.) та енергія взаємодії цих частинок.
До внутрішньої енергії не відносяться кінетична енергія руху системи як цілого і потенціальна енергія системи у зовнішніх полях.
Внутрішня енергія – однозначна функція термодинамічного стану системи. В кожному стані система має цілком визначену внутрішню енергію. Тому, внутрішня енергія не залежить від того, яким чином система прийшла в даний стан.
При переході системи із одного стану в інший зміна внутрішньої енергії визначається тільки різницею значень внутрішньої енергії цих станів і не залежить від шляху переходу.
Число степенів вільності.
Число степенів вільності – це число незалежних змінних, які повністю визначають положення системи в просторі.
Число степенів вільності для ідеального газу жорстких молекул.
Число степенів вільності |
Одноатомний газ |
Двоатомний газ |
Багатоатомний газ |
Поступальних |
3 |
3 |
3 |
Обертальних |
– |
2 |
3 |
Всього |
3 |
5 |
6 |
В реальних молекулах нема жорсткого зв’язку між атомами в молекулі, тому необхідно враховувати також степені вільності коливального руху атомів всередині молекули.
Незалежно
від загального числа степенів вільності
молекули, три степені вільності завжди
поступальні. На кожну з них приходиться
третя частина кінетичної енергії
поступального руху молекули
![]() :
:
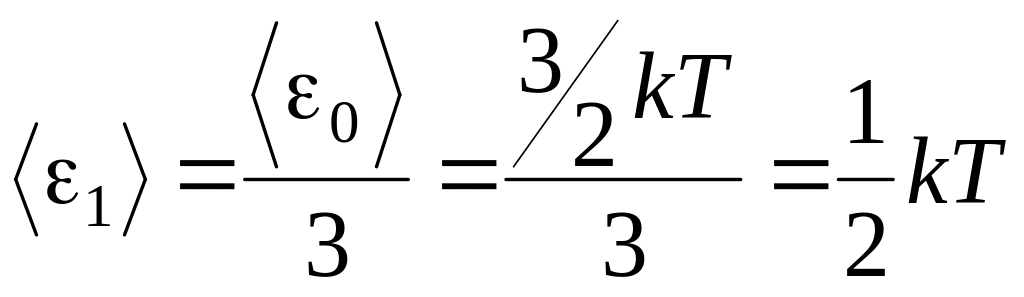 .
.
Для
системи, яка знаходиться в стані
термодинамічної рівноваги на кожну
поступальну і обертальну степінь
вільності приходиться у середньому
кінетична енергія, яка дорівнює
![]() ,
а на кожну коливальну степінь вільності
– в середньому енергія, яка дорівнює
kT.
,
а на кожну коливальну степінь вільності
– в середньому енергія, яка дорівнює
kT.
Енергія коливальних степенів вільності вдвічі більше, оскільки коливальна система має рівні по розміру середні значення як кінетичної, так і потенціальної енергії.
Таким
чином, середня енергія молекули:
![]() ,
,
де і
– сума числа поступальних, числа
обертальних і подвоєного числа коливальних
степенів вільності молекули:
![]() .
В класичній теорії розглядають молекули
з жорстким зв’язком між атомами; для
них і
співпадає з числом степенів вільності
молекули.
.
В класичній теорії розглядають молекули
з жорстким зв’язком між атомами; для
них і
співпадає з числом степенів вільності
молекули.
В ідеальному газі молекули між собою не взаємодіють і їх потенціальна енергія дорівнює нулю. Тому внутрішня енергія одного моля ідеального газу Uμ і довільної маси m газу U будуть відповідно:
![]() ;
; ![]() .
.
