
- •Миколаїв 2008
- •Рецензент: д.Ф.-м.Н., професор і.О. Муленко Вступ
- •1. Механіка
- •1.1 Кінематика поступального і обертального руху Система відліку. Траєкторія, шлях, переміщення.
- •Лінійна швидкість.
- •Лінійне прискорення.
- •Види поступального руху:
- •Кінематика обертального руху.
- •Зв'язок лінійних і кутових характеристик руху.
- •Приклади розв'язування задач.
- •Задачі для самостійної роботи.
- •1.2. Динаміка матеріальної точки. Перший закон Ньютона.
- •Механічні системи.
- •Імпульс.
- •Другий закон Ньютона.
- •Принцип незалежності дії сил.
- •Третій закон Ньютона.
- •Закон збереження імпульсу.
- •Закон руху центру мас.
- •Сили в механіці.
- •Робота, енергія, потужність.
- •Кінетична енергія.
- •Потенціальна енергія.
- •Закон збереження енергії.
- •Зіткнення.
- •Поле сил тяжіння.
- •Космічні швидкості.
- •Приклади розв'язування задач.
- •Задачі для самостійної роботи.
- •Робота сили. Закони збереження
- •1.3. Механіка твердого тіла Момент інерції.
- •Момент сили.
- •Момент імпульсу.
- •Основний закон динаміки обертального руху.
- •Кінетична енергія обертання.
- •Основні величини і співвідношення для поступального і обертального руху.
- •Приклади розв'язування задач.
- •Задачі для самостійної роботи. Основний закон динаміки твердого тіла.
- •Енергія обертального руху. Закони збереження
- •2. Молекулярна фізика та термодинаміка
- •2.1 Молекулярно-кінетична теорія ідеальних газів. Рівняння стану ідеального газу. Перший закон термодинаміки. Статистичний і термодинамічний методи дослідження.
- •Термодинамічна система.
- •Ідеальний газ.
- •Закон Бойля-Маріотта.
- •Закон Авогадро.
- •Закон Дальтона.
- •Закон Гей-Люссака.
- •Рівняння стану ідеального газу.
- •Основне рівняння молекулярно-кінетичної теорії ідеальних газів.
- •Закон Максвелла про розподіл молекул ідеального газу по швидкостям.
- •Барометрична формула.
- •Внутрішня енергія термодинамічної системи.
- •Число степенів вільності.
- •Перший закон термодинаміки.
- •Теплоємність.
- •Приклади розв'язання задач.
- •Задачі для самостійної роботи.
- •2.2 Адіабатний процес. Робота газу при різних процесах Явища переносу. Робота газу при його розширенні.
- •Адіабатичний процес. Рівняння Пуассона.
- •Робота газу в адіабатичному процесі.
- •Політропічні процеси.
- •Середня довжина вільного пробігу молекул.
- •Явища переносу.
- •Теплопровідність.
- •Дифузія.
- •Внутрішнє тертя (в’язкість).
- •К руговий процес (цикл).
- •Ккд кругового процесу. Цикл Карно.
- •Приклади розв'язання задач.
- •Задачі для самостійної роботи.
- •2.3 Другий закон термодинаміки. Рідини. Ентропія.
- •Статистичне тлумачення ентропії.
- •Другий закон термодинаміки.
- •Третій закон термодинаміки.
- •Реальні гази, рідини та тверді тіла.
- •Рівняння Ван-дер-Ваальса.
- •Внутрішня енергія реального газу.
- •Рідини та їх опис.
- •Поверхневий натяг.
- •Змочування.
- •Тиск під скривленою поверхнею рідини.
- •Капілярні явища.
- •Приклади розв'язання задач.
- •Задачі для самостійної роботи.
- •Додатки
- •1. Вектор.
- •9. Градієнт.
- •Основні фізичні постійні
Приклади розв'язання задач.
Приклад 1. В посудині знаходиться суміш 1 кг кисню і 2 кг гелію за нормальних умов. Знайти, який об’єм займає суміш, її молекулярну вагу, а також густину суміші цих ідеальних газів.
m1 = 1 кг µ1 = 32∙10–3 кг/моль m2 = 2 кг µ2 = 4∙10–3 кг/моль R = 8,31 Дж/(моль∙К) T0 = 273 К p0 = 1,013∙105 Па |
V – ? µc – ? ρc – ? |
Для суміші двох ідеальних газів справедливий закон Дальтона:
![]() ,
,
де р1 і р2 – парціальні тиски, які визначаються з рівняння Менделєєва-Клапейрона
.
![]() ;
; ![]() .
.
де Т0 – температура суміші, V – об’єм посудини, де знаходяться змішані гази.
Підставляючи в закон Дальтона вирази для p1 та p2, отримаємо
![]() .
.
Оскільки
рс = р0,
то
![]() .
.
Молекулярну вагу суміші визначимо також із рівняння Менделєєва-Клапейрона:
![]() ,
,
тому
 .
.
Відповідно до визначення густини суміші маємо
![]() .
.
Перевіримо розмірність невідомих фізичних величин:
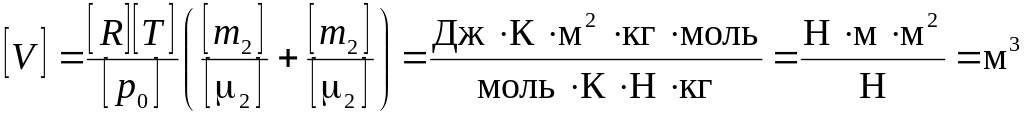 ;
;
 ;
;
![]() .
.
Проведемо обчислення невідомих фізичних величин у СІ:
![]() м3;
м3;
![]() кг/моль;
кг/моль;
![]() кг/м3.
кг/м3.
Відповідь: V = 12 м3; µc = 5,64∙10–3 кг/моль; ρc = 0,252 кг/м3.
Приклад 2. Визначити число молекул водню, які перетинають за 1 с площадку площею 1 см2, розташовану перпендикулярно осі (водень знаходиться за нормальних умов).
µ = 2∙10–3 кг/моль Δt = 1 с ΔS = 1 см2 = 10–4 м2 ρ0 = 1,013∙105 Па T0 = 273 К R = 8,31 Дж/(мольК) k = 1,38∙10–23 Дж/К |
n1 – ? n2 – ? |
Наведемо два способи розв’язування цієї задачі.
І спосіб. Враховуючи, що в газі немає переважних напрямків руху молекул, приймемо, що 1/3 всіх молекул рухається вздовж осі ОX, 1/3 – вздовж осі ОY і 1/3 – вздовж осі ОZ. Відповідно, в додатному напрямі осі ОX рухається 1/6 всіх молекул. Далі зробимо припущення, що швидкості всіх молекул однакові й дорівнюють середній швидкості v. Тоді шукане число молекул складатиме
![]() ,
,
де n0 – концентрація молекул (їх число в одиниці об’єму), яка визначається за формулою
![]() ,
,
де k – стала Больцмана.
Перевіримо розмірність невідомої величини:
![]() .
.
Середня арифметична швидкість може бути знайдена за формулою
![]() .
.
Підставляючи, отримаємо
![]() .
.
Проведемо обчислення в СІ:
![]() .
.
ІІ спосіб. В першому випадку вважалось, що молекули рухаються з однаковою за модулем швидкістю, яка дорівнює середній арифметичній. Однак молекули, розподілені за компонентами швидкостей згідно з законом Максвелла, який для одновимірного випадку легко одержати із розподілу
![]() .
.
Отже, число молекул, яке перетинає площадку ΔS = 1 см2 за час Δt = 1 с, знайдемо зі співвідношення

![]() ,
,
де
![]() .
.
Враховуючи,
що
![]() ,
одержимо
,
одержимо

Таким чином, одержані вирази для n1 і n2 різко відрізняються.
Відповідь:
n1![]() 7,62∙1023;
n2
11,1∙1023.
7,62∙1023;
n2
11,1∙1023.
Приклад 3. Кисень, маса якого 2 кг, знаходиться в закритій посудині об’ємом V1 = 1 м3 під тиском р1 = 2∙105 Н/м2. Газ спочатку нагрівають при сталому тиску до об’єму V2 = 3 м3, а потім при сталому об’ємі до тиску р3 = 5∙105 Н/м2. Обчислити зміну внутрішньої енергії газу, виконану ним роботу і теплоту, яка була передана газу.
m = 2 кг µ = 32∙10–3 кг/моль i = 5 p1 = 2∙105 Па V1 = 1 м3 V2 = 3 м3 p3 = 5∙105 Па R = 8,31 Дж/(мольК) |
ΔU – ? A – ? Q – ? |
Питома
теплоємність газу при сталому об’ємі
визначається за формулою
![]() ,
де і – число степенів вільності молекул
газу (для двохатомних молекул кисню
і = 5:
три степені вільності поступального
та дві степені – обертального руху).
Зміна внутрішньої енергії газу
,
де і – число степенів вільності молекул
газу (для двохатомних молекул кисню
і = 5:
три степені вільності поступального
та дві степені – обертального руху).
Зміна внутрішньої енергії газу
![]() ,
,
де
![]() – різниця температур газу в кінцевому
(третьому) і початковому станах.
– різниця температур газу в кінцевому
(третьому) і початковому станах.
Початкову і кінцеву температури газу знайдемо з рівняння Менделєєва-Клапейрона :
![]() .
.
Робота по розширенню газу при сталому тиску виражається формулою
![]() .
.
Робота газу, який нагрівається при сталих тиску й об’ємі, дорівнює нулю: А2 = 0.
Отже,
повна робота, виконувана газом:
![]() .
.
Відповідно до першого закону термодинаміки, теплота Q, передана газу, дорівнює сумі зміни внутрішньої енергії ΔU і роботи А. Обчислимо всі температури:
![]() К;
К;
![]() К;
К;
![]() К.
К.
Враховуючи значення температур, знаходимо роботу:
![]() Дж.
Дж.
Перевіримо розмірність роботи:
![]()
Знайдемо зміну внутрішньої енергії:
![]() Дж.
Дж.
Перевіримо
розмірність
![]() :
:
![]()
Теплота, яка була передана газу,
![]() Дж.
Дж.
Відповідь: ΔU = 3,24∙106 Дж; A = 4∙105 Дж; Q = 3,64∙106 Дж.
