
- •Миколаїв 2008
- •Рецензент: д.Ф.-м.Н., професор і.О. Муленко Вступ
- •1. Механіка
- •1.1 Кінематика поступального і обертального руху Система відліку. Траєкторія, шлях, переміщення.
- •Лінійна швидкість.
- •Лінійне прискорення.
- •Види поступального руху:
- •Кінематика обертального руху.
- •Зв'язок лінійних і кутових характеристик руху.
- •Приклади розв'язування задач.
- •Задачі для самостійної роботи.
- •1.2. Динаміка матеріальної точки. Перший закон Ньютона.
- •Механічні системи.
- •Імпульс.
- •Другий закон Ньютона.
- •Принцип незалежності дії сил.
- •Третій закон Ньютона.
- •Закон збереження імпульсу.
- •Закон руху центру мас.
- •Сили в механіці.
- •Робота, енергія, потужність.
- •Кінетична енергія.
- •Потенціальна енергія.
- •Закон збереження енергії.
- •Зіткнення.
- •Поле сил тяжіння.
- •Космічні швидкості.
- •Приклади розв'язування задач.
- •Задачі для самостійної роботи.
- •Робота сили. Закони збереження
- •1.3. Механіка твердого тіла Момент інерції.
- •Момент сили.
- •Момент імпульсу.
- •Основний закон динаміки обертального руху.
- •Кінетична енергія обертання.
- •Основні величини і співвідношення для поступального і обертального руху.
- •Приклади розв'язування задач.
- •Задачі для самостійної роботи. Основний закон динаміки твердого тіла.
- •Енергія обертального руху. Закони збереження
- •2. Молекулярна фізика та термодинаміка
- •2.1 Молекулярно-кінетична теорія ідеальних газів. Рівняння стану ідеального газу. Перший закон термодинаміки. Статистичний і термодинамічний методи дослідження.
- •Термодинамічна система.
- •Ідеальний газ.
- •Закон Бойля-Маріотта.
- •Закон Авогадро.
- •Закон Дальтона.
- •Закон Гей-Люссака.
- •Рівняння стану ідеального газу.
- •Основне рівняння молекулярно-кінетичної теорії ідеальних газів.
- •Закон Максвелла про розподіл молекул ідеального газу по швидкостям.
- •Барометрична формула.
- •Внутрішня енергія термодинамічної системи.
- •Число степенів вільності.
- •Перший закон термодинаміки.
- •Теплоємність.
- •Приклади розв'язання задач.
- •Задачі для самостійної роботи.
- •2.2 Адіабатний процес. Робота газу при різних процесах Явища переносу. Робота газу при його розширенні.
- •Адіабатичний процес. Рівняння Пуассона.
- •Робота газу в адіабатичному процесі.
- •Політропічні процеси.
- •Середня довжина вільного пробігу молекул.
- •Явища переносу.
- •Теплопровідність.
- •Дифузія.
- •Внутрішнє тертя (в’язкість).
- •К руговий процес (цикл).
- •Ккд кругового процесу. Цикл Карно.
- •Приклади розв'язання задач.
- •Задачі для самостійної роботи.
- •2.3 Другий закон термодинаміки. Рідини. Ентропія.
- •Статистичне тлумачення ентропії.
- •Другий закон термодинаміки.
- •Третій закон термодинаміки.
- •Реальні гази, рідини та тверді тіла.
- •Рівняння Ван-дер-Ваальса.
- •Внутрішня енергія реального газу.
- •Рідини та їх опис.
- •Поверхневий натяг.
- •Змочування.
- •Тиск під скривленою поверхнею рідини.
- •Капілярні явища.
- •Приклади розв'язання задач.
- •Задачі для самостійної роботи.
- •Додатки
- •1. Вектор.
- •9. Градієнт.
- •Основні фізичні постійні
Рівняння стану ідеального газу.
Рівнянням стану термодинамічної системи називається рівняння, яке зв’язує тиск р, об’єм V і температуру Т термодинамічної системи, яка знаходиться в стані термодинамічної рівноваги:
![]() ,
,
де кожна зі змінних є функцією двох інших.
Припустимо, що деяка маса газу знаходиться в стані 1, при цьому її об’єм V1, тиск р1, температура Т1. Ця ж маса газу в іншому довільному стані характеризується параметрами р2, V2, Т2. Перехід зі стану 1 в стан 2 здійснюється послідовно ізотермічним (1–1) і ізохорним (1–2) процесами (рис.2.1).
З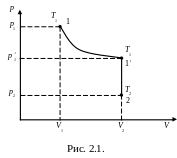 апишемо
для визначених станів рівняння за
законами Бойля-Маріотта і Гей-Люссака.
апишемо
для визначених станів рівняння за
законами Бойля-Маріотта і Гей-Люссака.
![]() ,
,
![]() .
.
Виключаючи
![]() ,
отримаємо рівняння стану ідеального
газу: для даної маси ідеального газу
відношення добутку тиску та об’єму до
термодинамічної температури є стала
величина (рівняння Клапейрона)
,
отримаємо рівняння стану ідеального
газу: для даної маси ідеального газу
відношення добутку тиску та об’єму до
термодинамічної температури є стала
величина (рівняння Клапейрона)
![]() чи
чи
![]() .
.
За
однакових тиску р
та температурі Т
молі всіх газів займають однаковий
молярний об’єм
![]() ,
згідно з законом Авогадро. Рівняння
стану для моля ідеального газу:
,
згідно з законом Авогадро. Рівняння
стану для моля ідеального газу:
![]() ,
де константа R = 8,31 Дж/(моль·К)
– називається універсальною газовою
сталою.
,
де константа R = 8,31 Дж/(моль·К)
– називається універсальною газовою
сталою.
Об’єм
газу маси m:
![]() .
.
Для довільної маси m газу рівняння стану ідеального газу, рівняння Менделєєва-Клапейрона має вигляд:
![]() .
.
Використовуючи
сталу Больцмана:
![]() Дж/К, рівняння стану можна записати у
вигляді:
Дж/К, рівняння стану можна записати у
вигляді:
![]() ,
,
де
![]() – концентрація молекул – кількість
молекул в одиниці об’єму.
– концентрація молекул – кількість
молекул в одиниці об’єму.
Таким чином:
1) тиск ідеального газу при даній температурі прямо пропорційний концентрації його молекул,
2) при однакових температурі і тиску всі гази налічують в одиниці об’єму однакове число молекул.
Кількість молекул, яка налічуються в 1м3 газу за нормальних умов, називається числом Лошмідта:
![]() 1/м3.
1/м3.
Основне рівняння молекулярно-кінетичної теорії ідеальних газів.
Припустимо,
що в посудині об’ємом V
знаходиться ідеальний газ масою m,
який складається із N
молекул масою m0,
які рухаються з однаковими швидкостями
υ. Концентрація молекул в газі за
визначенням
![]() .
.
Якщо
при зіткненні зі стінками за час Δt
елементарній площадці ΔS
стінці посудини передається імпульс
ΔР,
то тиск газу, який він створює на стінку
посудини
![]() .
.
При
кожному зіткненні молекула, яка рухається
перпендикулярно стінці, передає їй
імпульс 2m0υ.
В середньому в напрямку до стінки
рухається 1/6 частина всіх молекул. (Якщо
розглянути три взаємно перпендикулярні
осі, то в середньому тільки 1/3 молекул
рухається вздовж однієї з осей і тільки
половина із них – 1/6 вздовж даного
напрямку). За час Δt
площадки ΔS
досягне 1/6nΔSυΔt
молекул і передадуть їй імпульс
![]() .
.
Тиск,
який створює газ на стінку посудини:
![]() .
.
Якщо газ об’ємом V вміщає N молекул, які рухаються зі швидкостями υ1, υ2, …, υN, то доцільно розглядати середню квадратичну швидкість, яка визначається як
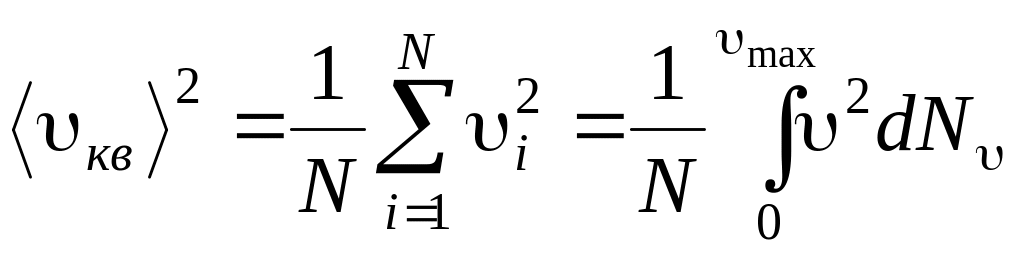 ,
,
і характеризує всю сукупність молекул газу.
Основне рівняння молекулярно-кінетичної теорії ідеальних газів:
![]() .
.
Інші варіанти запису цього рівняння з урахуванням співвідношень
![]() ;
; ![]() ;
;
![]() ;
; ![]() ,
,
де Е – сумарна кінетична енергія поступального руху всіх молекул газу, – молярний об’єм, μ – молярна маса.
Використовуючи
рівняння Клапейрона-Менделєєва, отримаємо
![]() ,
звідки середньоквадратична швидкість
молекул ідеального газу:
,
звідки середньоквадратична швидкість
молекул ідеального газу:
![]() .
.
Середня кінетична енергія поступального руху однієї молекули ідеального газу:
![]() .
.
Звідси
витікає, що
![]() при Т
= 0 К – зупиняється рух молекул газу.
при Т
= 0 К – зупиняється рух молекул газу.
Молекулярно-кінетичне тлумачення температури: термодинамічна температура – міра середньої кінетичної енергії поступального руху молекул газу.
