
- •Содержание
- •Введение
- •Диссоциация электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Ионное произведение воды
- •Расчет рН сильных кислот и оснований
- •Расчет рН слабых бинарных кислот и оснований
- •Влияние сильных электролитов и одноименных ионов на ионные равновесия в слабых электролитах
- •Буферные растворы
- •Гидролиз солей
- •Вопросы и задачи для самостоятельного решения
- •Тест для самоконтроля «Ионные равновесия в гомогенных системах»
- •Равновесия в гетерогенных системах
- •Произведение растворимости
- •Задачи на применение условия выпадения осадка
- •Расчет растворимости осадков в присутствии одноименных ионов
- •Расчет растворимости осадка в присутствии разноименных ионов (солевой эффект)
- •Дробное осаждение
- •Вопросы и задачи для самостоятельного решения
- •Окислительно-восстановительное равновесие
- •Расчет констант равновесия окислительно-восстановительных реакций
- •Расчет окислительно-восстановительного потенциала
- •Вопросы и задачи для самостоятельного решения
- •Равновесия в растворах комплексных соединений
- •Вопросы и задачи для самостоятельного решения
- •Тест для самоконтроля «Ионные равновесия в реакциях осаждения, комплексообразования и окисления-восстановления»
- •Качественный анализ
- •Вопросы и задачи для самостоятельной работы
- •Гравиметрический анализ
- •Расчет количества осадителя
- •Рассчитаем массу 4 %-ного раствора Na2hpo4:
- •Расчет потерь осадка при промывании
- •Выбор оптимального интервала значений рН
- •Расчёт результатов гравиметрического определения
- •0,0623 Г Ag содержится в 125 мл раствора;
- •Вопросы и задачи для самостоятельного решения
- •Титриметрические методы анализа
- •Способы выражения концентраций растворов
- •Определение фактора эквивалентности
- •Пример 2. Какой объем 0,1 н. Раствора серной кислоты необходимо отмерить для приготовления 100 мл 0,02 н. Раствора?
- •Способы титрования
- •Кислотно-основное титрование
- •Выбор индикатора
- •Вопросы и задачи для самостоятельного решения
- •Окислительно-восстановительное титрование
- •Оксидиметрические индикаторы
- •Вопросы и задачи для самостоятельного решения
- •Комплексонометрическое титрование
- •Выбор индикатора и условий проведения анализа
- •Вопросы и задачи для самостоятельного решения
- •Примеры построения кривых титрования
- •Титрование сильных кислот и оснований
- •Титрование слабой кислоты сильным основанием
- •0,40 Моль/л раствором koh.
- •Вопросы и задачи для самостоятельного решения
- •Окислительно-восстановительное титрование
- •Вопросы и задачи для самостоятельного решения
- •Физико-химические методы анализа
- •Потенциометрия и потенциометрическое титрование.
- •Вольтамперометрия
- •Кулонометрия.
- •Вопросы и задачи для самостоятельного решения
- •Спектроскопические методы анализа
- •Фотометрические методы анализа.
- •Вопросы и задачи для самостоятельного решения
- •Атомно-абсорбционная спектроскопия
- •Вопросы и задачи для самостоятельного решения
- •Эмиссионный спектральный анализ
- •Вопросы и задачи для самостоятельного решения
- •Люминесцентный анализ
- •Вопросы и задачи для самостоятельного решения
- •Хроматографические методы анализа
- •Ионообменная хроматография.
- •100,0 ∙ 0,09567 Ммоль NaOh.
- •17,80 ∙ 0,09051 Ммоль щелочи,
- •Газовая хроматография.
- •Вопросы и задачи для самостоятельного решения
- •Метрологические характеристики методов анализа
- •Вопросы и задачи для самостоятельного решения
- •Справочные материалы
- •Коэффициенты активности ионов
- •Коэффициенты активности при высоких значениях ионной силы
- •Относительные атомные массы элементов
- •Растворимость неорганических и некоторых органических соединений в воде
- •Плотности водных растворов некоторых веществ при 20оС
- •Произведения растворимости важнейших малорастворимых веществ
- •Значения рН осаждения гидроксидов металлов
- •Гравиметрические факторы
- •Константы ионизации кислот
- •Константы ионизации оснований
- •Интервал рН перехода важнейших индикаторов
- •Некоторые смешанные индикаторы
- •Стандартные электродные потенциалы (е°) при 25°с
- •Окислительно-восстановительные индикаторы
- •Логарифмы суммарных констант устойчивости комплексных соединений
- •Логарифмы констант устойчивости комплексонатов металлов
- •Литература
расчёт условий растворения и осаждения осадков:
условий количественного осаждения малорастворимого соединения;
условий начала образования осадка;
условий, при которых осадок не выпадает;
прогнозирование возможности выпадения осадка при смешении растворов заданной концентрации (путём сравнения ПР и произведения концентраций ионов над осадком (ПС));
выбор осадителя и осаждаемой формы для конкретного иона;
оценка возможности обнаружения или количественного определения конкретного иона с использованием реакций осаждения.
Численные значения ПР представлены в таблице 6 (Справ. материалов)
При проведении расчетов в гравиметрическом анализе необходимо учитывать следующие положения:
- Осадок выпадает при условии ПС ПР.
- Осадок растворяется при условии ПС < ПР.
- Осаждение считается количественным, если остаточная концентрация осаждаемого иона в растворе не превышает 10–6 моль/л.
- Осадитель должен образовывать с определяемым ионом как можно менее растворимое соединение.
- В качестве осаждаемой формы пригодны только те осадки, для которых ПР 10–8 (для бинарных электролитов).
Пример 1. Какую навеску BaCl22H2O надо взять, чтобы получить 0,5 г BaSO4?
Решение.
BaCl2 + H2SO4 = BaSO4 + 2HCl.
По уравнению реакции из 1 моля BaCl2 получается 1 моль BaSO4.
Определим количество вещества BaSO4:
![]() ;
;
![]() моль;
n(BaSO4)
= n(BaCl22H2O)
= 0,002 моль,
моль;
n(BaSO4)
= n(BaCl22H2O)
= 0,002 моль,
m(BaCl22H2O) = n(BaCl22H2O) M(BaCl22H2O);
m(BaCl22H2O) = 0,002 244,31 = 0,52 г.
Пример 2. При какой концентрации фторид-ионов магний (II) количественно осадится в виде MgF2?
Решение. Равновесие MgF2 Mg2+ + 2F–
характеризуется табличной величиной произведения растворимости:
![]()
Поскольку в насыщенном растворе малорастворимого электролита μ → 0, то активности можно заменить на концентрации.
После подстановки [Mg2+] = 10–6 моль/л получим:
![]()
Пример 3. Выбрать осаждаемую форму и осадитель для гравиметрического определения алюминия (III).
Решение: Из приведённых в таблице осадков, содержащих ион алюминия (III), наименее растворимым является Al(OH)3, следовательно, он является подходящей гравиметрической формой, а в качестве осадителя можно использовать щёлочи либо гидроксид аммония. Однако в избытке щелочей амфотерный гидроксид Al(OH)3 растворяется, поэтому осаждение надо проводить раствором NH4OH.
Пример 4. Можно ли использовать реакцию образования MgC2O4 для количественного определения магния (II) с использованием гравиметрического или перманганатометрического методов анализа ?
Решение: По значению ПР = 8,6·10–5 можно сделать вывод, что осадок MgC2O4 в заметной степени растворим, следовательно, он не может служить осаждаемой формой в гравиметрическом методе анализа и не позволит с достаточной точностью провести титриметрическое определение.
При выборе условий гравиметрического определения также необходимо прогнозировать возможность изоморфного соосаждения ионов. Сопоставляя радиусы осаждаемого и примесного ионов, можно предположить, будет ли происходить загрязнение осаждаемой формы за счет изоморфизма.
При выяснении этого вопроса необходимо учитывать следующие положения:
- изоморфизм наблюдается для ионов с близкими радиусами:
Δr ≤ 10 – 15 %;
- осаждаемый и изоморфно соосаждаемый ионы должны образовывать соединения с одинаковым типом кристаллической решётки.
Пример 5. Требуется провести гравиметрическое определение Ba2+ (осадить BaSO4, взвесить BaSO4) в присутствии микроколичеств Pb2+. Можно ли предполагать загрязнение осаждаемой формы за счет изоморфизма ?
Решение: Ионы Ba2+ и Pb2+ имеют радиусы 0,143 и 0,132 нм соответственно, их сульфаты BaSO4 и PbSO4 имеют одинаковый тип кристаллической решётки. На основании расчёта
Δr = [(0,143 – 0,132) / 0,143]∙100 % = 7,7 %
делаем вывод, что Pb2+ может заместить Ba2+ в кристаллической решётке BaSO4. Следовательно, при проведении анализа необходимо принять меры для уменьшения изоморфизма.
Расчет количества осадителя
Пример 6. Какой объем 4 %-ного раствора Na2HPO4 необходим для практически полного осаждения Mn2+ из раствора, содержащего 0,6452 г
MnSO4 · 4H2O?
Решение. Запишем реакцию осаждения:
2MnSO4 + (NH4)2SO4 + 2Na2HPO4 2MnNH4PO4 + 2Na2SO4 + H2SO4
В соответствии со стехиометрией реакции рассчитаем необходимую массу Na2HPO4:
![]()
m(Na2HPO4) = 0,6452 ∙ 141,96 / 223,06 = 0,4106 г.
Рассчитаем массу 4 %-ного раствора Na2hpo4:
![]()
Принимая плотность раствора Na2HPO4 равной единице, так как 5%, находим необходимый объем осадителя:
Vр-ра (Na2HPO4) = 10,27 мл.
Поскольку осадитель нелетучий, то для практически полного осаждения необходимо взять его полуторакратный избыток, т. е. 10,27 ∙ 1,5 = 15,40 мл.
Расчет потерь осадка при промывании
При промывании осадка водой и другими промывными жидкостями часть осадка переходит из твердой фазы в раствор. Потери при промывании можно рассчитать исходя из произведения растворимости осадка, объема раствора и состава промывной жидкости.
Так как переход осадка в раствор при промывании происходит постепенно и равновесие этого процесса устанавливается во времени, то вводится понятие «насыщаемости». Например, насыщаемость раствора при промывании осадка BaSO4 составляет 80%. Для того чтобы определить потери осадка при этом условии, необходимо принять количество растворенного BaSO4, рассчитанное на основании ПР, за 100%.
Задачи необходимо решать в следующем порядке:
Записать уравнение химического равновесия осадка с ионами в насыщенном растворе и выражение для ПР осадка.
Если в качестве промывной жидкости используется раствор сильного электролита, то необходимо привести уравнение его диссоциации. Определить, какие ионы содержит раствор электролита: общие (одноименные) с осадком или другие (разноименные). Сделать вывод о влиянии ионов электролита на растворимость осадка (влияние одноименного иона или солевой эффект).
Затем рассчитать концентрацию перешедшего в раствор соединения или иона при условии полного насыщения раствора.
Далее рассчитать величину, указанную в условии задачи, с учетом взятых для промывки объемов и насыщаемости промывного раствора.
Выбор оптимального интервала значений рН
Значения рН начала осаждения гидроксидов металлов, практически полного их осаждения, а также начала растворения и полного растворения осадков амфотерных гидроксидов необходимо учитывать в случаях обнаружения, разделения и количественного определения ионов многовалентных металлов.
Пример 7. В какой среде можно оттитровать комплексонометрически ион Fe3+ при его концентрации в растворе ~ 0,01 моль/л ?
Решение:
Поскольку гидроксид железа (III) из 0,01 М раствора начинает осаждаться при рН = 2,3, то титрование можно провести только в кислой среде.
Пример 8. Можно ли разделить ионы Cr3+ и Mg2+ при их концентрациях 0,01 моль/л, регулируя значение рН раствора ?
Решение: Cr(OH)3 практически полностью осаждается при рН = 6,8, а начинает растворяться при рН = 9,4. Mg(OH)2 начинает осаждаться при рН = 10,4, полнота осаждения его достигается при рН = 12,4. Следовательно, в интервале 6,8 < рН < 9,4 ион Cr3+ будет находиться в осадке, а ион Mg2+ – в растворе, т. е. разделение возможно.
Расчёт результатов гравиметрического определения
Массу определяемого компонента (Х) в анализируемом образце можно рассчитать по уравнению реакции, если известна масса гравиметрической формы (ГФ). Часто в таких расчетах используют гравиметрический фактор (F), представляющий собой отношение молярной массы определяемого компонента к молярной массе гравиметрической формы с учетом стехиометрических коэффициентов:
![]()
Для определения гравиметрического фактора следует составить стехиометрическую схему (определяемый компонент → гравиметрическая форма) и расставить коэффициенты.
Пример 9: При определении Fe3+ в качестве гравиметрической формы получают Fe2O3. Вычислить гравиметрический фактор.
Решение: В соответствии со стехиометрией,
2 Fe3+ → Fe2O3 (а = 2, b = 1)
![]() .
.
Значения F для многих методик гравиметрического анализа приведены в табл. 9 (Справ. материалов) и могут быть использованы при решении задач.
Пример 10. Рассчитать содержание NH4+ в пробе, если после проведения гравиметрического определения по схеме NH4+ → (NH4)2PtCl6 → Pt масса гравиметрической формы (Pt) составила 0,0243 г.
Решение: Воспользуемся табличным значением F = 0,1849 для этого случая анализа:
m(NH4+) = m(Pt)·F = 0,0243·0,1849 = 0,0045 г.
Пример 11. Рассчитать массовую долю серебра в сплаве, если для анализа взята навеска m1 = 0,4368 г, которая переведена в раствор (V1=300 мл), а из аликвоты (V2 = 125 мл) получено m2 = 0,0958 г Ag2CrO4.
Решение: Массовая доля серебра рассчитывается по формуле
= m (Ag)/m1 · 100%.
Для определения m (Ag) запишем схему анализа и установим стехиометрические соотношения между соединениями:
2 Ag Ag2CrO4.
Рассчитаем гравиметрический фактор F :
![]()
Массу серебра определим следующим образом:
m′(Ag) = m(гравиметр. формы) ∙ F = 0,0958 · 0,6503 = 0,0623 г;
0,0623 Г Ag содержится в 125 мл раствора;
х г Ag содержится в 300 мл раствора,
тогда полное содержание Ag рассчитаем по формуле
m(Ag) = m′(Ag) ∙ V1/V2 = 0,0623 ∙ 300/125 = 0,1495 г.
Отсюда массовая доля серебра в сплаве
= (0,1495/0,4368) ∙ 100% = 34,23%.
Вопросы и задачи для самостоятельного решения
В чем сущность весового анализа?
Какие операции производят при весовом анализе?
Каковы правила взвешивания на аналитических весах?
Как следует вести запись результатов весового анализа?
Какие химические реакции могут быть использованы в весовом анализе?
Приведите примеры весового анализа полупроводников и диэлектриков.
Что называют осаждаемой формой?
Перечислите основные требования, предъявляемые к осаждаемой форме.
Что понимают под практически полным осаждением? Какие потери
допустимы при количественном осаждении?
В виде какого соединения выгоднее произвести осаждение ионов Ba2+: BaCO3, BaC2O4, BaSO4 или BaCrO4 и почему?
Что называют весовой формой? Каким требованиям должна удовлетворять весовая форма? Укажите достоинства и недостатки следующих весовых форм: Fe2O3, BaSO4, CaC2O4, CaO, Mg2P2O7.
Каким реактивом (NaOH или NH4OH) целесообразно осаждать гидроксид железа (III), меди (II), алюминия (III) и почему?
Что подразумевается под созреванием (старением) осадка? Какие процессы происходят при созревании осадка?
Условия осаждения кристаллических осадков. Примеры осаждения кристаллических осадков.
При каких условиях нужно производить осаждение аморфных осадков? Сопоставьте условия осаждения аморфных и кристаллических осадков.
Укажите типы соосаждения и меры борьбы с ними.
Прокаленный тигель, взвешенный на весах АДВ-200, уравновешен гирьками. На чашку весов поместили 9 г, а на планку навесили (поворотом ручки) кольца 200+200+50+10 мг. При этом стрелка весов остановилась против деления +7,8 на микрошкале. Определите массу тигля.
18. Какова концентрация бромид-ионов в растворе, полученном при сливании равных объемов 0,105 М раствора бромида калия, 1,1·10–2 М раствора бромида кадмия и 2,03·10–2 М HBr?
Ответ: 0,147 М.
19. Сколько граммов меди содержится в растворе, полученном при сливании по 0,5 л 3·10–5 и 4,05·10–4 М растворов сульфата меди?
Ответ: 1,38·10–2 г.
20. Вычислить произведение растворимости СаСO3, если в 1 л насыщенного раствора при 25 °С содержится 6,93·10–2 г этой соли.
Ответ: 4,8·10–9.
21. Произведения растворимости при 25 °С PbSO4, MgCO3, BaCrO4 и составляют:
П![]() ПР
ПР![]()
ПР![]() ПР
ПР![]()
Определить концентрации ионов: а)Pb2+, б) Mg2+, в) Ba2+ и г) Zn2+ в граммах на литр насыщенного раствора каждой из перечисленных солей.
Ответ а) 2,8·10–2 г/л; б)7,7·10–2 г/л; в)2,1·10–3 г/л; г)8,8·10–3 г/л.
22.
Сколько граммов: а)иона Pb2+
и б) иона I–
содержится в1 мл насыщенного раствора
РbI2,
если при 25 °С ПР![]() ?
?
Ответ: а) 2,7·10–4 г/мл; б) 3,3·10–4 г/мл.
23. Растворимость СаС2О4 при 18 °С равна 4,2·10–4 моль/л. Вычислить произведение растворимости этой соли при той же температуре.
Ответ: 2,3·10–9.
24. Растворимость Аg3РО4 при 20 °С равна 2,0·10–3 г/л. Вычислить произведение растворимости этой соли при той же температуре.
Ответ: 1,4·10–20.
25.
Сколько граммов иона Ag+
находится в 1 л насыщенного раствора
Ag2SO4,
если ПР![]() Можно
ли количественно определять серебро в
виде его сульфата?
Можно
ли количественно определять серебро в
виде его сульфата?
Ответ: 5,76 г. Нельзя.
В растворе бромида натрия осадили бром в виде AgBr. После высуши
вания масса осадка была равна 0,2510 г. Вычислите содержание NaBr в растворе.
Ответ: 0,1375 г.
В навеске 0,1341 г хлорида калия, загрязненного хлоридом натрия, оп
ределяли содержание калия осаждением в виде KClO4, масса которого оказалась равной 0,2206 г. Вычислите процентное содержание KCl в исследуемом образце хлорида калия.
Ответ: 88,52 %.
При определении хлора взвешиванием его в виде AgCl обычно желательно, чтобы масса осадка была около 0,5 г. Какую требуется взять для та
кого определения навеску вещества, содержащего около 15 % хлора?
Ответ: 0,8 г.
Сколько миллилитров раствора аммиака плотность 0,99 г/см3, содер
жащего 2,5 вес % NH3, нужно взять для осаждения железа из раствора, полученного при растворении 1 г железоаммонийных квасцов (NH4)2Fe(SO4)212H2O?
Ответ: с полуторным избытком приблизительно 6 мл.
Сколько миллилитров 0,25 М раствора (NH4)2C2O4 потребуется для
осаждения Ca2+ из раствора, полученного при растворении 0,7 CaCO3?
Ответ: с полуторным избытком приблизительно 42 мл.
Вычислите факторы пересчета для определения: а) количества серы по
массе BaSO4; б) количества серебра по массе Ag2S; в) количества цинка по массе Zn2P2O7.
Ответ: а) 0,1374; б) 0,8704; в) 0,4291.
Вычислите факторы пересчета для определения: а) количества
BaCl22H2O по массе BaSO4; б) количества Ca3(PO4)2 по массе Mg2P2O7; в) количества Cr2O3 по массе PbCrO4.
Ответ: а) 1,047; б) 1,844; в) 0,2352.
Произведение растворимости Pb3(PO4)2 при 25 C равно 7,910-43. Вычислите растворимость этой соли (в г/л) и концентрацию каждого из ионов в насыщенном растворе при той же температуре.
Ответ: [Pb3(PO4)2] = 1,2210-6 г/л; [Pb2+] = 9,110-7 г/л; [PO43-] = 2,710-7 г/л.
По растворимости PbSO4 и PbI2, равной соответственно 0,045 и
0,300 г/л, вычислите величины произведений растворимости этих солей.
Ответ: 2,210-8; 1,110-9.
Растворимость AgNO2 равна 1,95 г/л. Вычислите точное значение
 с
учетом коэффициентов активности ионов.
с
учетом коэффициентов активности ионов.
Ответ: ПР = 1,610-4.
Во сколько раз растворимость CaC2O4 в 0,01 М растворе (NH4)2C2O4
меньше растворимости его в чистой воде: а) без учета коэффициентов активности; б) с учетом коэффициентов активности?
Ответ: а) в 200 раз; б) приблизительно в 78 раз.
Вычислить растворимость осадка Ag2CrO4, а также [Ag+] и [CrO42-]
(в
г/л) с учетом коэффициентов активности
этих ионов.
![]()
Ответ: [Ag2CrO4] = 0,023 г/л; [CrO42-] = 0,0081 г/л; [Ag+] = 0,0150 г/л.
38. Вычислить солевой эффект 0,05 М раствора KNO3 и его влияние на растворимость роданида серебра (ПРAgCNS =1,110-12).
Ответ: 1,2410-6 моль/л.
39. При анализе медной соли найдено, что она содержит 64,19 % меди и 35,81 % хлора. Вычислите эмпирическую формулу этой соли.
Ответ: CuCl.
40. В веществе, содержащем только магний, фосфор и кислород, при анализе было найдено 36,23 % MgO и 63,77 % P2O5. Найдите эмпирическую формулу этого вещества.
Ответ: 2MgOP2O5.
Титриметрические методы анализа
Так как в титриметрии используют стандартные растворы титрантов с известной концентрацией, необходимо знать способы выражения концентраций и уметь делать пересчеты концентраций и расчеты, связанные с приготовлением стандартных растворов и их разбавлением.
Способы выражения концентраций растворов
В титриметрии используются следующие способы выражения концентрации растворов:
- молярная концентрация эквивалента (нормальная концентрация) – показывает, сколько молей эквивалента вещества содержится в 1 л раствора. Например, С (1/2 H2SO4) = 0,1 моль/л, С (1/5 KMnO4) = 0,05 моль/л.
- молярная концентрация – показывает, сколько молей вещества содержится в 1 л раствора. Например, С (H2SO4) = 0,2 моль/л.
- титр – показывает, сколько граммов вещества A содержится в 1 мл раствора, или
![]()

где C(1/Z A) – молярная концентрация эквивалента вещества А;
M(1/Z А) – молярная масса эквивалента вещества А.
Например, Т (H2SO4) =0,002374 г/мл.
- титр по определяемому веществу – показывает, сколько граммов определяемого вещества А можно оттитровать 1 мл раствора титранта В,
![]()

где C(1/Z A) – молярная концентрация эквивалента вещества А;
M(1/Z B) – молярная масса эквивалента вещества В,
1/Z – фактор эквивалентности, выраженный через число эквивалентности – z.
Например, Т(HСl/CaCO3) = 0,008137 г/мл, т. е. 1 мл раствора HCl вступает в реакцию с 0,008137 г CaCO3.
Определение фактора эквивалентности
Для проведения расчетов в титриметрии пользуются понятием эквивалента и фактора эквивалентности. Эквивалентом называют условную частицу вещества, равноценную в данной реакции одному иону водорода или одному электрону. Фактор эквивалентности (fэкв., 1/Z) определяет долю реальной частицы вещества, по которой рассчитывается эквивалент. В расчетах, связанных с определением фактора эквивалентности и молярной массы эквивалента, прежде всего необходимо учитывать тип протекающей реакции.
В кислотно-основной реакции эквивалент кислоты или основания – такая условная частица вещества, которая в данной реакции высвобождает один ион водорода или соединяется с ним, или каким-либо образом эквивалентна ему. Например, рассчитаем fэкв.(CaCO3) в реакции
CaCO3 + 2H+ + 2Cl– = H2CO3 + Ca2+ + 2Cl–
Отсюда fэкв.(CaCO3) = 1/Z = 1/2 , а молярная масса эквивалента = = М(1/2 CaCO3) = М(CaCO3) ∙ 1/2.
В реакции окисления-восстановления эквивалент окисляющегося или восстанавливающегося вещества – это такая условная частица вещества, которая может присоединять или отдавать один электрон в данной химической реакции. Для примера определим fэкв.(Na2S2O3) и продукта его окисления – иона S4O62–, используя полуреакцию
2S2O32– – 2ē S4O62–,
в которой участвуют два электрона. Один ион S2O32– отдает 1 электрон, т. е. fэкв.(S2O32–) = fэкв.(Na2S2O3) = 1, а один ион S4O62– присоединяет 2 электрона
(z = 2), и fэкв.( S4O62–) = fэкв.(Na2S4O6) = 1/Z = 1/2 .
В комплексонометрии комплексон III (синонимы – ЭДТА, трилон Б), представляющий собой двунатриевую соль этилендиаминтетрауксусной кислоты – Na2H2Y, в водном растворе диссоциирует с образованием ионов H2Y2–. Для определения fэкв.(комплексона III) и fэкв.(Меn+) используем реакцию
H2Y2– + Меn+ МеY2– + 2 Н+
В результате замещения выделяется 2Н+, отсюда следует, что fэкв.(комплексона III) равен 1/2. Особенностью реакции является то, что при взаимодействии H2Y2– с ионами металлов в разной степени окисления (n>2) всегда освобождаются только 2 иона водорода (z = 2), и в этом случае fэкв.(комплексона III) = fэкв.(Меn+)= 1/2. Например, при титровании иона Al3+ комплексоном III:
H2Y2– + Al3+ AlY– + 2 Н+, и fэкв.(Al3+) = 1/2.
В случае, если одновременно используются реакции различных типов, например осаждения и окисления-восстановления, комплексообразования и окисления-восстановления и т. д., фактор эквивалентности определяется с помощью пропорции. Расчет фактора эквивалентности показан в
Примере 1раздела «Окислительно-восстановительное титрование».
Пример 1. Для стандартизации раствора HNO3 навеску 1,7594 г Na2B4O7 · 10H2O растворили в мерной колбе вместимостью 100,0 мл. На титрование аликвотной части (V = 15,0 мл) этого раствора затрачено 12,7 мл раствора HNO3. Вычислить молярную концентрацию, молярную концентрацию эквивалента и титр раствора кислоты.
Решение. При титровании протекает следующая реакция:
2HNO3 + Na2B4O7 +5H2O 2NaNO3 + 4H3BO3
Значит, фактор эквивалентности Na2B4O7 · 10H2O равен 1/2. Рассчитаем концентрацию приготовленного раствора тетрабората натрия по формуле
С = m/(M · V),
где С – молярная концентрация эквивалента, моль/л; m – масса, г; М – молярная масса эквивалента, г/моль; V – объем раствора, л.
М(1/2 Na2B4O7 · 10H2O) = 190,69 г/моль;
С(1/2 Na2B4O7 · 10H2O) =1,7594/(190,69 · 0,1) = 0,09226 моль/л.
По закону эквивалентов рассчитаем молярную концентрацию эквивалента раствора HNO3:
С(1HNO3) = 15,0 ∙ 0,09226/12,7 = 0,1090 моль/л.
Фактор эквивалентности (fэкв.) HNO3 равен единице, поэтому значение молярной концентрации HNO3 совпадает со значением молярной концентрации эквивалента. Титр раствора кислоты рассчитываем по формуле

М(HNO3) = 63,013 г/моль [3];
![]()
Пример 2. Какой объем 0,1 н. Раствора серной кислоты необходимо отмерить для приготовления 100 мл 0,02 н. Раствора?
Решение.
Т.к. количество молей эквивалентов H2SO4
в исходном и приготовленном растворах
одинаково, то, в соответствии с законом
эквивалентов, объем исходного раствора
V1
=
![]() =
=![]() =20
мл.
=20
мл.
Пример 3. Какой объем 12%-ного раствора H2SO4 потребуется для приготовления 1 л 0,1н. раствора этой кислоты.
Решение. Масса серной кислоты в 1 л 0,1н. раствора составляет
![]() =
=
![]() =
490,11=4,9
г.
=
490,11=4,9
г.
Такая
масса H2SO4
содержится в 40,83 г 12%-ного раствора в
соответствии с формулой:
![]() =40,83
г.
=40,83
г.
Плотность
исходного раствора по данным табл.5
(Спр. матер.) составляет
=1080,0 г/л.
Следовательно, для приготовления 1 л
0,1н. раствора H2SO4
потребуется
![]() =
=![]() =0,0378
л или 37,8 мл 12%-ного раствора.
=0,0378
л или 37,8 мл 12%-ного раствора.
Пример 4. Плотность водного раствора NaCl = 1095,0 г/л. Определить массовую долю соли в растворе, рассчитать молярную долю NaCl, молярную концентрацию, молярную концентрацию эквивалента соли, моляльную концентрацию и массовую концентрацию раствора.
Решение. Для определения массовой доли соли в растворе используем данные табл.5 (Спр. матер). Т.к. заданное значение плотности раствора NaCl в таблице отсутствует, применяем метод интерполяции. Для этого используем ближайшие меньшее и большее значения плотностей и соответствующие им массовые доли раствора данной соли. Считая, что в указанных пределах зависимость между плотностью и массовой долей раствора линейная, рассчитаем массовую долю растворенного вещества в растворе по пропорции (индекс б означает "большее", м - "меньшее"):
![]() .
.
По данным табл.5 б = 1100,9 г/л; б= 0,14; м = 1085,7 г/л; м = 0,12.
Соответственно:
![]() .
.
Решая уравнение, получим =0,132 (или 13,2%).
При расчете молярной доли соли в растворе и других концентраций удобно использовать следующие соотношения: масса раствора – 100 г, следовательно, масса растворенного вещества т = 13,2г, а масса воды (растворителя) ms = 86,8 г = 0,0868 кг. В таком растворе число молей NaCl составит:
nNaCl
=![]() =0,2256
моль,
=0,2256
моль,
а
число молей воды
 =4,8222
моль.
=4,8222
моль.
Следовательно, молярная доля NaCl:
![]() =0,045.
=0,045.
Рассчитаем моляльную концентрацию:
Сm
=
![]() =2,6
моль/кг.
=2,6
моль/кг.
Раствор массой 100 г занимает объем:
V=![]() =0,0926
л,
=0,0926
л,
следовательно молярная концентрация:
С=
![]() =2,48моль/л,
=2,48моль/л,
молярная концентрация эквивалента:
Сэкв=![]() =2,48
моль экв/л,
=2,48
моль экв/л,
массовая концентрация:
Смасс
=
![]() =144,54
г/л.
=144,54
г/л.
Пример 5. В мерную колбу вместимостью 250 мл поместили 10,0 мл смеси серной и фосфорной кислот, содержимое довели до метки. В две колбы для титрования поместили по 15,0 мл полученного раствора. На титрование первой пробы с метиловым оранжевым израсходовали 27,4 мл раствора NaOH с концентрацией 0,09678 моль/л. На нейтрализацию второй пробы в присутствии фенолфталеина затратили 33,2 мл раствора NaOH той же концентрации. Рассчитать массу серной и фосфорной кислот в исходной смеси.
Решение. Кривые титрования серной и фосфорной кислот показывают, что изменение окраски метилового оранжевого произойдет, когда H2SO4 будет оттитрована по двум ступеням и H3PO4 – по первой ступени. При этом протекают реакции:
H2SO4 + 2NaOH = Na2SO4 + 2H2O H3PO4 + NaOH = NaH2PO4 + H2O; |
} |
VT = 27,4 мл. |
Окрашивание фенолфталеина произойдет, когда полностью оттитруется H2SO4, а H3PO4 будет оттитрована по двум ступеням:
H2SO4 + 2NaOH = Na2SO4 + 2H2O H3PO4 + 2NaOH = Na2HPO4 + 2H2O |
} |
VT = 33,2 мл. |
Следовательно, разность объемов соответствует количеству титранта, пошедшему на титрование H3PO4 по одной ступени.
Рассчитаем объем раствора NaOH, пошедшего на титрование фосфорной кислоты по одной ступени:
V = 33,2–27,4 = 5,8 мл.
По закону эквивалентов определим концентрацию фосфорной кислоты в растворе:
С = 0,09678 ∙ 5,8/15,0 = 0,03742 моль/л; М(H3PO4) = 97,9952.
Расчет проведен на основании результатов титрования по одной ступени, следовательно, фактор эквивалентности H3PO4 равен 1. В 250,0 мл раствора и в 10,0 мл анализируемой смеси содержится одинаковое количество H3PO4:
m(H3PO4) =0,03742 ∙ 250,0 ∙ 10–3 ∙ 97,9952 = 0,9168 г.
Объем, пошедший на титрование H2SO4, можно рассчитать, отняв от объема, пошедшего на титрование смеси в присутствии метилового оранжевого, объем, затраченный на титрование H3PO4 по одной ступени. Так, Vр–ра (NaOH), пошедший на титрование серной кислоты:
Vр–ра (NaOH) = 27,4 – 5,8 = 21,6 мл.
Фактор эквивалентности H2SO4 равен ½, так как титрование проходило по двум ступеням. Вычислим концентрацию и массу H2SO4:
С(1/2 H2SO4) = 0,09678 ∙ 21,6/15,0 = 0,1394 моль/л;
m(H2SO4) = 0,1394 ∙ 250,0 ∙ 10–3 ∙ (1/2 98,078) = 1,7086 г.
Способы титрования
Расчеты результатов анализа зависят от способов титрования. Различают методы прямого титрования, обратного и по заместителю.
В методе прямого титрования к некоторому объему анализируемого вещества (Vх) непосредственно добавляют титрант с известной молярной концентрацией эквивалента (СТ). Определив объем титранта (VТ) в т. э., рассчитывают молярную концентрацию эквивалента (Сх) или количество молей эквивалента анализируемого вещества (nх) по закону эквивалентов:
Сх ∙ Vх = СТ ∙ VТ;
nх = nТ;
nх = СТ ∙ VТ.
Массу определяемого вещества (mx) рассчитывают по формуле
mx = nх ∙ M(1/ZX) ∙ cТ ∙ VТ ∙ M(1/ZX),
где M(1/Z X) – молярная масса эквивалента определяемого вещества.
Метод обратного титрования заключается в прибавлении к раствору анализируемого вещества избытка точно известного количества стандартного раствора В и после завершения реакции между ними титровании оставшегося количества вещества В раствором титранта С. Количество молей эквивалента определяемого вещества равно разности между количеством молей эквивалента веществ В и С:
nх = nВ – nС.
В методе титрования по заместителю к определяемому веществу добавляют реагент, вступающий с ним в реакцию. Затем один из продуктов взаимодействия (В) оттитровывают титрантом С. Количество молей эквивалента определяемого вещества при титровании заместителя всегда равно количеству молей эквивалента титранта:
nх = nВ = nС.
Кислотно-основное титрование
В случае кислотно-основного титрования необходимо уметь решать следующие аналитические задачи:
расчёт рН в растворах:
слабых кислот, слабых оснований и их солей;
многоосновных кислот, многокислотных оснований и их солей;
буферных смесей;
расчёт кривых кислотно-основного титрования;
прогнозирование возможности титрования слабых кислот, слабых оснований и их солей;
прогнозирование числа точек эквивалентности и числа скачков на кривых титрования многоосновных кислот, многокислотных оснований и их солей;
расчёт кислотной, основной и солевой ошибок титрования.
Пример 6. Определить массу Na2CO3 в 250,0 мл раствора, если на титрование 25,00 мл этого раствора с индикатором метиловым оранжевым израсходовано 20,20 мл раствора HCl с концентрацией 0,1010 моль/л.
Решение: Прямое титрование. Навеска определяемого вещества или аликвотная часть анализируемого раствора титруется непосредственно титрантом.
Определяем молярную массу эквивалента Na2CO3. C данным индикатором титрование идет по реакции:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2(г)
Фактор эквивалентности Na2CO3 равен 1/2. Закон эквивалентов в этом случае имеет вид:
n(1/2Na2CO3) = n(HCl) и M(1/2Na2CO3) = 53,00 г/моль.
m(Na2CO3) = n(1/2Na2CO3) ∙1/2M(Na2CO3)
Количество вещества эквивалентов HCl равно
n(HCl) = C(HCl) ∙ V(HCl)
Объем титранта переводится в литры и учитывая, что на титрование взята аликвотная часть исследуемого раствора равная отношению
Vколбы/Vпипетки = 250/25, получаем:
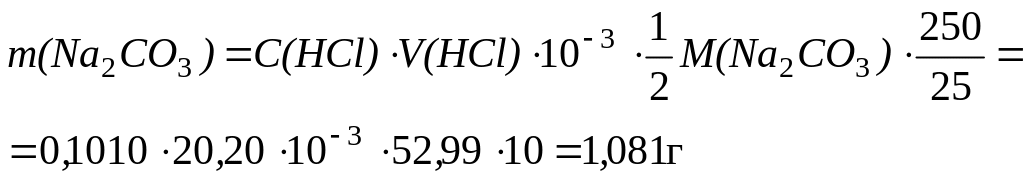
Пример 7 Титрование по остатку (обратное). Образец аммония хлорида массой 0,1500 г растворили в воде, добавили 30,00 мл 0,1150 моль/л раствора KOH и полученный раствор прокипятили до полного удаления аммиака. На титрование остатка избытка щелочи израсходовано 6,30 мл раствора серной кислоты с молярной концентрацией эквивалента 0,1050 моль/л. Определить массовую долю аммиака в образце.
Решение: В данном способе титрования к определяемому раствору добавляется известный избыток титранта (I). Затем избыток непрореагировавшего титранта (I) оттитровывают титрантом (II). Закон эквивалентов для обратного титрования имеет вид:
![]()
Фактор эквивалентности аммиака в реакциях кислотно-основного взаимодействия равен единице. М(NH3) = 17,03 г/моль.
Записываем закон эквивалентов
n(KOH) = n(NH3) + n(1/2H2SO4)
n(NH3) = C(KOH) ∙ V(KOH) ∙ 10-3 – C(1/2H2SO4) ∙ V(H2SO4) ∙ 10-3
10-3 - пересчет объемов титрантов в литры.
m(NH3) = (0,1150 ∙ 30,00 ∙ 10-3 – 0,1050 ∙ 6,30 ∙ 10-3) ∙ 17,03 = 0,04748г
![]()
Выбор индикатора
Основная количественная характеристика индикатора – интервал перехода окраски индикатора. Выбор индикатора осуществляется в соответствии с правилом:
«Интервал перехода индикатора (ΔрН) должен полностью или частично укладываться в пределы скачка кривой титрования»
или
«Показатель титрования (рТ) индикатора должен лежать в пределах скачка кривой титрования».
Кроме того, значение рТ двухцветного индикатора, которое можно рассчитать по табличному значению интервала перехода, используют для расчёта индикаторных ошибок всех типов: водородной, гидроксильной, кислотной, основной и солевой.
При решении этой задачи учитывают следующие положения:
- ΔрН 2 ед. рН;
- для двухцветных индикаторов значение рТ примерно равно середине интервала перехода;
- индикаторная ошибка титрования (δ) минимальна, если показатель титрования индикатора практически совпадаетсо значением рН в точке эквивалентности;
- если δ 0,2 %, то индикатор выбран правильно, а если δ 0,2 %, то неправильно.
Если скачок кривой титрования выражен слабо (величина скачка < 2 ед. рН), то нельзя провести титрование с требуемой точностью, используя обычные кислотно-основные индикаторы. В этом случае можно использовать только смешанные индикаторы, которые имеют гораздо более узкий интервал перехода ΔрН = 0,1–0,2 ед. рН.
Вопросы и задачи для самостоятельного решения
Что называется концентрацией раствора?
Что называется молярной массой эквивалента, что обозначает фактор эквивалентности?
Какие растворы называются нормальными, децинормальными, сантинормальными?
Как приготовить 200 л 0,01 Н раствора щелочи NaOH?
Вычислите нормальную концентрацию раствора серной кислоты, если титр раствор кислоты равен 0,0049 г/мл.
Какая реакция лежит в основе метода нейтрализации?
Что такое точка эквивалентности и как она фиксируется?
Что называется индикатором? Какие индикаторы применяются в методе нейтрализации? Что такое область перехода индикатора?
Что называется ионным произведением воды? Как вычислить концентрацию ионов гидроксила при известной концентрации ионов водорода?
Что такое водородный показатель? РН растворов 2,4,9,11,12, какой их
этих растворов более кислый, какой – более щелочной?
Концентрация ионов водорода равна 10-6 моль\л. Вычислите величину
рН, концентрацию ионов гидроксила [OH–]. Какую окраску будут иметь индикаторы метилоранж, лакмус, фенолфталеин?
На нейтрализацию 15 мл 0,90 Н раствора щелочи КОН израсходовано
18,00 мл раствора кислоты H2SO4. Вычислите нормальную концентрацию и титр раствора серной кислоты.
Что такое рабочий (стандартный, титрованный) раствор? Какие концен-
трации рабочих растворов обычно используют в методе нейтрализации?
Дать определение понятий: титр, нормальность, титр по определяемому
веществу. Написать формулы для расчета результатов титрований: а) прямого, б) обратного, в) по методу замещения, если концентрация рабочего раствора выражена в единицах нормальности.
15. Определить молярную массу эквивалента в реакциях нейтрализации следующих веществ: а) КОН ; б) КНSО4; в) К2О; г) Н2SО4; д) N2О5;
Ответ: а) 56,10; б) 136,2; в) 47,10; г) 49,04; д) 54,01
16. Каковы молярные массы эквивалента следующих веществ:
а) Nа2СО3 при титровании по фенолфталеину (до NаНСО3) или при титровании по метиловому оранжевому (до Н2СО3);
б)NaНСО3 при титровании до Н2СО3 или до Nа2СО3;
в) Н3РО4 при титровании по фенолфталеину (до Nа2НРО4);
г) В2О3 при титровании Н3ВО3 раствором NаОН в присутствии фенолфталеина и глицерина (до комплекса NаН2ВО3 с глицерином);
д) азота при определении в виде NН3, когда аммиак поглощается раствором НСl, а затем избыток последнего оттитровывается раствором NаОН.
Ответ: а) 106; 53,00; б) 84,01; 84,01; в) 49,00; 98,00; г) 34,82 (В2О3 соответствует 2Н+); д) 14,008 (1м.NН3 – 1 мол НСl).
17. Сколько граммов Н2SО4 реагируют с 10.0 мл 0,12 н раствора Ва(ОН)2?
Ответ:58,8·10–3 г.
18. Из 2,500 г Nа2СО3 приготовлено 500 мл раствора, Рассчитать для этого раствора концентрации: а) нормальную, б) молярную, в) титр и г) титр по НСl.
Ответ :а) 0,0943 н ; б) 0,0472 М; в) 0,005000 г/мл; г) 0,003440 г/мл;
19. Какова нормальная и молярная концентрация раствора Н2SО4, титр которого равен 0,005122 ?
Ответ: 0,1044 н или 0,0522 М.
20.
Какова нормальная и молярная концентрация
раствора Ва(ОН)2
с Т![]()
Ответ:0,2000 н.
21.
а) Каков Т![]() для
0,1125 н раствора НСl
? б) Вычислить для 0,1125 н раствора НСl
молярную концентрацию, титр по НСl
и титр по СаО.
для
0,1125 н раствора НСl
? б) Вычислить для 0,1125 н раствора НСl
молярную концентрацию, титр по НСl
и титр по СаО.
Ответ: а) 0,001915 г/мл; б) 0,1122 М; 0,004091 г/мл и 0,003146 г СаО/мл.
22. Сколько граммов щелочи следует взять для приготовления 700 мл 0,15 н раствора ?
Ответ:4,2 г.
23.
Сколько граммов щелочи, содержащей 92%
NaOH
и 8% индифферентных примесей следует
взять для приготовления 1,5 л раствора
с Т![]() =
0,00300 ?
=
0,00300 ?
Ответ:7,0 г.
24. Какова нормальная концентрация раствора НСl, если на титрование 0,1946 г х.ч. Nа2СО3 идет 20,45 мл этого раствора?
Ответ:0,1795 н.
25. Какова молярная концентрация раствора Н2SО4, если на титрование 0,4519 г буры (Nа2В4О7·10Н2О) идет 16,43 мл этого раствора?
Ответ:0,0721 М.
26. На 1,025 г Н2С2О4·2Н2О идет 24,10 мл раствора NaOH. Рассчитать: а) титр этого раствора, б) его титр по Н2С2О4 и в) его нормальную концентрацию.
Ответ: а) 0,02699 г/мл; б) 0,03037г Н2С2О4/мл; в) 0,6748н.
27. При титровании на 20 мл раствора НСl с Т = 0,003512 израсходовано 21,12 мл раствора NaOH. Вычислить:
а)
Т![]() б) Т
б) Т![]() в) Т
в) Т![]() .
.
Ответ: а) 0,003325; б) 0,003647; в) 0,004470.
28. Из 6,227 г буры приготовлено 250 мл раствора. 25,00 мл этого раствора реагируют с 24,17 мл раствора НСl. Рассчитать нормальную концентрацию растворов: а) буры и б) НСl.
Ответ: а) 0,1306 н ; б) 0,1352 н.
29. Сколько миллиграммов НСl содержится в растворе, если на нейтрализацию его идет 22,00 мл 0,1140 М раствора Nа2СО3?
Ответ: 182,8 мг.
30. Сколько миллиграммов Ва(ОН)2 содержится в растворе, если на нейтрализацию его идет 20,00 мл 0,1245 н раствора НСl?
Ответ: 213,3 мг.
31. Сколько миллиграммов Nа2СО3 содержится в растворе, если на нейтрализацию его до Н2СО3 идет 23,00 мл 0,1020 н раствора НСl?
Ответ: 124,3 мг.
32. Титр соляной кислоты по СаО равен 0,005670. Сколько мл этой кислоты требуется для нейтрализации 0,200 г СаО?
Ответ: 35,3 мл.
33. Сколько мл раствора КОН с титром 0,01111 требуется для нейтрализации 25,00 мл раствора НСl с титром 0,007777?
Ответ: 26,93 мл.
34. В 20 мл раствора НСl с титром 0,007860 было пропущено некоторое количество NН3. Избыток НСl оттитровали 6.30 мл раствора NaOH, 1 мл которого эквивалентен 1.025 мл раствора НСl. Определить количество NН3, поглощенного раствором НСl.
Ответ: 0,0866 г.
35. К 0,1500 г известняка, содержащего кроме СаСО3 примеси, не реагирующие с кислотой, прибавлено 20 мл 0,2060 н раствора НСl, после чего избыток кислоты оттитрован 5,60 мл раствора NaOH, 1 мл которого эквивалентен 0,975 мл раствора НСl. Определить процентное содержание СО2 в известняке.
Ответ: 43,9%.
36. К раствору (NH4)2SO4 было добавлено 25,00 мл раствора NaOH (TNaOH = 0,009021). Затем кипячением из раствора был удален NH3; на оттитровывание оставшегося избытка NaOH пошло 6,30 мл HCl (THCl 0,007860) .Вычислить содержание (NH4)2SO4 в растворе.
Ответ: 261,4 мг.
Окислительно-восстановительное титрование
В отличие от других типов реакций, для характеристики окислительно-восстановительных реакций (ОВР) чаще используют не константу равновесия, а стандартный электродный потенциал Е0. Численные значения Е0 приведены в табл.14 (Справ. материалы) и используются при решении следующих задач:
определение направления ОВР для выяснения возможности окисления или восстановления анализируемого вещества конкретным аналитическим реагентом с целью обнаружения или определения;
расчёт константы равновесия ОВР (К) для выяснения полноты протекания аналитической реакции;
выбор подходящего окислителя или восстановителя (на основании сравнения Е10 и Е20 или расчёта К);
прогнозирование возможности применения данной ОВР для проведения титриметрического определения;
расчёт индикаторных ошибок титрования;
химико-аналитические расчёты по уравнению Нернста:
расчёт кривых окислительно-восстановительного титрования;
расчёт условий проведения анализа с использованием ОВР – значения рН, концентрации реагирующих веществ, концентрации маскирующих агентов или реагентов-осадителей (учёт побочных реакций), в т. ч. с целью увеличения скачка кривой титрования.
Пример 1. К 20,00 мл раствора соли серебра добавили 20,00 мл 0,0200 моль/л раствора K2CrO4. Осадок Ag2CrO4 отделили, а фильтрат подкислили, добавили избыток раствора KI. На титрование выделившегося иода пошло 24,60 мл 0,0400 моль/л раствора Na2S2O3. Рассчитать массовую концентрацию Ag+ в исходном растворе.
Решение. Запишем уравнения реакций:
2Ag+ + CrO42– (изб.) = Ag2CrO4 ↓
2 CrO42– + 6 I– + 16 H+ = 2 Cr3+ + 3 I2 + 8 H2O
2 S2O32–+ I2 = S4O62– + 2 I
При количественном определении Ag+ последовательно используются методы обратного титрования и титрования заместителя.
Фактор эквивалентности иона CrO42– в реакции окисления-восстановления определяем, используя полуреакцию
CrO42– + 8 H+ – 3ē = Cr3+ + 4 H2O → fэкв(CrO42–)= 1/3.
Так как два иона Ag+ вступают в реакцию осаждения с ионом CrO42–, следовательно, 2 иона Ag+ эквивалентны 3 электронам. Для определения фактора эквивалентности иона Ag+ составим пропорцию:
2 иона Ag+ – 3 ē,
1 ион Ag+ – х ē.
Отсюда x = z = 3/2. Следовательно, фактор эквивалентности иона Ag+ равен 2/3.
Перейдем от молярных концентраций растворов к молярным концентрациям эквивалента:
С(1/3K2CrO4) = 0,0200 / (1/3) = 0,0600 моль/л;
С(1Na2S2O3) = 0,0400 / 1 = 0,0400 моль/л.
По закону эквивалентов найдем объем раствора K2CrO4, который остался после образования осадка:
![]()
Тогда на взаимодействие с KI ушло 20,00 – 16,40 = 3,60 мл раствора K2CrO4.
Найдем массу Ag+ в растворе, используя М(2/3Ag+) = 71,912 г/моль,
m(Ag2+) = 3,60 ∙ 10–3 ∙ 0,0600 ∙ 71,912 = 0,01553 г,
и его массовую концентрацию:
ρ*(Ag+) = 0,01553 /20 ∙ 10–3 = 0,7766 г/л.
Оксидиметрические индикаторы
Оксидиметрические индикаторы представляют собой органические вещества, окисленная и восстановленная форма которых окрашены в различные цвета. Изменение окраски индикатора связано с окислением восстановленной формы и превращением ее в окисленную при определенном значении потенциала раствора. В данном случае интервал перехода индикатора – область изменения потенциала системы, в которой наблюдается изменение окраски индикатора (ΔЕ):
![]()
Выбор индикатора осуществляется в соответствии с правилом:
«Стандартный потенциал индикатора (Е0) должен лежать в пределах скачка кривой титрования».
Характеристика важнейших оксидиметрических индикаторов приведена в табл.15(Справ. материалы) .
Вопросы и задачи для самостоятельного решения
1. Найти: а) титр; б) нормальную и молярную концентрации; в) титр K2Cr2O7 по иоду раствора, для приготовления 1 л которого было взято 5,200 г K2Cr2O7.
Ответы: а) 0,005200 г/мл; б) 0,1060 н.; 0,01769 М; в) 0,01346 г I2/мл.
2. Сколько граммов K2Cr2O7 необходимо взять для приготовления 1 л раствора с титром по железу, равным 0,002792?
Ответ: 2,452 г.
3. Навеска в 2,750 г химически чистого KBrO3 растворена в мерной колбе на 1000 мл, и объем раствора доведен до метки. Найти: а) титр раствора; б) нормальность; в) титр раствора по сурьме; г) титр раствора по иоду.
Ответы: а) 0,002750; б) 0,0988; в) 0,006015; г) 0,01254.
4. Для определения титра раствора перманганата калия взято 0,3310 г оксалата натрия. Навеска растворена в мерной колбе емкостью 50 мл. На титрование 10 мл этого раствора расходуется 14,75 мл раствора перманганата калия. Определить: а) нормальность KMnO4; б) титр перманганата по оксалату натрия.
Ответы: а) 0,06699; б) 0,002117.
5. Нормальность раствора HNO3 как кислоты равна 0,1121. Найти ее нормальность как окислителя в реакции восстановления до NO.
Ответ: 0,3363 н.
18. Рассчитать нормальность раствора K2Cr2O7 в реакциях окисления, если для реакций осаждения этот раствор имеет нормальность 0,1000.
Ответ: 0,1500 н.
6. Раствор азотной кислоты плотностью 1,185 содержит 30,1 % HNO3. Рассчитать ее нормальность в реакциях окисления, если при этом HNO3 восстанавливается до NO.
Ответ: 16,99 н.
7. Какую навеску Nа2С2О4 надо взять, чтобы на титрование ее шло 20 мл 0,1 н раствора KMnO4?
Ответ: 134 мг.
8. Навеску в 0,2133 г руды растворили в соляной кислоте; содержащееся в пробе железо восстановили до Fe2+ и затем оттитровали 0,117 н. раствором KMnO4, которого потребовалось 17,20 мл. Найти процентное содержание железа в руде.
Ответ: 50,4 %.
9. К навеске 0.1200 г K2Cr2O7 добавили избыток KI и соляной кислоты и выделившийся иод оттитровали 22,85 мл раствора тиосульфата. Найти: а) нормальную концентрацию Nа2S2О3 и б) его титр по иоду.
Ответ: а) 0,1074 н; б) 0,01362 г I/мл.
10. На титрование 20 мл раствора иода пошло 21,35 мл 0,1135 н раствора
Nа2S2О3 . Каковы: а) нормальная концентрация раствора иода и б) его титр?
Ответ: а) 0,1212 н; б) 0,01538 г I/мл.
11. К раствору KI, содержащему серную кислоту, прибавили 20 мл 0,1133 н раствора KMnO4 и выделившийся иод оттитровали 25,9 мл раствора Nа2S2О3 Какова нормальная концентрация раствора тиосульфата?
Ответ: а) 0,0874 н.
Комплексонометрическое титрование
Для равновесий комплексообразования основной характеристикой является константа устойчивости комплексного соединения, численное значение которой необходимо для решения следующих аналитических задач:
расчёт равновесных концентраций ионов в растворах комплексных соединений;
расчёт сложных равновесий в многокомпонентных растворах:
расчёт растворимости малорастворимого электролита, если один из ионов одновременно участвует в реакции комплексообразования;
расчёт окислительно-восстановительного потенциала, если один из компонентов сопряжённой окислительно-восстановительной пары одновременно участвует в реакции комплексообразования;
расчёт кривых комплексометрического титрования;
выбор маскирующего агента для конкретного иона;
оценка возможности обнаружения или количественного определения конкретного иона с использованием реакций комплексообразования;
прогнозирование возможности титрования ионов-комплексообра-зователей или ионов-лигандов.
При решении некоторых из этих задач используются следующие положения:
- суммарная константа устойчивости равна произведению ступенчатых констант:
= 1· 2· 3·...· n–1· n
или
р = р 1 + р 2 + р 3 +...+ р n–1 + р n.
- в случае ступенчатого комплексообразования скачок на кривой титрования будет наблюдаться, если ступенчатые константы устойчивости различаются не менее чем в 104 раз.
Пример 1. Необходимо замаскировать Fe3+ (продукт реакции мешает зафиксировать конечную точку титрования за счёт собственной окраски) при перманганатометрическом определении Fe2+ в сильнокислой среде.
Решение: По данным таблицы выясняем, что Fe3+ образует комплексы со многими лигандами: CN–, Cl–, F–, HPO42–, H2PO4–, OH–, SCN–. Из них:
- комплексы с ионами Cl– и SCN– являются малоустойчивыми, значит, непригодными для целей маскирования;
- лиганд CN– очень токсичен;
- комплексы с ионами OH– не могут существовать в условиях проведения анализа (сильнокислая среда);
- комплексы с ионами F–, HPO42–, H2PO4– являются очень устойчивыми, кроме того, они неокрашены. Следовательно, эти лиганды можно использовать для маскирования Fe3+, например, добавить в титруемый раствор немного фосфорной кислоты.
Пример 2. Можно ли провести количественное определение Cu2+, используя реакции комплексообразования с неорганическими лигандами ?
Решение: Ион Cu2+ – типичный комплексообразователь, образует устойчивые комплексы со многими неорганическими лигандами, например с NH3, OH–, SCN–. Однако комплексометрическое титрование с использованием этих реакций провести невозможно, поскольку разница в ступенчатых константах устойчивости составляет 1–3 порядка, т. е. скачка на кривой титрования не будет.
Пример 3. Вычислить массовую долю Al2O3 в силикате, если навеску 1,0220 г перевели в раствор, добавили 25,00 мл раствора комплексона III
[C(1/2 компл. III) = 0,2151 моль/л ], а на титрование избытка последнего пошло 9,83 мл 0,1015 моль/л раствора сульфата цинка.
Решение. В растворе протекают следующие реакции:
Al3+ + H2Y2– AlY– + 2 H+
H2Y2– + Zn2+ ZnY2– + 2 H+
Расчеты в задаче будем проводить по методу обратного титрования. Количество молей эквивалента Al3+ определяется разностью:
n(1/2 Al3+) = n(1/2 компл. III) – n(1/2 ZnSO4).
Рассчитаем количество молей эквивалента прибавленного
комплексона III:
n(1/2 компл. III) = C(1/2 компл. III) ∙ V(1/2 компл. III);
n(1/2 компл. III) = 0,2151 ∙ 25,00 ∙ 10–3 = 5,38 ∙ 10–3 моль.
Переведем концентрацию раствора ZnSO4 в молярную концентрацию эквивалента ZnSO4 с учетом, что fэкв.(ZnSO4) = 1/2 :
С (1/2 ZnSO4) = С (ZnSO4): 1/2 = 0,1015 : 1/2 = 0,2030 моль/л;
n(1/2 ZnSO4) = 0,2030 ∙ 9,83 ∙ 10–3 = 2,00 ∙ 10–3 моль.
Тогда количество молей эквивалента Al3+
n(1/2 Al3+) = 5,38 ∙ 10–3 – 2,00 ∙ 10–3 = 3,38 · 10–3 моль.
Вычислим fэкв.(Al2O3) с учетом схемы:
Al2O3 → 2 Al3+
fэкв. (Al2O3) = (1/2)/ 2 = 1/4 .
Рассчитаем m(Al2O3) с учетом M(1/4 Al2O3) = 25,4903:
m(Al2O3) = n(1/2 Al3+) ∙ M(1/4 Al2O3) = 3,38 ∙ 10–3 ∙ 25,4903 = = 0,0862 г;
ω = 0,0862 / 1,0220 ∙ 100 = 8,43 %.
Выбор индикатора и условий проведения анализа
При выборе индикатора и оптимального значения рН для конкретного случая комплексонометрического титрования можно воспользоваться данными таблицы 18 (Справочные материалы).
Кроме того, на основании табличных данных можно решить следующие вопросы:
- насколько селективна конкретная методика;
- надо ли принять меры с целью удержания титруемого иона металла в растворе.
Пример 4. Выбрать индикатор для комплексонометрического определения Са2+ в многокомпонентном растворе.
Решение: Ион Са2+ можно оттитровать раствором ЭДТА со многими индикаторами – кальцонкарбоновой кислотой, ксиленоловым оранжевым, метилтимоловым синим, мурексидом, ПАН, ПАР, флуорексоном и фталеинкомплексоном – в сильнощелочной, слабощелочной и слабокислой среде. Однако для определения Са2+ в многокомпонентном растворе пригодна только очень селективная методика, какой и является титрование с кальцонкарбоновой кислотой при рН > 12. Во всех остальных случаях с конкретным индикатором при определённом значении рН титруется сразу несколько ионов металлов.
Пример 5. Необходимо провести комплексонометрическое определение ионов Сu2+ при концентрации ~ 0,01 моль/л с индикатором ксиленоловым оранжевым. Надо ли принимать меры по удержанию Сu2+ в растворе ?
Решение: По таблицам выясняем оптимальное значение рН = 9–10, а также значение рН начала осаждения Сu(OH)2 из 0,01 М раствора, оно равно 6,2. Следовательно, в титруемый раствор необходимо ввести лиганды, которые связали бы ионы Сu2+ в прочный комплекс так, чтобы Сu(OH)2 не выпадал в осадок, а ионы Сu2+ в ходе титрования могли бы перейти в ещё более прочный комплекс с ЭДТА. С использованием табличных данных находим такой лиганд – NH3, а также устанавливаем, что комплексы Сu2+ с ЭДТА более устойчивые, чем с NH3.
Вопросы и задачи для самостоятельного решения
1. Напишите структурные формулы ЭДТА и ее комплексы с двух- и трехзарядными ионами металлов.
2. Рабочие растворы и установочные вещества в комплексонометрии.
3. В каких координатах в комплексонометрии строятся кривые титрования?
4.В чем сущность прямого, обратного и вытеснительного комплексонометрического титрования?
5. Что такое металлиндикаторы? Напишите равновесие в растворе металлиндикатора на примере хромоген черного Т.
6. Какова стехиометрия комплексов металлов с ЭДТА?
7. Как возможно определить Са2+ и Мg2+ при совместном присутствии?
8. Как возможно определить ион SО42– с помощью ЭДТА?
9. Условия титрования ионов кальция раствором ЭДТА.
10. Титр раствора ЭДТА по кальцию равна 0,000560 г/мл. Рассчитать молярную и нормальную концентрации этого раствора.
Ответ : 0,00100; 0,00200;
11. Какую навеску ЭДТА надо взять для приготовления 200 мл раствора с титром по стронцию, равным 0,00080 г/мл?
Ответ : 0,6791 .
12. Какой массе металла соответствует 1 мл 0,1000 н раствора ЭДТА: а) Mg2+; б)Co2+; в) Pb2+?
Ответ :а) 0,00126 г; б) 0,001179; в) 0,0004144.
13. Раствор ЭДТА (М = 292) приготовили растворением 10,00 г этой соли в небольшом объеме NаОН и разбавили точно до 500 мл. Рассчитать для этого раствора: а) молярную и нормальную концентрации; б) его титр по Са2+мг/мл; в) его титр по МgСО3 мг/мл.
Ответ :а) 0,06849 и 0.1368; б) 0,2745; в) 5,775 .
14. На титрование 40,00 мл воды при определении общей жесткости потребовалось 5,10 мл 0,03000 н раствора ЭДТА. Вычислить жесткость воды (мг/л), вызываемую карбонатом кальция.
Ответ :191,4.
15. Сколько граммов меди обнаружено в растворе, если на титрование этого раствора уходит 15,20 мл 0,06000 н ЭДТА в присутствии индикатора мурексида?
Ответ :0,02918.
16. На титрование раствора СdСl2 при рН = 9,3 в присутствии эриохрома черного израсходовано 25,20 мл 0,1000 н ЭДТА. Рассчитать массу кадмия (мг) в растворе.
Ответ :141,6.
17. Исследуемый раствор NiCl2 разбавили до 250 мл. К 25,00 мл этого раствора прибавили 15,00 мл 0,03000 н раствора ЭДТА, избыток которого оттитровали 5,60 мл 0,03000 н раствора MgSO4. Рассчитать массу Ni (мг) в растворе.
Ответ :82,77.
18. Навеску MgCl2 в 0,3100 г растворили в мерной колбе вместимостью 250 мл. На титрование 25,00 мл этого раствора израсходовано 10,35 мл 0,05000 н раствора ЭДТА. Рассчитать (в %) массовую долю MgCl2 в исследуемом образце соли.
Ответ :79,68.
19. Навеску Hg(NO3)2 , равную 0,6865 г растворили в 250 мл воды. На титрование 25,00 мл этого раствора в присутствии хромоген черного израсходовано 8,50 мл 0,04400 н раствора ЭДТА. Рассчитать (в %) массовую долю Hg(NO3)2 в исследуемом образце соли.
Ответ :88,42.
20. Рассчитать количество (в мг) МоО42– в растворе. Молибдат-ионы осадили в виде СаМоО4. В осадке оттитровали кальций 11,17 мл 0,1002 н раствора ЭДТА.
Ответ :179,2.
Примеры построения кривых титрования
Кривые титрования помогают выбрать индикатор, оценить погрешность титрования, наглядно проследить за ходом титрования. В процессе кислотно-основного титрования изменяется рН раствора, поэтому кривые титрования строят в координатах рН – V или рН – f, где V – объем прибавляемого титранта (мл), f – степень оттитрованности (%).
Кривые окислительно-восстановительного титрования строят в координатах – потенциал системы (Е) от объема (V) прибавленного реагента.
При построении кривой титрования необходимо провести расчеты величины рН или Е для четырех этапов титрования:
до начала титрования (исключается в случае окислительно-восстановительного титрования);
до точки эквивалентности;
в точке эквивалентности;
после точки эквивалентности.
В расчетах с использованием закона эквивалентов применяется молярная концентрация эквивалента, которую необходимо перевести в молярную концентрацию перед подстановкой в формулы для расчета рН или Е.
Титрование сильных кислот и оснований
Пример 1. Построить кривую титрования NaOH [С(NaOH) = = 0,15 моль/л] раствором HCl c концентрацией 0,30 моль/л и подобрать индикаторы.
Решение. NaOH – сильное основание, а HCl – сильная кислота, поэтому в данном случае рассмотрим титрование сильного основания сильной кислотой.
Предположим, что для титрования взяли 100,00 мл (V0) раствора NaOH
[С0 = С(NaOH) = 0,15 моль/л]. По закону эквивалентов рассчитаем объем раствора HCl (Vх), необходимый для оттитровывания NaOH (для достижения точки эквивалентности):
100,00 · 0,15 = Vх · 0,30; Vх = 50,00 мл.
Для простоты расчета допустим, что объем раствора при титровании не изменяется.
1. Сильные кислоты и основания в водном растворе диссоциированы нацело, поэтому концентрацию Н+ или рН рассчитывают исходя из концентрации NaOH по уравнению:
pH = 14 – pOH = 14+lg 0,15 = 13,18.
2. Значения рН раствора до точки эквивалентности будут определяться концентрацией неоттитрованного основания. При прибавлении 25,00 мл (50%) раствора HCl на титрование затрачено
n(HCl) = = 25,00 · 10–3 · 0,30 = 7,50 · 10–3 моль.
Неоттитрованное количество NaOH определяется вычитанием эквивалентного количества от исходного:
100,00 · 10–3 · 0,15 – 7,50 · 10–3 = 7,50 · 10–3 моль.
Отсюда С(NaOH) = 7,50 ∙ 10–3/100,00 ∙ 10–3 = 7,50 ∙ 10–2 моль/л, а
рН = 14 + lg 7,50 ∙ 10–2 = 12,88.
Объединяя поэтапный расчет и учитывая, что молярные концентрации эквивалентов в данном случае равны молярным концентрациям, получим в общем виде:
![]()
где Ст и С0 – исходные концентрации растворов титранта и титруемого вещества соответственно; V0 – исходный объем титруемого вещества; Vт – добавленный объем титранта.
Таким же образом рассчитываем рН при прибавлении 45,00 мл раствора HCl (45,00 : 50,00 · 100 = 90%):
![]()
Если добавлено 49,50 мл раствора HCl (49,50 : 50,00 · 100 = = 99%), то
![]()
После прибавления 49,95 мл раствора HCl (49,95 : 50,00 · 100 = = 99,9%):
![]()
3. В точке эквивалентности рН раствора определяется как
рН = 1/2 рKW = 7.
За точкой эквивалентности рН определяется избытком НCl. При добавлении 50,05 мл раствора HCl (50,05 : 50,00 · 100 = 100,1 %):
![]()
а так как в точке эквивалентности количество моль титруемого вещества равно количеству моль титранта, т. е. С0 ∙ V0 = 100,00 · 0,15 = = 50,00 ∙ 0,30, то
![]()
При добавлении 50,50 мл раствора HCl (50,50 : 50,00 · 100 = = 101 %)
![]()
При добавлении 55,00 мл раствора HCl (55,00 : 50,00 · 100 = 110 %):
![]()
Результаты вычислений сведем в табл.5, а по данным таблицы построим кривую титрования (рис. 1).
Таблица 5
Объем титранта VT, мл |
Компонент раствора, определяющий рН |
Формула для расчета рН |
рН |
0 |
NaOH |
14+lg С0(NaOH) |
13,18 |
25,00 |
NaOH |
|
12,88 |
45,00 |
NaOH |
-″- |
12,18 |
49,50 |
NaOH |
-″- |
11,18 |
49,95 |
NaOH |
-″- |
10,18 |
50,00 |
H2O |
рН = 1/2 рKW |
7,00 |
50,05 |
HCl |
|
3,82 |
50,50 |
HCl |
-″- |
2,82 |
55,00 |
HCl |
-″- |
1,82 |
Скачок титрования определяется резким изменением рН от 10,18 до 3,82 при недотитровывании или перетитровывании на 0,1% соответственно. Правило выбора индикаторов предусматривает, что интервал перехода окраски индикатора должен укладываться в пределы скачка титрования. По справочным данным подходящими индикаторами являются:
- метиловый оранжевый (интервал перехода 3,1- 4,4; рТ = 4,0),
- метиловый красный (интервал перехода 4,2 - 6,2; рТ = 5,0),
- бромтимоловый синий (интервал перехода 6,0 - 7,6; рТ = 7,0),
- фенолфталеин (интервал перехода 8,2 - 10,0; рТ = 9,0).

Рис. 1. Кривая титрования 0,15 моль/л раствора NaOH 0,30 моль/л раствором HCl.
Титрование слабой кислоты сильным основанием
Пример 2. Построить кривую титрования муравьиной кислоты
(С0 = 0,20 моль/л) раствором КОН c концентрацией 0,40 моль/л и подобрать индикаторы.
Решение. Муравьиная кислота – слабая кислота, а КОН – сильное основание, поэтому в данном случае рассмотрим титрование слабой кислоты сильным основанием. Расчет проводим без учета изменения объема раствора.
Предположим, что для титрования взяли 100,00 мл (V0) раствора НСООH (С0 = 0,20 моль/л). Рассчитаем объем раствора КОН (Vх), необходимый для полного оттитровывания HCOOH.
100,00 · 0,20 = Vх · 0,40; Vх = 50,00 мл.
1. рН исходного раствора рассчитываем по формуле для расчета рН раствора слабой кислоты:
рН = 1/2 рKа – 1/2 lg С0 = 1/2 3,75 – 1/2 lg 0,20 = 2,57.
2. В любой момент титрования до точки эквивалентности в растворе существует буферная смесь, состоящая из неоттитрованной муравьиной кислоты и образовавшегося формиата калия. При этом, аналогично предыдущему примеру, концентрацию кислоты и соли можно рассчитать следующим образом :
Ск = (Со ∙ Vo – Ст ∙ Vт)/ Vo; Сc = Ст ∙ Vт/ Vo.
Отсюда отношение концентраций можно рассчитать как
Ск/Сc = [(Со ∙ Vo – Ст ∙ Vт)/ Vo] / (Ст ∙ Vт/ Vo) =
= (Со ∙ Vo – Ст ∙ Vт) / Ст ∙ Vт/ Vo.
Следовательно, формула для расчета рН имеет вид
![]()
При добавлении 25,00 мл (50%) раствора гидроксида калия:
![]()
Таким же образом рассчитываем рН при прибавлении 45,00 мл раствора КОH (45,00 : 50,00 · 100 = 90 %):
![]()
Если добавлено 49,50 мл раствора КОH (49,50 : 50,00 · 100 = = 99 %),
![]()
При добавлении 49,95 мл раствора титранта (99,9 %), что соответствует точке начала скачка титрования:
![]()
3. В точке эквивалентности вся муравьиная кислота прореагировала и превратилась в соль, концентрация которой Ссоли = Скислоты = 0,2 моль/л.
рН раствора соли слабой кислоты рассчитываем по формуле:
![]()
4. За точкой эквивалентности величина рН раствора определяется только избытком добавленного титранта. Расчет рН проводится аналогично предыдущему примеру. Например, при добавлении 50,05 мл раствора KОН (100,1%)
рН = 14 + lg [(50,05 – 50,00) · 0,40/100,00] = 10,30.
При добавлении 50,50 мл раствора КОН (101%)
рН = 14 + lg [(50,50 – 50,00) · 0,40/100,00] = 11,30.
При добавлении 55,00 мл раствора КОН (110%)
рН = 14 + lg [(55,00 – 50,00) · 0,40/100,00] = 12,30.
Результаты сведем в табл. 6, по данным которой построим кривую титрования (рис. 2).
Таблица 6
Объем титранта VT, мл |
Компонент раствора определяющий рН |
Формула для расчета рН |
рН |
0 |
НСООН |
рН = 1/2 рKа – 1/2 lg С0 |
2,57 |
25,00 |
НСООН и НСООK |
|
3,75 |
45,00 |
НСООН и НСООK |
-″- |
4,70 |
49,50 |
НСООН и НСООK |
-″- |
5,75 |
49,95 |
НСООН и НСООK |
-″- |
6,75 |
50,00 |
НСООK |
рН = 7+1/2 рKа +1/2 lg Сc |
8,53 |
50,05 |
KOH |
pH = 14+lg СT |
10,30 |
50,50 |
KOH |
-″- |
11,30 |
55,00 |
KОН |
-″- |
12,30 |

Рис. 2. Кривая титрования 0,20 моль/л раствора муравьиной кислоты
0,40 Моль/л раствором koh.
Индикаторы выбираем с использованием справочных данных:
- нейтральный красный (интервал перехода 6,8 - 8,4; рТ = 8,0),
- феноловый красный (интервал перехода 6,8 - 8,4; рТ = 8,0),
- тимоловый синий (интервал перехода 8,0 - 9,6; рТ = 9,0),
- фенолфталеин (интервал перехода 8,2 - 10,0; рТ = 9,0).
Вопросы и задачи для самостоятельного решения
. Какое практическое значение имеют кривые титрования? Что такое скачок титрования, когда он начинается и заканчивается? От чего зависит величина скачка титрования?
Перечислите способы определения точки эквивалентности. Ответьте, в какой области pH лежит точка эквивалентности при титровании раствора:
а) сильной кислоты сильным основанием; б) слабой кислоты сильным основанием; в) слабого основания сильной кислотой.
. Какие вещества называются кислотно-основными индикаторами? Какие соединения используются в качестве кислотно-основных индикаторов?
Что называется интервалом перехода индикатора? Что такое показатель титрования индикатора? Сформулируйте правило выбора индикатора.
Напишите уравнения превращений индикаторов метилового оранжевого и фенолфталеина, происходящих под влиянием pH среды. Какие вещества и как можно определить методом нейтрализации с помощью этих индикаторов?
. Приведите примеры определения веществ способом обратного титрования в методе нейтрализации в микроэлектронике.
Укажите, какой из индикаторов (метиловый оранжевый, фенолфталеин, лакмус) пригоден для определения конца титрования:
а) HCOOH + NaOH; б) HNO3 + NaOH; в) NH3 + HCl;
г) Na2CO3 + HCl; д) Na2CO3 + 2HCl.
К 20 мл 0,1 н раствора HCl прибавили 30 мл 0,1 н раствора NaOH. Чему равен рН раствора в обоих случаях?
Ответ:12,30.
К 25 мл 0,1 н раствора HCl прибавили: а) 24,95 мл; б) 25,05 мл 0,1 н раствора NaOH. Чему равен рН раствора в обоих случаях?
Ответ: а) 4; б) 10.
К 25 мл 0.2 н СН3СООН прибавили 25,1 мл раствора NaOH. Вычис
лить рН полученного раствора (с учетом изменения объема).
Ответ:10,6.
При каком рН достигается точка эквивалентности титрования 0,1 н
раствора NН4ОН 0,1 н раствором НСООН?
Ответ:6,51.
При титровании 25,00 мл раствора, содержащего смесь Nа2СО3 и
NаНСО3, с фенолфталеином израсходовано 9,46 мл, а с метиловым оранжевым – 24,86 мл 0,1200 н раствора Н2SО4 . Сколько граммов Nа2СО3 и NаНСО3 содержится в 250 мл раствора?
Ответ:1,203 г Nа2СО3 и 0,5989 г NаНСО3.
Постройте кривые титрования и подберите индикаторы для
титрования:
а) 0,2 н. HCl-0,2 н. раствором NaOH;
б) 0,1 н. H2SO4-0,1 н. раствором KOH;
в) 0,2 н. CH3COOH-0,2 н. раствором NaOH;
г) 0,2 н. NH3-0,2 н. раствором HCl;
д) 0,2 М Na2CO3-0,2 н. раствором HCl;
е) 0,1 М H3PO4-0,1 н. раствором NaOH.
При каком значении pH следует закончить титрование 0,2 н. раствора
CH3COOH 0,1 н. раствором NaOH?
Ответ: pH = 8,80.
При каком значении pH следует закончить титрование 0,01 н. раствора
NH4OH 0,1 н. раствором HCl?
Ответ: pH = 5,28.
Определите pH раствора, полученного при титровании 20 мл 0,1 н.
раствора CH3COOH 5 мл 0,1 н. раствора NaOH.
Ответ: pH = 4,26.
Определите pH раствора, полученного при титровании 20 мл 0,1 н.
раствора NH4OH 10 мл 0,1 н. раствора HCl.
Ответ: pH = 9,26.
Окислительно-восстановительное титрование
Пример 1. Построить кривую титрования I2 раствором аскорбиновой кислоты (C6H8O6) и подобрать индикаторы. Концентрации растворов: С (1/2 I2) = 0,02 моль/л, С (1/2 C6H8O6 ) = 0,01 моль/л. рН раствора = 1.
Решение. Кривые окислительно-восстановительного титрования отражают зависимость потенциала системы от объема прибавленного реагента. При титровании раствора иода раствором аскорбиновой кислоты протекает окислительно-восстановительная реакция:
I2 + 2ē 2I– I2 – окислитель
C6H8O6– – 2ē C6H6O6 +2Н+ C6H8O6 – восстановитель
________________________
I2 + C6H8O6 = 2I– + 2 Н+ + C6H6O6
В растворе образуются две окислительно-восстановительные пары: I2 / 2I– и C6H8O6/C6H6O6, потенциал каждой из которых можно рассчитать по уравнению Нернста:
|
|
|
|
Значения стандартных потенциалов находим в справочных таблицах:
![]() ;
;
![]()
Рассчитаем объем (VT) раствора C6H8O6, необходимый для оттитровывания 100 мл (V0) раствора I2:
С0 · V0 = СT · VT; VT = 0,02 · 100,00/ 0,01 = 200,00 мл.
Потенциал системы до начала титрования не рассчитывают, поскольку в исходном растворе известна концентрация только одной из сопряженных форм титруемого вещества. До точки эквивалентности удобнее вести расчет потенциала для окислительно – восстановительной пары I2 / 2I– ,а после т. э. – для пары C6H8O6/C6H6O6.
1. Расчет кривой до точки эквивалентности.
В результате прибавления 100,00 мл раствора аскорбиновой кислоты образовалось эквивалентное количество I– – иона, так как из одного моля I2 образовалось два моля I–, т. е. коэффициенты перед окисленной и восстановленной формами различны, то при расчете концентраций будем учитывать разбавление.
![]()
Рассчитаем концентрацию неоттитрованного иода:
![]()
Для подстановки в уравнение Нернста концентрацию необходимо перевести в молярную: [I2] = 2,50 · 10–3 моль/л.
Рассчитываем потенциал системы:
![]()
После добавления 180,00 мл (90%) титранта, рассчитаем изменившиеся концентрации иодид-иона и иода, а также потенциал системы:
![]()
![]()
[I2] = 3,57 · 10–4 моль/л;
![]()
Прибавлено 198,00 мл (99%) раствора аскорбиновой кислоты:
![]()
![]()
[I2] = 3,35 · 10–5 моль/л, Е = +0,532 В.
Прибавлено 199,80 мл раствора аскорбиновой кислоты (99,9%). Точка начала скачка титрования соответствует моменту титрования, когда раствор недотитрован на 0,1%:
![]()
![]()
[I2] = 3,34 · 10–6 моль/л, Е = +0,503 В.
2. Потенциал системы в т. э. рассчитываем с учетом рН раствора по формуле

где n1 и n2 – количество электронов, участвующих в полуреакциях.
![]() .
.
3. Расчет кривой после т. э. проводим для пары C6H8O6/C6H6O6.
Прибавлено 200,20 мл раствора аскорбиновой кислоты (100,1 %), т. е. раствор иода перетитрован на 0,1%, что соответствует концу скачка титрования. Определим концентрацию избытка аскорбиновой кислоты:
![]()
Молярная концентрация С6Н8О6 :
[С6Н8О6] = 3,33 · 10–6 моль/л.
Количество образовавшегося продукта окисления аскорбиновой кислоты (С6Н6О6) после т. э. не изменяется, а его концентрация уменьшается с разбавлением:
![]()
[С6Н6О6] = 3,33 · 10–3 моль/л.
Рассчитаем потенциал системы Е:
![]()
При добавлении 202,00 мл титранта (101%)
[С6Н8О6] = 3,31 · 10–5 моль/л;
[С6Н6О6] = 3,31 · 10–3 моль/л;
Е = –0,326 В.
При добавлении 220,00 мл титранта (110%)
[С6Н8О6] = 3,12 · 10–4 моль/л;
[С6Н6О6] = 3,12 · 10–3 моль/л;
Е = –0,356 В.
4. Результаты вычислений сведем в табл. 7, а по данным таблицы построим кривую титрования (рис. 3).
Таблица 7
-
Объем прибавленного титранта, мл
Потенциалопределяющая система
Е, В
100,00
I2 / 2 I–
0,595
180,00
I2 / 2 I–
0,564
198,00
I2 / 2 I–
0,532
199,80
I2 / 2 I–
0,503
200,00
I2 C6H6O6
0,075
200,20
C6H8O6/C6H6O6
–0,296
202,00
C6H8O6/C6H6O6
–0,326
220,00
C6H8O6/C6H6O6
–0,356

Рис. 3. Кривая титрования раствора иода раствором аскорбиновой
кислоты [С (1/2I2) = 0,02 моль/л, С (1/2 C6H8O6 ) = 0,01 моль/л]
В качестве окислительно-восстановительных индикаторов можно использовать нейтральный красный (при рН = 1 Е 0= + 0,15 В), индиготрисульфоновую и индиготетрасульфоновую кислоты (при рН = 1 соответственно
Е0 = +0,28 и +0,31 В). Значения Е0 этих индикаторов находятся в пределах скачка титрования.
Вопросы и задачи для самостоятельного решения
Как зависит величина окислительно-восстановительного потенциала от соотношения концентраций окисленной и восстановленной форм? Учитывая величину стандартных окислительно-восстановительных потенциалов пар Fe3+/Fe2+ и I2/2I-, укажите, в каком направлении должна идти реакция между ними. Пригодна ли эта реакция для иодометрического определения ионов железа (III)?
Как зависит величина окислительно-восстановительного потенциала от концентрации ионов водорода? Рассчитайте величину
 в
вольтах при [IO3-]
= [I-]
и а) [H+]
= 0,1 моль/л;
в
вольтах при [IO3-]
= [I-]
и а) [H+]
= 0,1 моль/л;
б)
[H+]
= 10-7
моль/л.![]()
Ответ: а) 1,02 В; б) 0,67 В.
Какова связь между константами равновесия окислительно-восстановительных реакций и стандартными потенциалами реагирующих веществ? Рассчитайте константы равновесия следующих реакций при [H+] = 1 моль/л:
а) IO3- + 6Br- + 6H+ I- + 3Br2 + 3H2O
б) MnO2 +Na2C2O4 + 2H2SO4 MnSO4 + 2CO2 + 2H2O + Na2SO4
На основании расчетов ответьте, в каком направлении пойдут реакции и являются ли они практически необратимыми.
Вывести формулы для вычисления констант равновесия следующих реакций:
а) Sn2+ + I2 Sn4+ + 2I-
б) MnO4- + 8H+ + 5Fe2+ Mn2+ + 5Fe3+ + 4H2O
и найти их числовые значения. Какая из указанных реакций протекает более полно?
Ответ: а) K = 2,81013; б) K = 6,31063.
Постройте кривую титрования 0,1 н. раствора соли железа (II) 0,1 н. раствором соли церия (IV). При этом учтите, что Ce4+ восстанавливается до Ce3+ и
 Определите
потенциал в точке эквивалентности.
Определите
потенциал в точке эквивалентности.
Ответ: = 1,160 В.
Постройте кривую титрования 0,1 н. раствора соли железа (II) 0,1 н. раствором KClO3 при концентрации [H+], равной 1 моль/л. Определите (в вольтах): а) область скачка; б) точку эквивалентности.
Рассчитайте окислительно-восстановительный потенциал в растворе, полученном если: а) к 20 мл 0,1 н раствора Na3AsO4 приливают 18 мл 0,1 н раствора I2 при pH = 9.
Ответ: Е = – 0,101 В.
8. Рассчитайте окислительно-восстановительный потенциал раствора в точке эквивалентности титрования 0,1 н. раствора FeSO4 0,1 н. раствором KMnO4 (при рН = 0)
9. Какие индикаторы применяются в редоксометрии? Какой химический процесс является причиной перемены их окраски?
10. От каких факторов зависит скорость реакций окисления-восстановления?
11. Какие реакции называют индуцированными (сопряженными)?
12. Расскажите, какие рабочие растворы применяют: а) в перманганатометрии; б) иодометрии.
Физико-химические методы анализа
Электрохимические методы анализа.
Электрохимические методы анализа основаны на электрохимических процессах, протекающих на границе двух фаз (электрод-раствор). Электрохимические измерения проводят прямыми и косвенными методами.
В прямых методах физическое свойство исследуемой системы является критерием содержания определяемого вещества.
В косвенных методах (титрование) определенные свойства служат указателем (подобно индикатору) конца реакции взаимодействия анализируемого вещества или его заместителя с титрантом.
Классифицируются электрохимические методы на основе физических свойств системы, интенсивность которых измеряется.
Потенциометрия и потенциометрическое титрование.
Одним из важнейших электрохимических методов является потенциометрия. В основе потенциометрии лежит определение активности (концентрации) вещества (иона), основанное на измерении электродвижущей силы (ЭДС) обратимых равновесных электрохимических систем, когда индикаторный электрод имеет равновесный (или близкий к равновесному) потенциал.
Индикаторный электрод должен быть обратим к определяемому иону, а в случае исследования окислительно-восстановительных систем он должен быть электронообратимым и изготавливаться из инертного материала (платина, графит, стеклографит). Измерения проводятся относительно электрода сравнения с помощью потенциометра постоянного тока с большим входным сопротивлением, благодаря чему исключаются электродные электрохимические реакции и возникновение тока в системе.
Метод прямой потенциометрии основан на измерении истинного значения электродного потенциала и нахождению по уравнению Нернста активности (концентрации) потенциалопределяющего компонента в растворе. Наиболее широкое применение метод находит для определения рН растворов, а также различных катионов и анионов с использованием ионоселективных мембранных электродов. Селективность электродов на твердых мембранах связана с возможностью переноса через мембрану только определяемого иона.
При потенциометрическом титровании могут протекать реакции нейтрализации, окислительно-восстановительные, осаждения и комплексообразования. Все реакции должны протекать быстро, необратимо, возможно наиболее полно.
Пример 1. Вычислить потенциал медного электрода, помещенного в раствор нитрата меди, относительно насыщенного хлоридсеребряного электрода, если в 150 мл раствора содержится 24,2 г Cu(NO3)2·2 H2O.
Решение.
Стандартный
потенциал пары
![]() В.
Потенциал насыщенного хлорсеребряного
электрода равен 0,201 В. Медный электрод,
опущенный в раствор соли меди является
электродом I
рода, его потенциал зависит от природы
потенциалопределяющей пары и концентрации
Cu2+
(окисленной формы):
В.
Потенциал насыщенного хлорсеребряного
электрода равен 0,201 В. Медный электрод,
опущенный в раствор соли меди является
электродом I
рода, его потенциал зависит от природы
потенциалопределяющей пары и концентрации
Cu2+
(окисленной формы):
![]() .
.
Концентрация иона Cu2+ определяется из соотношения:
С
(моль/л) =
![]() ,
,
где m – масса соли, г;
M – молярная масса, г/моль;
V – объем раствора, л.
Следовательно,
С
(Cu2+)
=
![]() моль/л.
моль/л.
Подставляем С (Cu2+) в уравнение Нернста:
![]() .
.
ЭДС = 0,340 – 0.201 = 0,139 В.
Пример 2. Потенциал хингидронного электрода по отношению к нормальному каломельному равен 0,170 В при 20 ºС.
Вычислить рН раствора.
Решение.
рН = – lg[H+] .
Потенциал хингидронного электрода (Ех-г) связан с [Н+] или рН уравнением:
Ех-г = 0,699 + 0,058 lg[H+] = 0,699 – 0,058 рН.
ЭДС гальванического элемента, составленного из хингидронного и каломельного (Ек) электродов, равна:
ЭДС = Ех-г – Ек = 0,170 В Ек = 0,282 В (по таблицам), следовательно
![]() .
.
Пример 3. Вычислить потенциал водородного электрода, опущенного в раствор 0,05М НСООН, на 50% оттитрованной 0,05 М KОН.
Решение.
Потенциал водородного электрода (Евод.) равен:
Евод. = – 0,058 lg[H+].
Необходимо вычислить концентрацию [H+] в растворе.
НСООН + KОН = НСООK + Н2О,
где наряду со слабым электролитом НСООН будет находиться сильный электролит НСООK. Определим [H+] из уравнения константы диссоциации:
![]()
Kдис = 1,84·10–4 (табличные данные). В момент, когда кислота оттитрована на 50% [HCOOH] = [HCOO–]. Следовательно [Н+] = Kдис = 1,84·10–4 моль/л.
Потенциал водородного электрода в момент, когда раствор оттитрован на 50% равен
Eвод. = – 0,058 lg 1,84·10–4 = –0.217 В..
Пример 4. Вычислить потенциал платинового электрода, помещенного в раствор FеSО4, на 99% оттитрованного раствором KМnО4.
Решение.
Потенциал инертного платинового электрода определяется природой сопряженной окислительно-восстановительной пары и концентрацией ее окисленной и восстановленной форм.
В данном растворе имеется пара
![]()
Fe2+,
для которой
Fe2+,
для которой
![]() В,
В,
тогда
![]() .
.
Поскольку исходный раствор оттитрован на 99% , то
![]() .
.
Следовательно,
Е = 0,77 + 0,058 lg100 = 0,876 B.
Вольтамперометрия
Вольтамперометрия включает в себя группу электрохимических методов анализа, основанных на изучении поляризационных кривых. Многие из них играют важную роль в практике анализа.
Полярография - основана на измерении силы тока, возникающего при электролизе растворов, с применением рабочего электрода очень маленького размера, чаще всего ртутного капающего; раствор должен содержать избыток индифферентного электролита (фон).
При изменении потенциала микроэлектрода меняется сила тока, проходящего через раствор. Зависимость силы тока от потенциала электрода, регистрируемая полярографом, называется полярограммой. При достижении определенного для каждого вещества значения потенциала происходит электровосстановление (или окисление) его, сопровождающееся увеличением силы тока в цепи, который приобретает практически постоянное значение, называемое предельным (диффузионным) током или высотой волны. Потенциал, при котором ток равен половине диффузионного, называется потенциалом полуволны (Е1/2). По потенциалам полуволн определяют качественный состав раствора. Для количественных определений используют величину диффузионного тока id (высоту волны, h), которая прямо пропорциональна концентрации определяемого вещества:
iдиф = k·C.
Данное уравнение называется уравнением Ильковича и является основой количественного полярографического анализа, выражающее связь диффузионного тока с концентрацией вещества, природой электрохимической реакции и характеристиками электрода. На основании этого уравнения проводится количественный анализ одним из обычных методов - сравнения, калибровочного графика, метод добавок, расчетный метод.
При работе по методу сравнения измеряют высоты волн на полярограммах двух – трех стандартных растворов и определяют средний коэффициент пропорциональности:
h1 = k1 C1; h2 = k2C2; k2 = h2/C2; k1 = h1/C1
![]()
Далее, измерив высоту волны исследуемого раствора и использовав вычесленный коэффициент пропорциональности, определяют Cx:
Cx
=
![]() .
.
В методе добавок измеряют высоту волны для исследуемого раствора h1, затем к нему добавляют строго определенное количество стандартного раствора С0 и снова определяют высоту волны h2.Концентрацию определяемого элемента Сx находят. решая систему уравнений:
h1 = kCx
h2 = k(Cx + C0),
где (Cx + C0) – концентрация после добавления стандартного раствора;
k – коэффициент пропорциональности.
Если известны коэффициенты диффузии D и характеристика капилляра, из которого вытекает ртуть (m2/3·t1/6), то концентрацию Cx определяемого элемента можно определить расчетным методом, используя уравнение Ильковича:
iдиф. = 607·n·D1/2· m2/3·t1/6·Cx,
где iдиф. – предельный диффузионный ток, мкА;
n – число электронов, участвующих в электрохимической реакции;
m – масса ртути, вытекающая из капилляра за 1 с, мг;
t – время образования одной капли, с;
Cx – концентрация, ммоль/л.
Пример 5. По полярографическим данным для соли таллия на фоне ЭДТА определить потенциал полуволны
Е, В 0,5 0,65 0,75 0,725 0,75 0,775 0,80 0,90
I, мкА 1,1 3.6 6,9 15,0 26,8 35,8 41,0 45,0
Решение.
По приведенным данным строим график, по которому определяем потенциал полуволны (E1/2,)В. После построения полярограммы проводим касательные к верхней, нижней и средней кривой (прямые линии, проведенные через две первые, две средние и две последние точки на кривой). Через точки пересечения этих линий проводим прямые, параллельные оси абсцисс (рис.4). Расстояние между ними равно диффузионному току. Потенциал, при котором сила тока равна половине высоты волны, является потенциалом полуволны:
E1/2 = – 0.74 В.

Рис 4. Полярограмма раствора Рис 5. Калибровочный график
соли таллия на фоне ЭДТА полученный при полярографировании
10–3М раствора кобальта
Пример 6. Сплав, массой 0,1000 г, содержащий кобальт, растворили в смеси кислот и разбавили в мерной колбе вместимостью 100 мл. Для полярографирования отобрали 10 мл исследуемого раствора, разбавили раствором фона до 20 мл. Высота волны составила 35 мм.
Для построения калибровочного графика приготовили 10–3 М раствор соли кобальта, аликвотную часть которого разбавили до 20 мл тем же раствором фона и получили следующие данные при полярографировании:
V, мл 1 2 3 4 5
h, мм 10 20 30 40 50
Определить мольную долю кобальта в сплаве.
Решение.
Строят калибровочный график зависимости высоты волны от объема раствора соли кобальта (рис.5). По графику определяют, что высоте волны 35 мм соответствует объем соли кобальта, равный 3,5 мл. Содержание кобальта в этом объеме равно:
m(Со) = 10· 58,9·10–3·3,5 = 2,06 мг.
Мольная доля кобальта в сплаве:
ω(Со)%
=
![]() .
.
Амперометрическое титрование с одним индикаторным электродом
Этот метод имеет те же теоретические основы что и метод полярографии. Поскольку предельный диффузионный ток прямо пропорционален концентрации электроактивного вещества, то по его изменению в процессе титрования можно судить об изменении содержания в растворе определяемого вещества, титранта или продукта реакции. Точка эквивалентности находится графически по кривой титрования, отражающей изменение диффузионного тока в зависимости от объема титранта. Форма кривой титрования и характер перегиба на ней, соответствующего точке эквивалентности, прежде всего зависит от потенциала микроэлектрода.
Основным моментом является выбор потенциала для титрования, который должен соответствовать предельному току одного или двух участников химической реакции. Для этого необходимо четко представлять себе (уметь нарисовать) полярограммы определяемого вещества, тиранта и продуктов реакции, если они электроактивны. Следует заметить, что в амперометрии наряду с ртутным капающим электродом, используемым в области отрицательных потенциалов (процессы восстановления), широко применяется вращающийся платиновый микроэлектрод, позволяющий работать при достаточно больших положительных значениях потенциала и исследовать процессы окисления.
Пример 7. Препарат фитин количественно осаждается ионами свинца. На этой реакции основано амперометрическое определение фитина титрованием раствором нитрата свинца. На ртутном капающем электроде на фоне хлорида лития восстанавливаются фитин (Е1/2 = –1,50 В) и ион свинца (Е1/2 = –0,43 В). Необходимо оценить возможность амперометрического титрования фитина раствором нитрата свинца при потенциалах –0,10 В, –0,80 В и – 1,70 В. Какую форму имеют кривые титрования при этих потенциалах? Нарисовать кривые титрования.
Решение. Предельный диффузионный ток восстановления имеет место при потенциалах более отрицательных, чем потенциал полуволны.
Поэтому при потенциале –0,10 В не восстанавливается и, следовательно, не дает ток ни одно из веществ, участвующих в реакции, что делает титрование при этом потенциале невозможным.
При потенциале –0,80 В электроактивным является ион свинца и имеет место диффузионный ток, обусловленный восстановлением этого иона (но не фитина). Поэтому при амперометрическом титровании до точки эквивалентности, пока в растворе отсутствуют ионы Pb2+, ток отсутствует; после точки эквивалентности ток возрастает пропорционально увеличению концентрации ионов свинца, накапливающихся в растворе при добавлении избытка титранта. Кривая амперометрического титрования при Е = –0,80 В приведена на рис.6.
При потенциале – 1,70 В восстанавливается не только ион свинца, но и фитин, имеющий при этом потенциале предельное значение тока. В процессе титрования величина этого тока уменьшается пропорционально уменьшению концентрации фитина и становится практически равной нулю в точке эквивалентности. После точки эквивалентности в растворе появляются избыточные ионы свинца, концентрация которых возрастает по мере добавления титранта, что приводит к возрастанию силы тока. Кривая амперометрического титрования при Е = –1,70 В приведена на рис.7.

Рис.6 Рис.7
Пример 8. При амперометрическом титровании ацетальдегида
2,4 -динитрофенилгидразином при потенциале –1,4 В относительно ртути были получены следующие данные:
V ,мл 0,2 0,25 0,35 0,45 0,53 0,61 0,69 0,70
I, мкА 0 78 63 45 30 30 39 60
Найти точку эквивалентности и содержание ацетальдегида, если титр
2,4-динитрофенилгидразина по ацетальдегиду равен 5,6·10–6 г/л.
Решение. Из построенного графика в координатах iдиф – V, находим,что точка эквивалентности соответствует объему 0,55 мл 2,4-динитрофенилгидразина. Исходя из этого, вычисляют содержание ацетальдегида в исследуемом растворе по формуле:
m = T·V =0.55·5,6·10–6 = 3,08·10–6 г.
Кулонометрия.
Метод основан на измерении количества электричества, необходимого для полного окисления или восстановления определяемого вещества, и расчете его количества на основе закона Фарадея. Наиболее широко используется на практике два вида кулонометрии - прямая кулонометрия при постоянном потенциале и кулонометрическое титрование при постоянной силе тока. Первый из них применим для электрохимически активных веществ и основан на измерении количества электричества, необходимого для полного электропревращения определяемого вещества. Второй предполагает образование на электроде промежуточного вещества, которое химически взаимодействует с находящимся в растворе определяемым веществом. Количество электричества определяется по времени, затраченному на образование (генерирование) этого промежуточного вещества (титранта) от начала электролиза до окончания химической реакции в растворе.
Характерной особенность кулонометрии является то, что этот метод, в отличие от других физико-химических методов анализа, не требует для своего осуществления стандартных или титрованных растворов, так как здесь измеряется количество электричества, а не какое-либо свойство, связанное функциональной зависимостью с концентрацией вещества. Главными моментами в прямой кулонометрии при постоянном потенциале является выбор потенциала электрода, определение момента окончания электролиза и способ определения количества электричества. Основным в кулонометрическом титровании является способ установления момента окончания химической реакции в растворе, для чего применяют как визуальные индикаторы, так и различные физико-химические методы (потенциометрия, амперометрия с двумя индикаторными электродами, фотометрия).
Пример 9. На кулонометрическое титрование раствора аскорбиновой кислоты иодом, генерируемым из иодида калия током силой 5,00 мА, потребовалось 520 с. Рассчитать массу аскорбиновой кислоты в анализируемом растворе. Предложить способ фиксирования конечной точки титрования.
Решение. Количество электричества, затраченное на окисление иодида и, соответственно, аскорбиновой кислоты
Q = i·t = 5,00·520 = 2600 мКл.
По закону Фарадея масса определяемого вещества рассчитывается по формуле
m(X) = Q·M(X)/F·n,
где: Q - количество электричества, затраченное на электролиз, Кл;
М - молярная масса определяемого вещества, г/моль;
F - число Фарадея, равное 96500 Кл/моль;
n - число электронов, участвующих в электрохимической реакции.
Аскорбиновая кислота окисляется иодом до дигидроаскорбиновой кислоты с отдачей двух электронов, следовательно, её масса в растворе равна:
m =2600·176,13/96500·2 = 2,37 мг.
Конечная точка титрования определяется по появлению избытка иода в растворе. Следовательно, фиксировать её можно:
- визуально с помощью крахмала, добавленного в анализируемый раствор (появление синей окраски),
- амперометрически с ртутным капающим или платиновым микроэлектродом по появлению предельного тока иода,
-- потенциометрически по резкому увеличению потенциала платинового электрода.
Вопросы и задачи для самостоятельного решения
В чем заключается сущность потенциометрического титрования? Когда используют потенциометрическое титрование?
Какую роль выполняют индикаторные электроды и электроды сравнения?
Какие электроды используют в качестве индикаторных при титровании по реакциям нейтрализации, окисления-восстановления, осаждения и комплексообразования?
Каковы преимущества определения точки эквивалентности в координатах (E/V) - V?
Что представляет собой хингидронный электрод?
Что представляет собой каломельный полуэлемент?
Опишите методику определения кобальта в резистивных сплавах потенциометрическим титрованием.
Почему можно использовать аскорбиновую кислоту в качестве титранта при потенциометрическом определении железа в травильных растворах?
Вычислить потенциал медного электрода в растворе, содержащем 16 г сульфата меди, в 1000 мл электролита.
В чем сущность полярографического метода анализа?
Какие электроды используются в полярографическом анализе?
Что называется высотой волны и потенциалом полуволны?
Каким образом можно изменять потенциалы полуволн?
Привести уравнение Ильковича и объяснить его.
Каким образом можно проводить количественный и полярографический анализ?
Какова чувствительность полярографических методов анализа?
Укажите области применения полярографического анализа в полупроводниковой технике.
Принцип амперометрического титрования с одним индикаторным
электродом. Какова связь этого метода с полярографией?
Как выбрать потенциал индикаторного электрода для амперометрического титрования?
Какова принципиальная схема установки и техника проведения ампе
рометрического титрования с одним индикаторным электродом?
Какова чувствительность метода амперометрического титрования с одним индикаторным электродом?
Какова область применения метода амперометрического титрования?
Вчем состоит принцип кулонометрического метода анализа?
Как выбрать потенциал электрода?
Каков характер измерения силы тока в процессе электролиза?
Каковы способы измерения количества электричества в методе кулонометрии при постоянном потенциале?
Преимущества и недостатки методов кулонометрии при постоянном потенциале и кулонометрического титрования.
Вычислить потенциал алюминиевого электрода, помещенного в раствор, содержащий 27 г АlСl3 в 200 мл раствора, относительно водородного электрода.
Ответ:–1,66 B
36. Вычислить потенциал хингидронного электрода, находящегося в растворе кислоты с рН = 2, по отношению к стандартному водородного электрода.
Ответ:0,601 B.
37. Чему равен потенциал водородного электрода в 0,1 М растворе НСl?
Ответ:–0,058 .
38. Вычислить потенциал серебряного электрода, помещенного в раствор, содержащий 0,2 моль АgNО3 в 500 мл раствора, относительно 0,1 н хлоридсеребряного электрода.
Ответ:0,48 B.
39. Чему равен потенциал никелевого электрода. помещенного в насыщенный раствор гидроксида никеля, относительно насыщенного каломельного элемента?
Ответ:0,623 B.
40. Железный электрод помещен в раствор, содержащий 20,5 г FeSO4·7H2O в 100 мл раствора. Вычислить его потенциал по отношению к нормальному каломельному электроду.
Ответ:0,761 B.
41. Рассчитать потенциал хингидронного электрода, находящегося в 0,1 М растворе НСl, оттитрованном 0,1 М раствором КОН на:
а) 50 %; б) 90%; в) 100%; г) 100,1%.
Ответ:a) 0,630 B, б) 0,544 В, в) 0,312 В, г) 0.138 В.
42. Рассчитать потенциал платинового электрода в растворе FeSO4, оттитрованном раствором К2Сr2О7 на:
а) 50%; б) 90%; в) 99%; г) 100%; д) 100,1%.
Концентрация ионов водорода в растворе равна 1 моль/л.
Ответ: а) 0,770 В; б) 0.826 В; в) 0.877 В; г)1,250 В; д) 1,282 В.
43. Рассчитать потенциал водородного электрода в 0,01 М растворе НСООН, оттитрованном 0,05 М раствором NаОН на:
а) 10%; б) 50%; в) 99,9%; г) 100%; д) 100,1%.
44. Вычислить молярную концентрацию меди в растворе, если при анализе 10 мл исследуемого раствора методом добавок была получена полярографическая волна высотой 10,5 мм, а после добавления 2 мл стандартного раствора меди с концентрацией 0,05 моль/л высота волны увеличилась до 24 мм.
Ответ: 0,0448 моль/л.
45. Определить, какой элемент присутствует в исследуемом растворе, если при полярографировании на ртутном капельном электроде на фоне 1 М раствора КОН был получен потенциал полуволны 1,03 В.
Ответ: Cr(IV).
Спектроскопические методы анализа
Спектроскопические методы анализа основаны на измерении интенсивности электромагнитного излучения, которое испускается анализируемым веществом (эмиссионный спектральный анализ) либо поглощается им.
В последнем случае методы анализа называются абсорбционными. Они получили широкое распространение в различных областях науки и техники.
Фотометрические методы анализа.
Фотометрические методы анализа основаны на способности веществ при определенных длинах волн поглощать электромагнитное излучение в видимой (400-750 нм) и ультрафиолетовой (УФ) области (185-400 нм) спектра. Причиной поглощения (абсорбции) электромагнитного излучения является переход молекул в возбужденное состояние за счет изменения энергии электронов. Зависимость интенсивности поглощения, которая характеризуется величинами
- оптической плотности А = lg(I0/I) и
- пропускания Т = (I/I0)··100%, и
- длиной волны электромагнитного излучения (λ, нм)
называется электронным спектром поглощения. Спектр поглощения является индивидуальной характеристикой вещества, на изучении спектров поглощения основан качественный анализ.
Максимум на кривой А = f(λ)
и минимум на кривой Т = f(λ)
соответствует длинам волн собственного (характеристического) поглощения анализируемого вещества.
Методы фотометрического анализа подразделяются на две группы:
спектрофотометрия - метод основан на измерении поглощения
монохроматического излучения с определенной длиной волны (получают с помощью монохроматора);
фотоколориметрия - метод основан на измерении поглощения по-
лихроматического излучения, т.е. пучка света с близкими длинами волн (получают с помощью светофильтров).
Спектрофотометрия является наиболее строгим и точным методом, фото-
колориметрия применяется в основном для анализа окрашенных растворов. Основой количественного фотометрического анализа является основной закон светопоглощения Бугера-Ламберта-Бера, который связывает интенсивность поглощения с концентрацией вещества в анализируемом растворе (С) и толщиной поглощающего слоя (кюветы, l в см). В логарифмической форме этот закон имеет вид:
А = k·С·l,
где k - коэффициент поглощения, характерный для данного вещества при
определенной длине волны.
Если концентрация выражена в моль/л, то k называется молярным коэффициентом поглощения (ε, моль-1·л·см-1), если в г/л - массовым (а, г-1·л·см-1).
Как видно из закона Бугера-Ламберта-Бера, непосредственно измеряемая на приборе величина оптической плотности при определенной длине волны (светофильтре) и толщине кюветы прямо пропорциальна концентрации, что позволяет применять при количественном фотометрическом анализе методы калибровочного графика, стандартного раствора и добавок. При количественных измерениях величина оптической плотности анализируемых и стандартных растворов должна находится в интервале от 0,2 до 0,8, что обеспечивает наибольшую точность определений.
Пример 1. Во сколько раз уменьшится интенсивность света при прохождении его через 5·10-4 М раствор вещества в кювете толщиной 10 мм, если молярный коэффициент поглощения вещества равен 2·103 моль-1·л·см-1?
Решение. В соответствии с законом Бугера-Ламберта-Бера
A = lg(I0/I) = ε·С·l = 2·103·5·10–4·1 = 1,
следовательно I0/I = 101 = 10, т.е. интенсивность света уменьшится в 10 раз.
Пример 2. При фотометрировании стандартного раствора вещества
(М = 289 г/моль) с концентрацией 2·10–4 моль/л получена величина оптической плотности 0,392. Рассчитать величины молярного и массового коэффициентов поглощения вещества и определить концентрацию этого вещества в анализируемом растворе, оптическая плотность которого равна 0,568.
Решение. Исходя из основного закона светопоглощения
ε = Aст/(Cст·l) = 0,392/(2·10–4·2) = 980 моль-1·л·см-1.
Тогда
а = ε /М = 980/289 = 3,39 моль-1·л·см-1.
Рассчитать концентрацию вещества в анализируемом растворе можно непосредственно по закону Бугера-Ламберта-Бера
Сx = Ах/( ε ·l) = 0,568/(980·2) = 2,9·10–4 моль/л,
либо по методу стандартного раствора (стандарта):
Сх = Сст·Ах/Аст = 2·10–4·0,568/0,392 = 2,9·10–4 моль/л.
Пример 3. При фотоколориметрическом определении Fe3+ с сульфосалициловой кислотой из стандартного раствора с содержанием железа 10 мг/мл приготовили ряд стандартных растворов в мерных колбах вместимостью
100 мл, измерили оптическую плотность полученных растворов и получили следующие данные:
Vст, мл |
1,0 |
2,0 |
3,0 |
4,0 |
5,0 |
А |
0,12 |
0,25 |
0,37 |
0,50 |
0,62 |
Построить калибровочный график, определить концентрацию Fe3+ и рассчитать его массу в 250 мл анализируемого раствора, если оптическая плотность этого раствора равна 0,30.
Решение. Строим калибровочный график А = f(C, мг/мл) и по нему находим концентрацию ионов железа 0,24 мг/мл, а затем рассчитываем массу железа в анализируемом растворе:
m(Fe3+) = C(Fe3+)·Vр-ра·M(Fe3+) = 0,24·0,250 = 60 мг = 0,060 г.
ИК-спектроскопия
Данный метод позволяет проводить неразрушающий контроль структуры различных материалов. Например, изучая свойства пленок на полупроводниковых подложках, по ИК-спектрам можно определить качественно и количественно по закону Бугера-Ламберта-Бера наличие влаги, углекислого газа, оксида и нитрида кремния, оксида фосфора и т.д. В материале по валентным колебаниям длины химической связи OH–, CO2, SiO2, Si3N4, P2O5 - 3600-3200, 2300, 1100, 900, 1250 см-1 соответственно ИК-спектроскопия позволяет определять не только структуру, качество, но и толщину пленок полупроводников и диэлектриков на высокоомных полупроводниковых подложках кремния и германия.
Вопросы и задачи для самостоятельного решения
На чем основано определение исследуемых веществ в фотометрическом методе анализа?
Каковы преимущества и недостатки фотометрического метода анализа?
Какова природа спектров поглощения в ультрафиолетовой, видимой и инфракрасной областях спектра? Для каких целей применяется спектрофотометрия в указанных областях?
Назовите интервалы длин волн ультрафиолетовой, видимой и инфракрасной областей спектра.
Каков физический смысл молярного коэффициента поглощения? От чего он зависит и как связан с чувствительностью реакции?
Как связана чувствительность определения с толщиной поглощающего слоя и с молярным коэффициентом поглощения?
Рассчитайте чувствительность определения (моль/л) и определяемый минимум (мкг) меди по реакции с диэтилдитиокарбаминатом (состав комплекса CuR) при = 436 нм, толщине поглощающего слоя l = 5 см и минимальном объеме окрашенного раствора V = 25 мл. Молярный коэффициент поглощения окрашенного соединения 436 = 12,8103. Минимальная величина оптической плотности, измеряемая прибором, равна 0,005.
Ответы: 7,810-4 моль/л; 0,124 мкг.
Вычислите чувствительность определения азобензола (моль/л) образующего окрашенный раствор при = 438 нм. Молярный коэффициент поглощения азобензола = 1100 (A = 0,356; l = 5,00 см).
Ответ: 6,510-5 моль/л.
Вычислите молярный коэффициент поглощения железа по реакции с ортофенантралином (FeR3) при = 390 нм, толщине поглощающего слоя
l = 5,00 см и концентрации, равной 0,52 мкг/мл. Величина оптической плотности равна 0,05.
Ответ: 1,05103.
С помощью чего в спектрометре создается монохроматический пучок света? Какова роль фотоэлемента? Какие фотоэлементы используются в спектрофотометре СФ-26?
Для чего в фотоколориметрах применяют светофильтры?
Чем руководствуются при выборе светофильтров для проведения фотометрических измерений?
На чем основано фотометрическое определение германия, меди и железа в материалах микроэлектроники? Каковы условия проведения реакций?
На чем основано определение фосфора и кремния в материалах микроэлектроники? Каковы условия проведения реакций?
Как зависит оптическая плотность раствора от его pH?
Для чего применяют экстракцию при фотометрических определениях?
Для каких целей применяются дифференциальный спектрофотометрический метод и метод спектрофотометрического титрования?
Для спектрофотометрического определения железа в промышленной воде после упаривания и обработки 0-фенантролином было получено 25 мл окрашенного раствора. Оптическая плотность этого раствора при толщине слоя 1 см равна 0,460. Определите содержание железа в промышленной воде (в мг/л), если молярный коэффициент поглощения этого окрашенного соединения равен 1100.
Ответ: 5,84 мг/л.
Для определения правильности измерений спектрофотометра используют раствор KNO3. Рассчитайте молярный коэффициент поглощения раствора KNO3, если 30,36 г KNO3 растворили в 1 л воды, оптическая плотность раствора равнялась 1,04 в кювете 5 мм.
Ответ: 6,93.
Для каких областей спектра предназначены приборы, оптические детали которых выполнены из: а) стекла; б) кварца; в) KBr; г) NaCl.
21. Расскажите о применении уравнения калибровочного графика. параметры которого вычисляются по методу наименьших квадратов.
22. Рассчитайте пределы измерения оптической плотности растворов, если если пределы изменений поглощения света составляют от 4 до 88 %.
Ответ: 0,017 – 0,921.
23. Выразите оптическую плотность в % пропускания:
a) 0,054; б) 0,801; в) 0,521.
Ответы: a) 88,3%, ) 15,81%, ) 30,13%
24. Переведите данные измерения пропускания в оптическую плотность:
а) 22,2% ; б) 52,5%; в) 79,8% .
Ответы а) 0,636; б) 0,280; в) 0,098.:
25. Пропускание раствора KМnО4 с концентрацией 5 мкг/мл, измеренного в кювете с l=2 см при 520 нм равно 0,400. Рассчитайте молярный коэффициент поглощения KМnО4.
Ответ: 0,6·104.
26. Пропускание раствора с концентрацией алюминия 3,2 мг в 100 мл, измеренное при 480 нм в кювете l=2 см, равно 34,6 %. Рассчитайте молярный коэффициент поглощения этого вещества.
Ответ: 1,96·102.
27. К аликвотной части раствора 25,00 мл, содержащего 4,5 мкг/мл Fe(III) прибавили избыток KCNS и разбавили до 50 мл. Какова оптическая плотность полученного раствора, измеренная при 570 нм в кювете с l=2 см. (Молярный коэффициент поглощения железа с роданид-ионами равен 5,5·103).
Ответ: 0,440.
28. В каких единицах выражается молярный коэффициент поглощения, если концентрация выражена в мкг/мл?
Ответ: в см–1·л·мг–1.
29. Навеску стали 1,2 г растворили в кислоте и разбавили раствор водой до 50 мл. Из 5 мл этого раствора после соответствующей обработки было получено 100 мл окрашенного раствора. Оптическая плотность этого раствора оказалась равной 0,12. Из стандартного раствора, содержащего 0,1124 г Н2МоО4·2Н2О в 100 мл раствора, были отобраны указанные ниже объемы и после обработки фенилгидразином и разбавления до 100 мл получены следующие оптические плотности:
Объем, мл |
2 |
4 |
6 |
8 |
10 |
Оптическая плотность |
0,05 |
0,11 |
0,16 |
0,21 |
0,25 |
Вычислить массовую долю молибдена в стали (в%).
Ответ: 2,06%.
30. Для каких целей применяются дифференциальный спектрофотометрический метод и метод спектрофотометрического титрования?
31. Для спектрофотометрического определения железа в промышленной воде после упаривания и обработки 0-фенантролином было получено 25 мл окрашенного раствора. Оптическая плотность этого раствора при толщине слоя 1 см равна 0,460. Определите содержание железа в промышленной воде (в мг/л), если молярный коэффициент поглощения этого окрашенного соединения равен 1100.
Ответ: 5,84 мг/л.
32. Для определения правильности измерений спектрофотометра используют раствор KNO3. Рассчитайте молярный коэффициент поглощения раствора KNO3, если 30,36 г KNO3 растворили в 1 л воды, оптическая плотность раствора равнялась 1,04 в кювете 5 мм.
Ответ: 6,93.
33. Назовите преимущества метода инфракрасной спектрофотометрии по сравнению с другими физико-химическими методами анализа. Приведите примеры применения инфракрасной спектрофотометрии в микроэлектронике. На чем основан качественный анализ в инфракрасной области спектра? Что такое валентные колебания химической связи, деформационные колебания угла между связями?
Атомно-абсорбционная спектроскопия
Самый чувствительный метод одноэлементного анализа, пределы обнаружения для многих элементов составляют 10–9-10–7 % (массвых).Селективность ААС выше, чем эмиссионного спектр. анализа (нет наложения спектральных. линий).
Главный недостаток - трудность осуществления многоэлементного анализа, для каждого элемента нужен свой источник излучения. По этой причине он не пригоден для качественного анализа.
Основой метода является способность атомов, находящихся в парообразном состоянии, при определенных условиях излучать лучи определенных длин волн (характеристическое излучение). Вместе с тем, атомы способны поглощать то излучение, которое сами испускают.
Таким образом, длина волны лучей, поглощенных атомами элемента, совпадает с длиной волны его характеристического излучения (атомы находятся в свободном, а не в возбужденном состоянии).
Методика ААС анализа заключается в том, что исследуемое вещество вводят в газовое пламя, одновременно пламя освещают светом с непрерывным спектром, например, от лампы накаливания или от трубки с полым катодом.
В полученном спектре интенсивность света в области характеристических частот будет меньше интенсивности ближайших соседних участков спектра.
В отличие от эмиссионного спектрального анализа, роль атомизатора состоит только в переводе пробы в атомарное состояние, но не в возбуждении атомов. Рабочий диапазон t° 800 - 3000°C.
В качестве атомизаторов используют пламя, графитовые трубки различной конструкции, полый катод.
Чем больше концентрация определяемого элемента в атомизаторе (зона пламени горелки, электроатомизаторе и др.), тем интенсивнее поглощение определяемого элемента. Результат анализа рассчитывают, используя зависимость величины атомного поглощения (Аx) от концентрации определяемого элемента (Сx):
Аx
= lg![]() kℓCx
,
kℓCx
,
где Аx – адсорбция поглощающего слоя плазмы;
I0 – интенсивность исходного излучения;
It – интенсивность ослабленного излучения;
k – коэффициент поглощения света свободными атомами;
ℓ – толщина поглощающего слоя плазмы;
Cx - концентрация поглощающих частиц.
Ослабление интенсивности в области характеристических частот измеряют при помощи фотоэлектрической установки:
Для определения концентраций элементов атомно-абсорбционным методом используют: метод сравнения, метод калибровочного графика и метод добавок.
Сущность метода сравнения состоит в том, что при одном режиме работы атомно-абсорбционного спектрофотометра измеряют величины атомного поглощения стандартного (Аст) и анализируемого (Аx) растворов и далее рассчитывают концентрацию определяемого элемента по формуле:
Cx
= Сст·![]() .
.
Конечный результат рассчитывают с учетом величины навески анализируемой пробы и ее дальнейшего разбавления. Важнейшим условием метода является близость химического состава исследуемого и стандартного растворов.
По методу калибровочного графика готовят 5 – 7 стандартных растворов определяемого элемента и измеряют их атомные поглощения. Строят калибровочный график в координатах Аст – Сст. Одновременно измеряют поглощение анализируемого раствора (Аx) и по графику методом интерполяции находят концентрацию определяемого раствора (Cx).
Метод добавок позволяет пр проведении анализа уменьшать влияние примесей В качестве растворов сравнения используются растворы анализируемых проб с добавками:
Cx; Cx + С1; Cx + С2; Cx + С3,
причем добавки стандартного раствора должны находиться в пределах
~1/2 Cx; ~ Cx или 2 Cx.
Для каждого из полученных растворов измеряют атомное поглощение и строят калибровочный график в координатах А – С (рис 8.) Точка пересечения прямой с осью абсцис дает величину Cx, то есть концентрацию определяемого элемента в анализируемой пробе.

Рис. 8. Калибровочный график для определения концентрации методом добавок.
Возможен также аналитический путь расчета концентрации Cx по любой из точек:
Cx
= C1·![]() .
.
Преимущество метода добавок заключается в том, что часто удается компенсировать влияние физико-химических и инструментальных помех.
Пример1. При определении магния методом сравнения взяли навеску сплава массой 0,1 г, растворили ее в смеси кислот и перенесли в мерную колбу вместимостью 200 мл. Для анализа взяли 1,00 мл раствора в мерную колбу вместимостью 100 мл. Атомное поглощение этого раствора (Аx) составило 35 единиц шкалы прибора при 285,2 нм. Стандартный раствор магния (Сст) с концентрацией 1 мкг в 1 мл характеризуется поглощением (Аст) в 40 делений шкалы.
Определить массовую долю магния в сплаве.
Решение.Концентрацию магния рассчитывают по формуле:
Аx
= Сст.·![]() ,
,
где n – число аликвотных частей, равное 200/10;
n1 – разбавление аликвотной части, равное (100/10) 10.
Аx
=
1·![]() мкг
=1750·10–6
г.
мкг
=1750·10–6
г.
![]()
Пример 2. При определении марганца в алюминии атомно абсорбционным методом при 279,5 нм был построен калибровочный график по следующим данным:
С(Mn) мкг/мл 0,5 1,0 1,5 2,0
А(Mn),(делений шкалы) 12 25 37 49
Навеска анализируемого образца массой 0,2 г растворена в смеси кислот и перенесена в мерную колбу вместимостью 100 мл.
Определите массовую долю марганца в алюминии (в %).
Решение. Строим калибровочный график в координатах С(Mn) – А(Mn). По графику методом интерполяции по величине Аx находим Cx ; получаем:
Cx = 0.925 мкг марганца в 1 мл.
Массовая доля марганца в алюминии:
![]() .
.
Пример 3.При определении магния методом добавок в две мерные колбы вместимостью 50 мл прилили по 20,00 мл анализируемого раствора и в одну из них 5 мл стандартного раствора магния с концентрацией его 4 мкг/мл, после чего объемы растворов в мерной колбе довели до метки дистиллированной водой.
Атомное поглощение этих растворов при 285,2 нм оказалось равным 15 и 23 единицы соответственно.
Определите концентрацию магния (Cx) в анализируемом растворе (в мг/мл) расчетным методом .
Решение. Расчет концентрации магния проводится по формуле:
Cx
= Cст·![]()
где Аx = 15; Аx+ст = 23; Сст= 20 мкг;
Cx
= 20·![]() мкг
(в 20 мл);
мкг
(в 20 мл);
Cx
=
![]() мг/л.
мг/л.
Вопросы и задачи для самостоятельного решения
1. В чем сущность атомно-абсорбционного анализа?
2. Какие физические процессы происходят в атомизаторе?
3. Каким уравнением описывается поглощение атомной плазмой?
4. Какие приборы используются в атомно-абсорбционном анализе?
5. Каким требованиям должен удовлетворять источник света?
6. Какие области спектра исследуются в атомно-абсорбционном методе?
7. Какими методами определяют концентрации растворов в атомно-абсорбционном анализе?
8. Назовите область применения метода атомно-абсорбционной спектроскопии.
9. Назовите недостатки и достоинства метода атомно-абсорбционной спектроскопии.
10. При определении цинка в чистом алюминии методом сравнения взяли навеску алюминия массой 1,0 г, растворили в кислоте и перенесли в мерную колбу вместимостью 100 мл. Атомное поглощение этого раствора при
213,9 нм составляет 6,0 делений на шкале прибора. Стандартный раствор цинка концентрации 0,6 мкг/мл дает показание прибора по шкале 11,5 делений. Определить массовую долю цинка в алюминии.
Ответ: 3,1·10–3%.
11. При определении магния методом сравнения взяли навеску сплава массой 0,3г, растворили в смеси кислот и перенесли в мерную колбу вместимостью 250 мл. Перед измерением атомного поглощения раствора магния
5 мл пробы разбавили до 200 мл. Интенсивность поглощения этого раствора при 285,2 нм составила 42 единицы шкалы.
Поглощение стандартного раствора магния с концентрацией 1,5 мкг/мл составляет 55 делений шкалы. Определить массовую долю магния в пробе.
Ответ: 5,73%
12. При определении свинца в электролите методом сравнения анализируемый раствор разбавили в 100 раз. Атомное поглощение этого раствора при 324 нм составляет 24 единицы шкалы прибора. Стандартный раствор с концентрацией 100 мкг/мл имеет поглощение 32 единицы.Определить концентрацию меди (в г/л) в электролите.
Ответ: 7,5 г/л.
13. При определении цинка в алюминии атомно-абсорбционным способом при 213,9 нм был построен калибровочный график по следующим данным:
С(Zn), мкг/мл 0,3 0,5 0,8 1,0
А(Zn) делений 7,5 11,5 16,33 21,5
Навеску анализируемого образца массой 0,5 г растворили в смеси кислот и перенесли в мерную колбу вместимостью 50 мл. Атомное поглощение этого раствора составляет 15 делений шкалы. Определить молярную долю цинка в образце.
Ответ: 7·10–3%.
14. Навеску сплава массой 0,25 г растворили в смеси кислот (НNО3 + Н2SО4), перенесли в мерную колбу вместимостью 500 мл. Интенсивность атомного поглощения марганца при 279,5 нм равна 25 делений шкалы .
Определить массовую долю марганца в сплаве методом калибровочного графика.
Для построения графика получены следующие данные:
С(Mn),мкг/мл 2,0 4,0 6,0 8,0 10
А(Mn), делений 10 20 30 40 50
Ответ: 1,0%.
15. При определении свинца в биологическом объекте использовали метод добавок. Для анализа взяли по 50 мл исследуемого раствора и перенесли в две делительные воронки. В одну из них прибавили 0,5 мл стандартного раствора свинца с концентрацией 60 мг/л. Свинец экстрагировали в органическую фазу и его содержание в ней определяли атомно-абсорбционным методом по линии поглощения при 283,3 нм.
Определить концентрацию свинца в анализируемом объекте (в мкг/л), если поглощение экстракта свинца в анализируемом растворе и в растворе с добавкой стандартного раствора равно 0,300 и 0,620 соответственно.
Ответ: 0,56 мг/л.
16. При определении магния методом добавок в две мерные колбы вместимость. 25 мл прилили по 10 мл анализируемого раствора и в одну из колб – 10 мл стандартного раствора магния с концентрацией 1 мкг/мл, после чего объемы растворов в мерных колбах довели до метки дистиллированной водой. Атомное поглощение этих растворов при 285,1 нм составляет 20 и 38 единиц соответственно. Определить концентрацию магния в анализируемом растворе (в мг/л).
Ответ: 1,1 мг/л.
Эмиссионный спектральный анализ
Метод эмиссионного спектрального анализа применяется для определения примесей в различных материалах. Чувствительность определения по разным элементам лежит в пределах 10-3 - 10-5 %.
Методы предварительного концентрирования примесей позволяют на 2-3 порядка повысить чувствительность определений.
Относительная ошибка определений составляет (10-30) %, поэтому метод применим для определения больших концентраций.
Основу метода определяет способность атомови ионов находиться в нормальном или возбужденном состояниях. В нормальном состоянии атомы (ионы) обладают минимальной энергией Е0 Под влиянием высоких температур (дуговой или искровой разряд) происходит переход валентных электронов с нормального уровня на один из более высоких уровней Е1, Е2, ...Еn.
По
истечении ~ 10–8
с возбужденный атом возвращается в
нормальное или какое-либо промежуточное
состояние. Освобождающаяся при этом
энергия ΔЕ
= Е2
– Е1
излучается в виде кванта света (h![]() ):
):
ΔЕ
= Е2
– Е1
=
![]() ,
,
где Е2 и Е1 – энергии исходного и возбужденного состояний;
h – постоянная Планка;
c – скорость света;
λ – длина волны излучения;
– частота излучения.
Число энергетических переходов определяется строением электронных уровней каждого элемента. Каждому переходу соответствует определенная линия в спектре излучения. По числу и положению линий в спектрах излучения проводят качественный анализ.
Анализируемое вещество, попадая в источник возбуждения (дуговой, искровой и т.д.), переходит в парообразное состояние, ионизируется, при этом испускается свет интенсивностью I. Чем больше концентрация определяемого элемента C, тем больше I. Количественно эту зависимость определяет уравнение Ломакина:
I = a C b,
где a и b - постоянные константы, связанные с условиями данного эксперимента.
Прологарифмировав уравнение Ломакина, можно получить линейную зависимость:
lg I = lg a + b lg C.
Однако интенсивность света зависит не только от концентрации, но и от многих других факторов (скорости испарения, нестабильности горения, силы тока дуги и т.д.). Введя линию сравнения (как правило, элемент основы), можно перейти к относительной интенсивности (Iл/Iср), которая не будет зависеть от условий съемки, а будет определяться только концентрацией.
При фотографировании спектра имеют дело с почернением спектральной
линии на фотопластинке S. Связь между почернением и интенсивностью па падающего света дается характеристической кривой фотопластстинки, рис.9.
Для прямолинейного участка BC: I = lg I – j,
где - контрастность, а
j - инерция фотопластинки.
Для линии примеси и линии сравнения можно записать:
S1 = lg I1 – j; S2 = lg I2 – j.
Относительную интенсивность двух линий можно определить по разности их почернения, зная фактор контрастности пластинки :
S = S1 – S2 = lg(I1/I2); S/ = lg(I1/I2).
Рис 9 Характеристическая кривая фотопластинки

В количественном спектральном анализе существуют: метод трех эталонов, метод постоянного графика и метод добавок.
При использовании метода трех эталонов фотографируются спектры минимум трех эталонов (образцы известной концентрации), затем спектры анализируемых образцов и строится калибровочный график в координатах
S - lgC.
Метод постоянного графика применяется при массовых анализах однородных проб, когда зная контрастность фотопластинок, пользуются однажды построенным постоянным графиком в координатах S/ - lgC.
При работе в области нормальных почернений это будет равносильно координатам lgIл/Iср - lgC.
При работе в области недодержек по характеристической кривой фотопластинки (S - lgI) для значений Sл и Sср находят lgIл и lgIср и строят график в координатах (lgIл/Iср) - lgC.
В области недодержек для устранения искривления графика необходимо из почернений линий вычесть почернение фона фотопластинки, измеренного рядом с линией.
Метод добавок используется при анализе единичных образцов неизвестного состава. Особые трудности связаны с приготовлением эталонов, состав которых должен быть точно идентичен составу пробы (эффект влияния третьего компонента). В этом случае анализируемую пробу делят на части и в каждую из них вводят определяемый элемент в известных концентрациях.
Если концентрации малы и уравнение Ломакина имеет упрощенный вид
I = a C b (b = 1),
то достаточно одной добавки:
Ix = a Cx I1 = a(Cx + C1),
![]() ,
,
отсюда легко определяется Cx.
Если b 1 и I = a C b, необходимы по крайней мере две добавки:
(Cx + C1) и (Cx + C2).
После фотографирования и измерения почернения линии на фотопластинке строят калибровочный график в координатах
(S/ – lgC),
где S = Sл - Sф.
Построив калибровочный график зависимости lg(Iл/Iф) от величины добавки, можно экстраполяцией этой зависимости к нулю найти значение концентрации Cx.
Кроме графического метода применяют расчетный метод, особенно если число добавок велико (С1, С2, ...Сn).
Пример1. Вычислите длину волны (λ) резонансной линии атома натрия, если энергия возбуждения резонансного уровня (ΔE) равна 2,1 эВ.
Решение. Длина волны вычисляется из соотношения
λ = hc/ΔE,
где h – постоянная Планка (h = 4,1354·10–15 эВ/с);
с – скорость света ( с = 2,9979·108м/с или 2,9979·1017 нм/с);
λ
=
![]() нм.
нм.
Пример 2. В спектре пробы между линиями железа λ1 = 304.26 нм и
λ2 = 304,508 нм имеется еще одна линия. Вычислить длину волны этой линии
λx, если на экране спектрофотометра она удалена от первой линии железа на
1,5 мм, а от второй – на 2,5 мм.
Решение. Длину волны λx вычисляют из соотношения:
λx
=
![]() ,
,
где ℓx – расстояние от первой линии железа до неизвестной линии;
ℓ – расстояние между известными линиями железа;
Подставив данные, получаем:
λx
= 304,266 + (304,508 – 304,266)·![]() нм.
нм.
Пример 3. При анализе контактного материала на хром по методу трех эталонов на микрофотометре МФ-2 измерено почернение S линий гомологической пары в спектрах эталонов и исследуемого образца. Найти процентное содержание хрома CCr по следующим данным:
Эталон |
I |
II |
III |
Образец |
CCr |
0,50 |
1,23 |
4,17 |
x |
SCr |
0,07 |
0,37 |
0,86 |
0,61 |
SFe |
0,27 |
0,23 |
0,27 |
0,25 |
Решение. В методе трех эталонов используется зависимость разности S почернений линий гомологической пары от логарифма концентрации определяемого элемента. При определенных условиях эта зависимость близка к линейной. По показаниям измерительной шкалы микрофотометра находим:
S1 = 0,07 - 0,27 = -0,20;
S2 = 0,37 - 0,23 = 0,14;
S3 = 0,86 - 0,27 = 0,59.
Определяем по данным логарифмы концентраций
lgC1 = –0,30; lgC2 = 0,09; lgC3 = 0,62 и строим калибровочный график в координатах S – lgC.
Находим S для анализируемого образца:
Sx = 0,61 – 0,25 = 0,36
и по калибровочному графику определяем lgCx:
lgCCr = 0,35; CCr = 2,24 %.
Пример 4. Определить содержание меди в пробе порошка (в %) методом постоянного графика (lgIл - lgC) с учетом фона (фон - вместо линии сравнения) по следующим данным:
для построения характеристической кривой фотопластинки:
S |
0,02 |
0,04 |
0,10 |
0,21 |
0,30 |
0,73 |
1,02 |
1,4 |
1,7 |
I |
0,35 |
|
0,82 |
1,25 |
1,80 |
5,00 |
10 |
20 |
42 |
для построения калибровочного графика:
lgC |
-5,0 |
-4,52 |
-4,00 |
-3,52 |
-3,00 |
lgIл |
0,38 |
0,70 |
1,11 |
1,61 |
1,98 |
почернение анализируемого элемента меди по линии = 3247 А, сфотографированного трижды:
Nсп |
Sл+ф |
Sф |
Sл+ф - Sф |
(Sn)сред |
1 |
1,52 |
0,07 |
|
|
2 |
1,52 |
0,06 |
|
|
3 |
1,6 |
0,08 |
|
|
Указания к решению.
Построить характеристическую кривую фотопластинки в координатах
S - lgI.
Построить калибровочный график в координатах
lgIл - lgC (lgIл = lg(Iл+ф/Iф), фон уже учтен.
Для анализируемого образца на медь, сфотографированного трижды, вычесть фон (Sл+ф-Sф); найти среднее значение из трех (Sл)ср; по характеристической кривой по (Sл)ср найти lgIср; по калибровочному графику по lgIср найти lgC. Выразить концентрацию меди в процентах.
Ответ: CCu = 2,710-4 %.
Пример 5. Определить содержание ниобия в образце (в %) методом добавок по следующим данным (Ti - линия сравнения):
почернение аналитических линий:
Части пробы |
Концентрация Nb в пробе с добавками, % |
SNb |
STi |
INb |
ITi |
INb/ ITi |
Исходная |
C0 |
0,59 |
0,75 |
|
|
|
С первой добавкой |
C0 + 0,2 |
0,91 |
0,76 |
|
|
|
С0 второй добавкой |
C0 + 0,6 |
1,47 |
0,78 |
|
|
|
2) почернение ступенек линии в спектре, снятом со ступенчатым ослабителем (для построения характеристической кривой фотопластинки):
Ступенька в ослабителе |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
lgI |
0,84 |
1,00 |
1,19 |
1,34 |
1,51 |
1,69 |
1,84 |
2,00 |
S |
0,46 |
0,55 |
0,68 |
0,82 |
1,04 |
1,32 |
1,51 |
1,81 |
Указания к решению.
Построить характеристическую кривую фотопластинки в координатах
S - lgI.
По характеристической кривой определить по почернению S для линии примеси Nb и линии сравнения Ti логарифм интенсивности и отношение lgINb/ITi для исходной пробы и для спектров пробы с добавкой ниобия.
Построить график в координатах lg(INb/ITi)-C;
C вычислим следующим образом (из всех частей вычтем C0):
C0 – C0 = 0;
C1 = C0 + 0,2 – C0 = 0,2;
C2 = C0 + 0,6 – C0 = 0,6.
Ответ: 0,13 %.
Вопросы и задачи для самостоятельного решения
Что является источником возбуждения в эмиссионном спектральном анализе?
Привести оптическую схему спектрографа.
Что называется характеристической кривой фотопластинки?
Методы построения кривой фотопластинки.
На чем основан качественный спектральный анализ?
Как проводится расшифровка спектра?
На чем основаны методы количественного спектрального анализа?
Привести уравнение Ломакина.
Что называется гомологической парой линий?
В чем сущность следующих методов спектрального анализа: а) трех эталонов; б) постоянного графика; в) метода добавок?
Привести примеры спектрального анализа полупроводниковых материалов.
14. Построить калибровочный график и определить (в %) концентрацию хрома и марганца в двух образцах феррованадия по следующим данным:
Образец |
Номер образца |
Концентрация, % |
Почернение |
||
Mn |
Cr |
SMn, Fe |
SCr, Fe |
||
Эталон
|
1 |
1,26 |
1,00 |
+0,46 |
-0,10 |
2 |
1,06 |
0,68 |
+0,34 |
-0,25 |
|
3 |
1,16 |
1,29 |
+0,39 |
-0,04 |
|
Проба
|
|
|
|
+0,42 |
-0,01 |
1 |
C1 |
C2 |
+0,41 |
-0,01 |
|
|
|
|
+0,40 |
-0,02 |
|
|
|
|
+0,35 |
-0,155 |
|
2 |
C3 |
C4 |
+0,38 |
-0,156 |
|
|
|
|
+0,35 |
-0,160 |
|
Ответы: C = 1, 18; C = 1, 24.
15. Определить содержание меди (в %) в образце сульфида кадмия методом добавок по следующим данным:
Содержание меди, % |
SCu |
SCd (линия сравнения) |
x |
0,74 |
0,90 |
x + 0,02 |
1,06 |
0,91 |
x + 0,06 |
1,62 |
0,93 |
Почернение ступенек линии в спектре, снятом со ступенчатым ослабителем, следующее:
Ступенька |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
Логарифм пропускамости |
1,09 |
1,15 |
1,34 |
1,59 |
1,66 |
1,84 |
1,99 |
2,15 |
Почернение ступеньки |
0,61 |
0,70 |
0,83 |
0,97 |
1,19 |
1,47 |
1,66 |
1,95 |
Ответ: 0,013.
16. Определить массовую долю (в %) хрома в стали, если при фотометрировании спектрограммы эталонного образца стали получили данные:
Эталон |
1 |
2 |
3 |
Образец |
С(Cr)% |
1,82 |
3,85 |
10,20 |
x |
CCr |
0,08 |
0,102 |
0,120 |
0,102 |
SFe |
0,058 |
0,07 |
0,04 |
0,055 |
Ответ:3,19 %.
17. Определить длину волны резонансной линии в атомных спектрах элементов по энергии возбуждения резонансного уровня (ΔЕ)
Элемент |
K |
Li |
Cu |
Be |
ΔЕ, эВ |
1,6 |
1,9 |
2,8 |
5,3 |
Ответы: λK = 772,5 нм; λLi = 649 нм; λCu =324,2 нм; λBe =232,4 нм.
18. Определите область нормальных почернений при следующих данных:
lgI
|
0,5 |
0,75 |
1,0 |
1,25 |
1,5 |
1,75 |
2,0 |
2,2 |
S
|
0,12 |
0,3 |
0,6 |
0,95 |
1,30 |
1,65 |
1,03 |
2,05 |
Ответ: от 0,8 до 1,8.
Люминесцентный анализ
Люминесцентный метод анализа отличается высокой чувствительностью и находит широкое применение при анализе полупроводников и материалов высокой чистоты, в которых необходимо контролировать примеси ≤ 10–8 %.
Люминесценция это «холодное свечение», его не следует смешивать со свечением раскаленных тел.
Люминесцируют многие вещества во всех трех агрегатных состояниях:
-газы и пары многих элементов (O2, S, I2 )
-твердые вещества (соли уранила, кристаллофоры-ZnS, CdS c добавками активаторов Ag, Cu, Mn и т.д.)
- растворы различных красителей и органических соединений.
Для возбуждения люминесценции вещества, необходимо извне подвести определенное количество энергии. При этом частицы вещества переходят в возбужденное состояние на какое то время, после чего возвращаются в исходное состояние, отдавая часть энергии возбуждения в виде квантов люминесценции.
Энергетический выход люминесценции (Вэ) - отношение излучаемой веществом энергии (Ел) к поглощенной энергии возбуждения (Еп), за счет которой возникла люминесценция:
Вэ
=
![]() .
.
Выход люминесценции зависит от:
- длины волны возбуждающего света
- концентрации люминесцирующего вещества
- наличия посторонних примесей
- природы растворителя и рН раствора
- температуры
Уменьшение величины выхода люминесценции под влиянием этих факторов носит название - гашение люминесценции.
Наибольшее гашение люминесценции вызывают увеличение концентрации (до 10–3 - 10–4 моль/л ) и повышение температуры.
Влияние примесей может иметь физический или химический характер, что тоже ведет к гашению люминесценции.
Спектр люминесценции - функция распределения излучаемой веществом энергии по частотам или длинам волн.
В основе количественного анализа лежит зависимость интенсивности люминесценции (Iл) от концентрации (С):
Iл = kС
Для определения концентрации применяют метод калибровочного графика и метод добавок.
Для анализа чаще всего используют фотолюминесценцию, связанную с возбуждением исследуемых веществ в УФ или ВО спектра. Широко применяются органические реагенты, образующие комплексы, способные люминесцировать: оксиантрахиноны, фенилфлуороны, оксиазо- и оксиазометиловые соединения, 8- оксихинолин, его производные и др.
При понижении температуры до – 196°С наблюдается резкое увеличение интенсивности флуоресценции этих комплексов или появления их фосфоресценции.
Пример 4. Рассчитать концентрацию урана в растворе по данным определения методом люминесцентного анализа. Анализируемый раствор объемом 0,05 мл высушен и сплавлен со 100 мг смеси NaF и NaKCO3 (9:91). Относительная люминесценция плава составила 38% от люминесценции стандарта, содержащего 0,50 мкг урана.
Решение. Расчет концентрации урана (в мкг/мл) проводят по формуле:
С(U)
=
![]() мкг/мл/
мкг/мл/
Пример 5. При люминесцентном определении концентрации Al3+ в дистиллированной воде к 5 мл этой воды добавлен сульфосалицилаль-о -амидофенол и вода до 10 мл. В аналогичных условиях приготовлены растворы известной концентрации алюминия. При измерении интенсивности люминесценции растворов получены следующие результаты:
С мкгAl/10мл |
0,04 |
0,06 |
0,08 |
x |
Iл |
11 |
17 |
23 |
19 |
Рассчитать концентрацию алюминия в воде.
Решение. Интенсивность люминесценции пропорциональна концентрации:
Iл = kС
Построив калибровочный график, определяют концентрацию алюминия для образца (x) по величине Iл = 19 : Сx=0,067 мкг/5 мл или
С
(Al)
=
![]() мкг/мл.
мкг/мл.
В методе добавок возможен кроме графического аналитический путь расчета концентрации Cx по любой из точек построенного графика:
Cx
= C1·![]() .
.
Вопросы и задачи для самостоятельного решения
Что такое люминесценция?
Каковы преимущества и недостатки люминесцентного метода анализа?
В чем заключается механизм флуоресценции?
Чем руководствуются при выборе первичного и вторичного монохроматизирующего устройства для измерения интенсивности флуоресценции?
Как связаны между собой спектры поглощения и флуоресценции?
Что такое выход флуоресценции и как он связан с интенсивностью флуоресценции и концентрацией исследуемого вещества?
Что такое гашение флуоресценции? Какие факторы приводят к гашению флуоресценции?
На чем основано количественное определение неорганических веществ с помощью органических реагентов?
На чем основано флуоресцентное определение алюминия, кадмия и цинка? Каковы условия выполнения реакции? Какова чувствительность и избирательность реакций?
10. Определить содержание алюминия в соляной кислоте (пл.1,18) (в %) по следующим данным люминесцентного определения его с сульфосалицилаль-о -аминофенолом. Из 5 мл анализируемой кислоты (после выпаривания, растворения в кислотном буфере) приготовили три раствора: а) без добавления Аl3+, б) с добавлением 0,03 мкг Аl3+, в) с добавлением 0,05 мкг Аl3+.К этим растворам, а также к «холостому» раствору добавлено одинаковое количество реактива. При измерении люминесценции получены следующие данные:
С мкг Al3+, мкг 0 x (x + 0,03) (x + 0,05)
Интенсивность (Iл) 2 10 16 19
Ответ: 2,0·10–6%.
Хроматографические методы анализа
Хроматография представляет собой метод разделения смеси веществ, основанный на различиях их физических или химических свойств, влияющих на распределение веществ между двумя фазами в условиях направленного движения одной (подвижной) фазы относительно другой (неподвижной). Хроматография может быть использована в аналитических целях, для установления качественного и (или) количественного состава смесей, или препаративных, для очистки или концентрирования веществ. Существует ряд классификаций хроматографии в зависимости от используемых подвижных и неподвижных фаз, целей (препаративная, аналитическая, количественная, качественная), механизмов удерживания (адсорбционная, распределительная, ионообменная, эксклюзионная), вариантов проведения (колоночная, насадочная, капиллярная, плоскостная) и т. д., например:
Качественной характеристикой в хроматографии является какой-либо параметр удерживания (время, объем, расстояние, фактор удерживания) или специфический отклик в процессе детектирования (цвет пятна, наличие сигнала селективного детектора и др.). В большинстве практически используемых количественных определений наблюдается линейная зависимость сигнала детектора от количества определяемого вещества в пробе.
При хроматографическом анализе применяются методы внешнего стандарта, калибровки, внутреннего стандарта, абсолютной калибровки, метод добавок, внутренней нормализации.
Плоскостная (тонкослойная и бумажная) хроматография.
Тонкослойная хроматография проводится в тонком слое какого-либо сорбента, нанесенного на стеклянную или металлическую пластинку. Она применяется для быстрого разделения веществ, которое может быть основано на адсорбции, абсорбции или ионном обмене в зависимости от характера сорбента и растворителей. Разделение веществ методом распределительной хроматографии на бумаге основано на различии коэффициентов распределения этих веществ между двумя несмешивающимися жидкостями одна из которых находится в виде неподвижной фазы в порах бумаги (чаще всего вода).
Качественной характеристикой в плоскостной хроматографии является фактор удерживания Rf, который определяется как отношение расстояния на бумаге (пластинке) от стартовой линии до центра пятна компонента к расстоянию от старта до фронта растворителя. Чем сильнее взаимодействует вещество с сорбентом, тем меньше значение Rf . Полуколичественные определения проводят на основании интенсивности пятен или их площади на бумаге или пластине.
Пример 1. При хроматографировании на бумаге величины Rf составили для вещества A 0,42, для вещества B 0,34, для вещества C 0,76. Какое из указанных веществ присутствует в исследуемом растворе, если в тех же условиях при пробеге растворителя 9,5 см пятно оказалось на расстоянии 3,2 см от старта?
Решение. Рассчитываем величины фактора удерживания в анализиремой смеси.
![]()
Наиболее близкое значение Rf = 0,34 имеет вещество B, следовательно исследуемый раствор содержит только B.
Ионообменная хроматография.
В основе ионообменной хроматографии лежит обратимый обмен между ионами анализируемого раствора и ионогенными группами сорбента (ионита). Иониты представляют собой, как правило, полимерные органические соединения, содержащие функциональные группы, способные к обмену ионов. Иониты, способные к обмену катионов называют катиониты (содержат сульфо-, карбоксильные, оксифенильные и другие аналогичные группировки). Аниониты - это ароматические или алифатические амины, а также четвертичные аммониевые основания, привитые к полимерной основе. Катионит, содержащий обменные ионы водорода, называют Н-формой катионита. Может быть катионит в солевой форме, когда он содержит способные к обмену катионы металлов. Анионит может находиться в ОН-форме или в форме, называемой хлоридной, карбонатной и др.
Важным понятием в ионном обмене является обменная емкость, которая выражается максимальным количеством миллимоль эквивалентов ионов, которое может быть поглощено одним граммом ионита (измеряется ммоль/г). Различают динамическую и статическую обменную емкость. Последнюю определяют путем настаивания ионита с известным количеством кислоты или щелочи.
Пример 2. Рассчитать статическую обменную емкость анионита, если навеска его 1,054 г была залита 100,0 мл NaOH 0,09567 н. раствора, а на титрование 25,00 мл раствора после установления равновесия потребовалось
17,80 мл 0,09051 н. раствора HCl.
Решение. Реакцию ионного обмена можно представить как:
R-NH3+Cl– + OH– → R-NH3+OH– + Cl–
Для определения обменной емкости было всего добавлено:
100,0 ∙ 0,09567 Ммоль NaOh.
По окончании реакции в 25,00 мл раствора осталось:
17,80 ∙ 0,09051 Ммоль щелочи,
а в 100,0 мл - 17,80 ∙ 0,09051 ∙ 4 ммоль.
Вступило в реакцию обмена:
(100,0 ∙ 0,09567 - 17,80 ∙ 0,09051 ∙ 4) ммоль щелочи.
Тогда статическая обменная емкость:
![]() моль/г.
моль/г.
Газовая хроматография.
Газовая хроматография применяется для разделения и анализа газов, жидкостей и твердых веществ с молярными массами приблизительно до 400-500 г/моль. В отличие от других видов хроматографии, ГХ проводится при строго контролируемой температуре от 300°С до отрицательных значений. При выходе из колонки детектором фиксируется какое-либо физическое или физико-химическое свойство элюата, зависящее от наличия в нем анализируемых веществ и записывается в виде хроматограммы, которая имеет вид пиков (в большинстве случаев).
Качественной характеристикой в газовой хроматографии является время удерживания, относительное время удерживания, объем удерживания, относительный объем удерживания, расстояние удерживания на хроматограмме, индекс удерживания и др. Для количественного анализа применяются несколько различных приемов: метод абсолютной калибровки, метод внутреннего стандарта, метод простой нормировки, метод внутренней нормировки. Все они основаны на измерении какого-либо параметра (площади пика, высоты пика, произведения времени удерживания на высоту пика и т. д.), пропорционального концентрации.
Пример 3. Рассчитать состав смеси толуола и м-ксилола в %, если площади пиков этих веществ (в мм2) составляют соответственно 2810 и 3050. Массовые поправочные (калибровочные) коэффициенты соответственно равны 1 и 0,98.
Решение. Поскольку даны поправочные коэффициенты, то речь идет о методе внутренней нормировки. Измеряемыми параметрами являются площади пиков. Суммарное содержание обоих компонентов определится как:
2810 ∙ 1 + 3050 ∙ 0,98.
Процентное содержание:
-
толуола:
![]()
-
м-ксилола:
![]()
Вопросы и задачи для самостоятельного решения
На чем основано разделение компонентов смеси газо-жидкостной хроматографии?
Каковы требования к подвижной и неподвижной фазе в методе ГЖХ?
Каковы параметры удерживания, селективность неподвижной фазы и эффективность хроматографической колонки?
Что является критериями разделения?
Приведите принципиальную схему хроматографа и объясните назначение его основных частей.
Как провести количественный анализ методом газо-жидкостной хроматографии?
Какие методы используются в количественном анализе ГЖХ?
Каковы параметры хроматографического пика применяемые при количественных определениях?
Каковы достоинства методаГЖХ?
Как определяется количественный состав смеси углеводородов методом внутренней нормализации?
При хроматографировании на пластинках "Силуфол" и при использовании в качестве подвижной фазы смеси хлороформ-метанол (9:1) амидопирин, бутадион и димедрол имеют величины Rf равные 0,60; 0,05; 0,95 соответственно. Какие из перечисленных препаратов содержатся в неизвестной смеси, если при ее хроматографировании в тех же условиях получено два пятна на расстоянии 4,8 см и 4 мм от стартовой линии, а растворитель прошел
8,0 см. Нарисовать вид хроматограммы.
Нарисовать хроматограмму смеси, содержащей гексан, гептан и октан, если их времена удерживания составляют 60 с, 1 мин 45 с и 3 мин 31 с соответственно. Рассчитать массовую долю этих компонентов в смеси по методу внутренней нормализации (нормировки), если площади их пиков на хроматограмме равны 305, 508 и 122 мм2 соответственно. Относительные поправочные коэффициенты для веществ равны: fгексана = 0,96; fгептана = 1,00 и
fоктана = 1,05.
Как отделить примесь бензойной кислоты от бензоата натрия с помощью ионнообменной хроматографии. Выбрать ионит и написать уравнения ионнообменных реакций.
Написать уравнения реакций ионного обмена между: а) катионитом в Н-форме и ионами K+ и Al3+; б) катионитом в Na-форме и ионами Н+ и Ba2+; в) анионитом в ОН-форме и ионами SO42-; г) анионитом в Cl-форме и ионами NO3-.
Метрологические характеристики методов анализа
Никакое аналитическое определение невозможно без определенных погрешностей. Случайные и систематические погрешности можно объяснить следующими причинами:
1. Исследуемые вещества неоднородны. Отдельные небольшие части пробы могут иметь неодинаковый состав. Следует уметь правильно взять среднюю пробу.
2. Все необходимые для анализа величины, например, массу осадка, объем титранта, оптическую плотность и т. д. можно измерить только с ограничен-ной точностью.
3. В процессе анализа исследуемые пробы подвергаются химической обработке. Как правило, все химические реакции сопрвождаются явлениями, создающими случайные и систематические погрешности. Например, это могут быть различные солевые эффекты, явления соосаждения и другие, препятствующие полноте протекания реакций.
Существует два фактора, по которым можно судить о результатах анализа:
воспроизводимость полученных результатов;
2) правильность результатов (соответствие их содержанию в пробе)
Воспроизводимость зависит от случайной погрешности, правильность - от систематической погрешности.
Абсолютная ошибка (абс) - разность между полученным результатом и истинным (или наиболее достоверным ) значением определяемой величины, выраженная в абсолютных единицах.
Например, в кристаллическом BaCl2·2H2O было найдено 14,70% кристаллизационной воды. Из формулы содержание воды составляет 14,75%.
В данном случае абсолютная ошибка составит:
абс = 14,70 – 14,75 = – 0,05%.
Относительная
ошибка
(отн
) - отношение абсолютной ошибки к истинному
значению: отн
=![]() .
.
Если
истинное значение неизвестно, то вместо
него берут среднее арифметическое (![]() )
из результатов проделанных определений
и сравнивают с ним каждый из результатов
(
)
из результатов проделанных определений
и сравнивают с ним каждый из результатов
(![]() ).
Полученные величины (d
=
).
Полученные величины (d
=
![]() )
называются отклонениями от среднего
значения отдельных результатов.
)
называются отклонениями от среднего
значения отдельных результатов.
Вычисления в количественном анализе проводятся с точностью, соответствующей точности выполнения анализа. В ответе должно быть столько значащих цифр, чтобы только последняя из них была недостоверной.
Значащими цифрами называются все цифры данного числа, кроме нулей, стоящих слева, а также справа, если они заменяют собой неизвестные нам цифры или появляются при округлении. Так в числе 0,0035 значащами цифрами являются 3 и 5.
Если результат взвешивания на технических весах с точностью до 0,01 г составляет 7,2500 г, то последние «00» - незначащие; в случае, если точность весов составляет 0,0001 г - все цифры значащие.
Если нули находятся между цифрами, то являются значащами: 0,0305; 10, 0305.
Нули после запятой в десятичной дроби являются значащами, например,
4000,0 (5 знач. цифр), но 500 - знач. цифр может быть одна- 5, две-50 или
три -500. В этом случае число представляют в нормальном виде: n·10n; 5·102 (одна значащая цифра - 5); 5,0·102 (две значащих цифры - 5,0); 5,00·102 (три значащие цифры).
Точность результатов вычисления не может быть больше, чем у наименее точного из чисел, входящих в вычисления.
Пример1 . Необходимо вычислить сумму следующих масс: 5,2727; 0,075; 3,7; 2,12 г (у 3,7- только один знак после запятой).
Решение. При вычислении суммы всех масс - надо оставить одну запасную цифру и потом округлить результат:
x = 5,27+0,08+3,7+2,12 =11,17 г и округлить: x = 11,2 г.
Рекомендуется округлять конечные результаты после выполнения всех арифметических действий.
Пример 2. При приготовлении раствора соли Мора были слиты:
10,1 мл насыщенного раствора соли Мора с 2,55 мл H2SO4(конц. ) и
40 мл H2O. Каков объем полученного раствора?
Решение.
V = 40 + 10,1 + 2,55 = 52,65 мл, результат округляем до целых чисел:
V = 53 мл.
Пример 3. Представьте в нормальном виде объем колбы вместимостью 2000 мл, если точность определения объема 10 мл.
Решение. Погрешность измерения объема содержится в 3-й цифре, поэтому последний ноль - незначим, объем = 2,00·103 мл или 2,00 л.
Пример 4. Какова концентрация [Cl–] в растворе, полученном при сливании равных объемов, содержащих 2,00·10–5 М NaCl , 0,33·10–4 М KCl и 5,0·10–6 М HCl.
Решение. Преобразуем числа, чтобы уравнять показатели степеней:
2,00·10–5 = 0,2·10–4 (наименьшее число значащих цифр);
0,33·10–4 ; 5,0·10–6 = 0,050·10–4 ; Σ = 0,580·10–4 ≈ 0,6·10–4;
[Cl–]
=
![]() моль/л..
моль/л..
Цель всех аналитических исследований - нахождение результата, наиболее близкого к истинному содержанию в пробе.
Общую погрешность метода можно оценить только с привлечением методов математической статистики. Эти методы исходят из идеализированного представления о бесконечно большом числе измерений. Исследователь же имеет дело с небольшим числом измерений, они называются выборкой. При оценке результатов анализа часто пользуются средним арифметическим значением. Прежде чем рассчитать среднее арифметическое значение результатов, они должны быть оценены на предмет выявления промахов, т. е. грубых отклонений. Нельзя без предварительной оценки отбросить кажущиеся неподходящими значения. Промахи или грубые отклонения устанавливаются по "размаху варьирования".
Размах варьирования - это разница между двумя крайними значениями - максимальным и минимальным. Далее вычисляют Q критерий, который определяется отношением:
![]()
где Х1 - подозрительно выделяющееся значение,
Х2 - значение, ближайшее по величине к подозрительному.
Вычисленную величину Q сопоставляют с табличным значением (таблицы обычно приведены в учебниках). Наличие грубого промаха доказано,
если Q > Qтабл, при данном числе определений n и выбранной доверительной вероятности P.
Доверительная вероятность (Р) - это соответствие экспериментального результа истинной величине и обычно принимается равной 95 %.
Для систематической обработки определяют ряд метрологических характеристик:
1. Среднее арифметическое - .
Эта величина при большом числе определений наиболее соответствует истинному значению.
2. Доверительный интервал
Для
ограниченного числа измерений истинное
значение определяемой величины находится
в пределах определенного интервала от
среднего арифметического
![]() ,
т.е. в пределах
,
т.е. в пределах
![]() .
Этот интервал называют доверительным
и рассчитывают по методу, известному
как метод Стьюдента.
.
Этот интервал называют доверительным
и рассчитывают по методу, известному
как метод Стьюдента.
Им предложено простое уравнение, связывающее доверительную вероятность (Р) и число определений (n) с доверительным интервалом.
![]()
где : t - коэффициент Стьюдента для заданных n и Р. Эта величина берется из справочных таблиц.
![]() -
функция от среднего арифметического
значения, - среднее квадратичное
отклонение среднего арифметического.
-
функция от среднего арифметического
значения, - среднее квадратичное
отклонение среднего арифметического.
3. Среднее квадратичное отклонение среднего арифметического.
Эта метрологическая характеристика, используемая для расчета доверительного интервала, связана со среднем квадратичным отклонением отдельного результата и числом определений n соотношением:
![]()
где: S(X) - среднее квадратичное отклонение отдельного результата
n - число определений.
4. Среднее квадратичное отклонение отдельного результата рассчитывают по формуле:
![]()
где: Хi - отдельный результат
- среднее арифметическое значение n определений
n - число определений.
Пример расчета:
Данные определения основной составляющей пробы представлены в таблице:
№ |
Х(%) |
|
|
1 |
96,6 |
+0,6 |
0,36 |
2 |
95,4 |
-0,6 |
0,36 |
3 |
95,5 |
-0,5 |
0,25 |
4 |
96,5 |
+0,5 |
0,25 |
5 |
96,1 |
+0,1 |
0,01 |
6 |
95,9 |
-0,1 |
0,01 |
7 |
94,1 |
|
|
![]()
![]()
Проверим на промах величину, наиболее отличающуюся от результатов всей серии- 94,1%.
![]()
Табличные значения Q для n = 7 и Р = 95 % - 0,480, следовательно, это значение является промахом и не включается в расчет среднего арифметического значения.
Вопросы и задачи для самостоятельного решения
По каким факторам можно судить о результатах анализа?
Какие ошибки встречаются при количественных аналитических определениях?
Как рассчитывается абсолютная ошибка?
Как рассчитывается относительная ошибка?
Какими методами можно устранить систематические ошибки?
Как влияют ошибки отдельных измерений на конечный результат?
Какие метрологические характеристики необходимо определить при обработке результатов анализа?
Как рассчитывается доверительный интервал?
С какой точностью необходимо проводить вычисления в количественном анализе?
Какие цифры называются значащами?
Как правильно проводить округление?
Сколько значащих цифр содержится в числах: 125,4; 0,012; 904; 2·10–2; 3,51·103; 3,00·10–4?
Ответ: 4;2; 3; 1; 3; 3.
Сколько значащих цифр содержится в числах: 325,45; 0,00015; 1,20·10–11; 0,015000·10–4; 300,0 ?
Ответ: 5; 2; 2; 3; 4; 4.
14. Представьте в нормальном виде числа 10000 и 1200, если недостоверность заключена в четвертой значащей цифре.
Ответ:1,000·104; 1,200·103.
15. Округлите следующие цифры, учитывая, что недостоверна третья значащая цифра: 10,13; 1,145;.0,3450;.0,3455.
Ответ:10,1; 1,14; 0,345; 0,345.
16. Представьте в нормальном виде объем мерной колбы вместимостью 200 мл, если погрешность измерения объема 1 мл.
Ответ:2,00·102.
17. Сложите следующие числа и округлите результат:
а) 6,75 + 0,443 + 15,28;
б) 0,10 + 0,1 + 10;
в) 1,153 + 2,127 + 3,150.
Ответ: а) 22,47; б) 10; в) 6,430.
18. Найдите разность следующих чисел и округлите результат:
а) 9,4514 – 9,0012;
б) 1,1315 – 0,8355;
в) 10,1412 – 10,0.
Ответ: а) 0,4502; б) 0,2960; в) 0,1.
19. Сложите следующие числа и округлите результат:
а) 2,0·10–5 + 1,15·10–5 + 0,2·10–3;
б) 4,183·10–2 + 3,1·10–3 + 5,13·10–5;
Ответ: а) 0,2·10–3 ; б) 4,54·10–2.
Справочные материалы
Таблица 1
Коэффициенты активности ионов
Ионы |
Значение коэффициента активностипри ионной силе, μ |
||||||
0,0005 |
0,001 |
0,005 |
0,01 |
0,025 |
0,05 |
0,1 |
|
H+ |
0,975
|
0,967 |
0,933 |
0,914 |
0,88 |
0,86 |
0,83 |
Li+
|
0,975 |
0,965 |
0,929 |
0,907 |
0,87 |
0,835 |
0,80 |
Rb+ Cs+ NH4+ Ag+ Tl+
|
0,975 |
0,964 |
0,924 |
0,898 |
0,85 |
0,80 |
0,75 |
K+ Сl– Вr– I– NO3– |
0,975 |
0,964 |
0,925 |
0,899 |
0,85 |
0,805 |
0,755 |
OH– HS– SCN– ClO3– IO4– ClO4– BrO3– MnO4– OCN– F– |
0,975 |
0,964 |
0,926 |
0,900 |
0,855 |
0,81 |
0,76 |
ClO2– IO3– HCO3– H2PO4– HSO3– Na+ |
0,975 |
0,964 |
0,928 |
0,902 |
0,86 |
0,82 |
0,775 |
Hg22+ SO42– S2O32–SeO42– HPO42– CrO42– |
0,903 |
0,867 |
0,740 |
0,660 |
0,545 |
0,445 |
0,355 |
Sr2+ Ba2+ Cd2+, Hg2+ S2– |
0,903 |
0,868 |
0,744 |
0,67 |
0,555 |
0,465 |
0,38 |
Продолжение таблицы 1
Mg2+ Be2+ |
0,906
|
0,872 |
0,755 |
0,69 |
0,595 |
0,52 |
0,45 |
Рb2+ CO32– SO32 – |
0,903
|
0,868 |
0,742 |
0,665 |
0,55 |
0,455 |
0,37 |
Таблица 2
Коэффициенты активности при высоких значениях ионной силы
μ |
Значения коэффициента активности при заряде иона, Z
|
|||||
|
1 |
2 |
3 |
4 |
5 |
6 |
0,05
|
0,84 |
0,50 |
0,21 |
0,062 |
0,013 |
0,0019 |
0,1
|
0,81 |
0,44 |
0,16 |
0,037 |
0,0058 |
0,00060 |
0,2
|
0,80 |
0,41 |
0,14 |
0,028 |
0,0038 |
0,00033 |
0,3 |
0,81
|
0,42 |
0,14 |
0,032 |
0,0046 |
0,00043 |
0,4 |
0,82
|
0,45 |
0,17 |
0,042 |
0,0072 |
0,00082 |
0,5 |
0,84
|
0,50 |
0,21 |
0,062 |
0,013 |
0,0020 |
0,6 |
0,87
|
0,56 |
0,27 |
0,098 |
0,027 |
0,0054 |
0,7 |
0,89
|
0,63 |
0,36 |
0,16 |
0,058 |
0,016 |
0,8 |
0,92
|
0,72 |
0,48 |
0,27 |
0,13 |
0,054 |
0,9 |
0,96
|
0,83 |
0,66 |
0,48 |
0,31 |
0,19 |
1,0 |
0,99
|
0,96 |
0,91 |
0,85 |
0,78 |
0,69 |
Таблица 3
Относительные атомные массы элементов
Элемент |
Масса |
Элемент |
Масса |
Ag |
107,868 |
F |
18,9984 |
Al |
26,9815 |
Fe |
55,845 |
As |
74,922 |
Ga |
69,723 |
Au |
196,967 |
Ge |
72,61 |
В |
10,811 |
H |
1,00794 |
Ba |
137,33 |
Hg |
200,59 |
Be |
9,0122 |
I |
126,904 |
Bi |
208,980 |
In |
114,82 |
Br |
79,904 |
Ir |
192,22 |
С |
12,011 |
К |
39,0983 |
Ca |
40,078 |
La |
138,906 |
Cd |
112,411 |
Li |
6,941 |
Ce |
140,115 |
Mg |
24,305 |
Cl |
35,453 |
Mn |
54,938 |
Co |
58,933 |
Mo |
95,94 |
Cr |
51,996 |
N |
14,0067 |
Cu |
63,546 |
Na |
22,9898 |
Nb |
92,906 |
Se |
78,96 |
Ni |
58,693 |
Si |
28,086 |
О |
15,9994 |
Sn |
118,71 |
P |
30,9738 |
Sr |
87,62 |
Pb |
207,2 |
Ta |
180,948 |
Pd |
106,42 |
Te |
127,60 |
Pt |
195,078 |
Th |
232,038 |
Ra |
226,025 |
Ti |
47,87 |
Rb |
85,468 |
Tl |
204,383 |
Re |
186,207 |
U |
238,028 |
Rh |
102,905 |
V |
50,942 |
Ru |
101,07 |
W |
183,84 |
S |
32,066 |
Y |
88,906 |
Sb |
121,76 |
Zn |
65,39 |
Sc |
44,956 |
Zr |
91,224 |
Таблица 4
Растворимость неорганических и некоторых органических соединений в воде
-
Вещество
Растворимость г/100 г воды
20 °С
100 °С
1
2
3
AgNO3
227,9
900,0
А1С13·6Н2О
Al(NO3)3·9H2O А12(SО4)3·18Н2О
45,9
73,9
36,4
49,0
159,7
89,0
ВаС12·2Н2О
35,7
58,8
СаС12·6Н2О СаС12·2Н2О Ca(NO3)2·4H2O Ca(NO3)2
CaSO4·2H2O
74,5
—
129,3
—
0,2036
—
159,0
—
363,7
0,1619
СоСl2·6Н2О СоСl2·2Н2О Со(NO3)2·6Н2О СоSО4·7Н2О CoSO4·H2O
52,9
—
100,0
36,3
—
—
106,2
—
—
38,5
CrO3
167,4
206,7
СuСl2·2Н2О Cu(NO3)2·6H2O Cu(NO3)2·3H2O CuSO4·5H2O
72,7
124,8
—
20,7
110,0
—
247,3
75,4
FеС12·4Н2О FeCl2·2H2O FeCl3·6H2O
FeCl3
Fe(NO3)2·9H2O FeSO4·7H2O
62,6
—
91,9
—
82,5 26,5
—
95,0
—
536,9
—
—
H3BO3
Н2С2О4·2Н2О H2C4H4O6
(винная)
H2C4H4O4 (янтар-ная)
H3C6H5O7 (лимонная)
5,04
9,52
139,2
6,91
146,0
40,3
—
344,4
121,3
—
KAl(SO4)2·12H2O K2CO3 ·1,5H2O
K2C2O4·H2O
KCl
K2CrO4
K2Cr2O7
5,9
110,5
36,4
34,0
61,81
12,0
154
155,7
78,6
56,7
75,5
97,0
Продолжение таблицы 4
-
1
2
3
K3[Fe(CN)6] K4[Fe(CN)6]
3H2O
KI
KMnO4
KNO2
KNO3
K2SO4
42,9
28,9
144
6,4
298,4
31,6
11,11
91,6
77,8
208
—
412,9
246
24,1
MgCl2·6H2O Mg(NO3)2·6H2O MgSO4·7H2O MgSO4·H2O
54,5
70,1
35,5
—
73,0
—
—
68,3
МnС12·4Н2О МnС12·2Н2О Mn(NO3)2·6H2O MnSO4·5H2O MnSO4·H2O
73,9
—
142,8
62,9
—
—
115,3
—
34,0
NH4Cl (NH4)2Fe(SO4)2
6H2O
NH4NO3 (NH4)2SO4
37,2
22,5
192
75,4
77,3
—
871,0
101,7
Na2B4O7·10H2O
Na2B4O7·5H2O Na2CO3·10H2O
Na2CO3·H2O
Na2C2O4
NaCl
NaHCO3
2,7
—
21,5
—
3,41
36,0
9,6
—
52,5
—
45,5
6,5
39,8
—
NaNO3
NaOH·H2O Na2SO3·7H2O
Na2SO3
Na2SO4·10H2O
Na2SO4·H2O
Na2S2O3·5H2O
Na2S2O3
88
109
26,9
—
19,4
—
70,0
—
180
—
—
26,6
—
42,5
—
266
NiСl2·6Н2О
NiСl2·2Н2О
Ni(NO3)2·6Н2О
NiSO4·6H2O
61,0
—
98,32
—
—
88,0
—
76,7
ZnCl2·1,5H2O
ZnCl2
Zn(NO3)2·6Н2О
ZnSO4·7H2O
ZnSO4·H2O
367,5
—
118,34
54,4
—
—
614,4
—
—
60,5
Пример использования данных таблицы. Необходимо приготовить раствор с концентрацией Na2B4O7, равной 0,1 моль/л, из кристаллического вещества
Na2B4O7·10Н2О. Рассчитаем навеску для приготовления 100 мл (0,1 л) такого раствора:
m(Na2B4O7·10Н2О)=C(Na2B4O7)·V(Na2B4O7)·M(Na2B4O7·10Н2О) =
=0,1·0,1·381,372=3,8137 г.
Далее воспользуемся табличными данными: при комнатной температуре (200 С) растворимость этой соли составляет 2,7 г в 100 г воды. Учитывая, что плотность разбавленных растворов (ω < 5 %; С < 1 моль/л) практически равна плотности растворителя, в данном случае воды, переведём растворимость в необходимые единицы измерения – 2,6 г на 100 мл раствора. Эта величина меньше рассчитанной навески, следовательно, при комнатной температуре приготовить раствор с концентрацией Na2B4O7, равной 0,1 моль/л, из кристаллического вещества Na2B4O7·10Н2О невозможно.
Таблица 5
Плотности водных растворов некоторых веществ при 20оС
NaCl |
H2SO4 |
HCl |
CH3COOH |
||||
|
, г/л |
|
, г/л |
|
, г/л |
|
, г/л |
0,01 |
1005,3 |
0,003 |
1000,0 |
0,004 |
1000,0 |
0,04 |
1004,1 |
0,02 |
1012,5 |
0,032 |
1020,0 |
0,024 |
1010,0 |
0,08 |
1009,8 |
0,04 |
1026,8 |
0,062 |
1040,0 |
0,044 |
1020,0 |
0,12 |
1015,4 |
0,06 |
1041,3 |
0,091 |
1060,0 |
0,064 |
1030,0 |
0,16 |
1020,8 |
0,08 |
1055,9 |
0,120 |
1080,0 |
0,085 |
1040,0 |
0,20 |
1026,1 |
0,10 |
1070,7 |
0,147 |
1100,0 |
0,105 |
1050,0 |
0,24 |
1031,2 |
0,12 |
1085,7 |
0,174 |
1120,0 |
0,125 |
1060,0 |
0,28 |
1036,0 |
0,14 |
1100,9 |
0,201 |
1140,0 |
0,145 |
1070,0 |
0,32 |
1040,5 |
0,16 |
1116,2 |
0,227 |
1160,0 |
0,165 |
1080,0 |
0,36 |
1044,8 |
0,18 |
1131,9 |
0,252 |
1180,0 |
0,184 |
1090,0 |
0,40 |
1048,8 |
0,20 |
1147,8 |
0,277 |
1200,0 |
0,204 |
1100,0 |
0,44 |
1052,5 |
0,22 |
1164,0 |
0,302 |
1220,0 |
0,223 |
1110,0 |
0,48 |
1055,9 |
0,24 |
1180,4 |
0,326 |
1240,0 |
0,243 |
1120,0 |
0,52 |
1059,0 |
0,26 |
1197,2 |
0,350 |
1260,0 |
0,262 |
1130,0 |
0,56 |
1061,8 |
Таблица 6
Произведения растворимости важнейших малорастворимых веществ
Формула вещества
|
ПР |
Формула вещества |
ПР |
1
|
2 |
3 |
4 |
Ag3AsO3
|
1∙10–17 |
Ag3АsО4 |
1∙10–22 |
AgBO2
|
4∙10–3 |
Ag2SO4 |
1,6·10–5 |
AgBr
|
5,3∙10–13 |
AgSeCN |
4,0·10–16 |
AgBrO3
|
5,5∙10–5 |
Ag2SeO3 |
9,8·10–16 |
AgC2H3O2
|
4∙10–3 |
Ag2SeO4 |
5,6·10–8 |
AgCN
|
1,4∙10–16 |
AgVO3 |
5·10–7 |
Ag2CO3
|
1,2∙l0–12 |
Ag2WO4 |
5,5·10–12 |
Ag2C2O4
|
3,5∙10–11 |
AlAsO4 |
1,6·10–16 |
AgCl
|
1,78∙10–10 |
А1(ОН)3 |
3,2·10–34 |
AgClO2
|
2∙10–4 |
A1PO4 |
5,75·10–19 |
AgClO3
|
5,0∙10–2 |
Ba3(AsO4)2 |
7,8·10–51 |
Ag2CrO4
|
1,1∙10–12 |
Ba(BrO3)2 |
5,5·10–6 |
Ag2Cr2O7
|
1∙10–10 |
BaCO3 |
4,0·10–10 |
Ag3Fe(CN)6
|
1∙10–22 |
BaC2O4 |
1,1·10–7 |
Ag4Fe(CN)6
|
8,5∙10–45 |
BaCrO4 |
1,2·10–10 |
Ag2HVO4
|
2∙10–14 |
BaF2 |
1,1·10–6 |
AgI
|
8,3·10–17 |
Ba2Fe(CN)6 |
3·10–8 |
AgIO3
|
3,0·10–8 |
Ba(IO3)2 |
1,5·10–9 |
AgMnO4
|
1,6·10–3 |
BaMnO4 |
2,5·10–10 |
Ag2MoO4
|
2,8·10–9 |
BaMoO4 |
4·10–8 |
AgN3
|
2,9·10–9 |
Ba3(PO4)2 |
6·10–39 |
AgNO2
|
6,0·10–4 |
Ba2P2O7 |
3∙10–11 |
Ag2O (Ag+,OH–)
|
1,95·10–8 |
BaSO3 |
8∙10–7 |
Продолжение таблицы 6
1 |
2
|
3 |
4 |
AgOCN
|
2,3·10–7 |
BaSO4 |
1,1∙10–10 |
Ag3PO4
|
1,3·10–20 |
BaS2O3 |
1,6∙10–5 |
AgReO4
|
7,95·10–5 |
BaSeO4 |
5∙10–8 |
Ag2S
|
6,3·10–50 |
BeCO3 |
1∙10–3 |
AgSCN
|
1,1·10–12 |
BeMoO4 |
3,2∙10–12 |
Ag2SO3
|
1,5·10–14 |
Be(OH)2 |
4,9∙10–22 |
AgSO3NH2
|
1·10–1 |
BiAsO4 |
2,8∙10–10 |
BiI3
|
8,1∙10–19 |
Ce(OH)3 |
1,5·10–20 |
Bi(OH)3
|
3,2∙10–32 |
CoCO3 |
1,05·10–10 |
BiPO4
|
1,3∙10–23 |
CoC2O4 |
6,3·10–8 |
Bi2S3
|
1∙10–97 |
Co2Fe(CN)6 |
4,8·10–38 |
Ca3(AsO4)2
|
6,8∙10–19 |
Co(IO3)2 |
1,0·10–4 |
CaC4H4O6 (тартрат)
|
7,7∙10–7 |
Co(OH)2 |
2,0·10–16 |
CaCO3
|
3,8∙10–9 |
Co(OH)3 |
4·10–45 |
CaC2O4
|
2,3∙10–9 |
CoS α |
4,0·10–21 |
CaCrO4
|
7,1∙10–4 |
CoS β |
2,0·10–25 |
CaF2
|
4,0∙10–11 |
CoSeO3 |
1,6·10–7 |
Ca(NH4)2Fe(CN)6
|
4∙10–8 |
CrAsO4 |
7,8·10–21 |
Са(IO3)2
|
7,0∙10–7 |
Cr(OH)2 |
1,0·10–17 |
Ca(OH)2
|
6,5∙10–6 |
Cr(OH)3 |
6,3·10–31 |
Ca3(PO4)2
|
2,0∙10–29 |
CrPO4 |
2,4·10–23 |
CaPO3F (Ca2+, PO3F2–)
|
4∙10–3 |
CsClO4 |
4∙10–3 |
CaSO3
|
3,2∙10–7 |
Cu3(AsO4)2 |
7,6∙10–36 |
CaSO4
|
2,5∙10–5 |
CuBr |
5,25∙10–9 |
Продолжение таблицы 6
1
|
2 |
3 |
4 |
CaSeO3
|
4,7∙10–6 |
CuCN |
3,2∙10–20 |
CaSiF6
|
8,1∙10–4 |
CuCO3 |
2,5∙10–10 |
CaWO4
|
9,0∙10–9 |
CuC2O4 |
3∙10–9 |
Cd3(AsO4)2
|
2,2∙10–33 |
CuCl |
1,2∙10–6 |
Cd(CN)2
|
1,0∙10–8 |
CuCrO4 |
3,6∙10–6 |
CdCO3
|
1,0∙10–12 |
Cu2Fe(CN)6 |
1,3∙10–16 |
CdC2O4
|
1,5∙10–8 |
CuI |
1,1∙10–12 |
Cd2Fe(CN)6
|
4,2∙10–18 |
Сu(IO3)2 |
7,4∙10–8 |
Cd(OH)2
|
5,9∙10–15 |
CuN3 |
5,0∙10–9 |
CdS
|
1,6·10–28 |
Cu2O (2Cu+, OH–) |
1∙10–14 |
CdSeO3
|
5,0·10–9 |
Cu(OH)2 |
8,3∙10–20 |
Ce(IO3)4
|
5·10–17 |
Cu2(OH)2CO3 |
1,7∙10–34 |
Cu2P2O7
|
8,3∙10–16 |
MgK2Fe(CN)6 |
5∙10–9 |
CuS
|
6,3∙10–36 |
Mg(NH4)2Fe(CN)6 |
4∙10–8 |
Cu2S
|
2,5∙10–48 |
MgNH4PO4 |
2,5∙10–13 |
CuSCN
|
4,8∙10–15 |
Mg(OH)2 |
7,1∙10–12 |
CuSe
|
1∙10–49 |
Mg3(PO4)2 |
1∙10–13 |
CuSeO3
|
1,7∙10–8 |
MgSO3 |
3∙10–3 |
FeAsO4
|
5,8∙10–21 |
MgSeO3 |
4,4∙10–6 |
FeCO3
|
3,5∙10–11 |
Mn3(AsO4)2 |
1,9∙10–29 |
FeC2O4
|
2∙10–7 |
MnCO3 |
1,8∙10–11 |
Fe4[Fe(CN)6]3
|
3,0∙10–41 |
MnC2O4 |
5∙10–6 |
Fe(OH)2
|
7,1∙10–16 |
Mn2Fe(CN)6 |
7,9∙10–13 |
Fe(OH)3
|
6,3∙10–38 |
MnNH4PO4 |
1∙10–12 |
Продолжение таблицы 6
1
|
2 |
3 |
4 |
FePO4
|
1,3∙10–22 |
Mn(OH)2 |
1,9∙10–13 |
FeS
|
5∙10–18 |
Mn(OH)3 |
1∙10–36 |
HgS
|
1,6∙10–52 |
MnS |
2,5∙10–10 |
In(OH)3
|
1,2∙10–37 |
MnSeO3 |
5,4∙10–8 |
In2S3
|
5,75∙10–74 |
(NH4)3AlF6 |
1,6∙10–3 |
K3AlF6
|
1,6∙10–9 |
(NH4)3Co(NO2)6 |
7,6∙10–6 |
K(C6H5)4B
|
2,25∙10–8 |
(NH4)2IrCl6 |
3∙10–5 |
K3Co(NO2)6
|
4,3∙10–10 |
(NH4)2PtCl6 |
9∙10–6 |
K2PdCl6
|
6,0∙10–6 |
Na3AlF6 |
4,1∙10–10 |
K2PtCl6
|
1,1∙10–5 |
NaSb(OH)6 |
4∙10–8 |
La2S3
|
2,0∙10–13 |
Na2SiF6 |
2,8∙10–4 |
Li3PO4
|
3,2∙10–9 |
Ni3(AsO4)2 |
3,1∙10–26 |
Mg3(AsO4)2
|
2,1∙10–20 |
Ni(CN)2 |
3∙10–23 |
MgCO3
|
2,1∙10–5 |
NiCO3 |
1,3∙10–7 |
MgC2O4
|
8,6∙10–5 |
NiC2O4 |
4∙10–10 |
MgF2
|
6,5∙10–9 |
Ni(ClO3)2 |
1∙10–4 |
Mg(IO3)2
|
3∙10–3 |
Ni2Fe(CN)6 |
1,3∙10–15 |
Ni(IO3)2
|
1,4∙10–8 |
Sc(OH)3 |
5,0∙10–37 |
Ni(OH)2
|
2,0∙10–15 |
SnI2 |
8,3∙10–6 |
Ni2P2O7
|
l,7∙10–13 |
Sn(OH)2 |
6,3∙10–27 |
NiS
|
3,2∙10–19 |
Sn(OH)4 |
1∙10–57 |
NiSeO3
|
1,0∙10–5 |
SnS |
2,5∙10–27 |
Pb3(AsO4)2
|
4,1∙10–36 |
Sr3(AsO4)2 |
1,3∙10–18 |
PbBr2
|
9,1∙10–6 |
SrCO3 |
1,1∙10–10 |
Продолжение таблицы 6
1
|
2 |
3 |
4 |
Pb(BrO3)2
|
8,0∙10–6 |
SrC2O4 |
1,6∙10–7 |
PbCO3
|
7,5∙10–14 |
SrCrO4 |
3,6∙10–5 |
PbC2O4
|
4,8∙10–10 |
SrF2 |
2,5∙10–9 |
РbС12
|
1,6∙10–5 |
Sr(IO3)2 |
3,3∙10–7 |
РbСrO4
|
1,8∙10–14 |
SrMoO4 |
2∙10–7 |
PbF2
|
2,7∙10–8 |
Sr(OH)2 |
3,2∙10–4 |
Pb2Fe(CN)6
|
9,55∙10–19 |
Sr3(PO4)2 |
1∙10–31 |
PbI2
|
1,1∙10–9 |
SrSO3 |
4∙10–8 |
Рb(IO3)2
|
2,6∙10–13 |
SrSO4 |
3,2∙10–7 |
РbМоO4
|
4,0∙10–6 |
SrSeO3 |
4,4∙10–6 |
Pb(N3)2
|
2,6∙10–9 |
Y(OH)3 |
6,3∙10–25 |
Рb(ОН)2
|
7,9∙10–16 |
Zn3(AsO4)2 |
1,3∙10–28 |
Рb3(РО4)2
|
7,9∙10–43 |
Zn(CN)2 |
2,6∙10–13 |
PbS
|
2,5∙10–27 |
ZnCO3 |
1,45∙10–11 |
Pb(SCN)2
|
2,0∙10–5 |
ZnC2O4 |
2,75∙10–8 |
PbSO4
|
1,6∙10–8 |
Zn2Fe(CN)6 |
2,1∙10–16 |
PbS2O3
|
4,0∙10–7 |
Zn(IO3)2 |
2,0∙10–8 |
PbSe
|
1∙10–38 |
Zn(OH)2 |
1,4∙10–17 |
PbSeO3
|
3∙10–12 |
Zn3(PO4)2 |
9,1∙10–33 |
PbSeO4
|
1,45∙10–7 |
ZnS |
1,6∙10–24 |
PbWO4
|
4,5∙10–7 |
ZnSe |
1∙10–31 |
Pb(OH)4
|
3,0∙10–66 |
ZnSeO3 |
1,9∙10–8 |
Таблица 7
Значения рН осаждения гидроксидов металлов
Гидроксид |
Значения рН
|
||||
начала осаждения при исходной концентрации осаждаемого иона, равной |
практически полного осаждения (остаточная концентрация меньше 10–5М)
|
начала растворения осадка (осаждение перестает быть полным) |
полного растворения выпавшего осадка |
||
1 М |
0,01 M |
||||
1
|
2 |
3 |
4 |
5 |
6 |
Sn(OH)4
|
0 |
0,5 |
1 |
13 |
15 |
TiO(OH)2
|
0 |
0,5 |
2,0 |
— |
— |
Sb(OH)3
|
0,2 |
0,9 |
1,9 |
6,9 |
— |
Sn(OH)2
|
0,9 |
2,1 |
4,7 |
10,0 |
13,5 |
HgO
|
1,3 |
2,4 |
5,0 |
11,5 |
— |
Fe(OH)3
|
1,5 |
2,3 |
4,1 |
14 |
— |
ZrO(OH)2
|
1,7 |
2,7 |
4,2 |
— |
— |
Ga(OH)3
|
1,7 |
2,4 |
3,6 |
5,6 |
— |
In(OH)3
|
2,9 |
3,6 |
4,6 |
11 |
— |
Al(OH)3
|
3,3 |
4,0 |
5,2 |
7,8 |
10,8 |
Cr(OH)3
|
4,0 |
4,7 |
6,8 |
9,4 |
12–13 |
Cu(OH)2
|
4,2 |
6,2 |
7,1 |
14 |
— |
Be(OH)2
|
5,2 |
6,2 |
8,8 |
13,5 |
— |
Zn(OH)2
|
5,4 |
6,4 |
8,0 |
10,5 |
12–13 |
Ag2O
|
6,2 |
8,2 |
11,2 |
12,7 |
— |
Pb(OH)2
|
6,4 |
7,4 |
9,0 |
10,5 |
— |
Fe(OH)2
|
6,5 |
7,5 |
9,7 |
13,5 |
— |
Co(OH)2
|
6,6 |
7,6 |
9,2 |
14,1 |
— |
Ni(OH)2
|
6,7 |
7,7 |
9,5 |
13,2 |
— |
Продолжение таблицы 7
1
|
2 |
3 |
4 |
5 |
6 |
Cd(OH)2
|
7,2 |
8,2 |
9,7 |
13,7 |
— |
Mn(OH)2
|
7,8 |
8,8 |
10,4 |
14 |
— |
Mg(OH)2
|
9,4 |
10,4 |
12,4 |
— |
— |
Примеры использования данных таблицы.
Пример1. В какой среде можно оттитровать комплексонометрически ион Fe3+ при его концентрации в растворе ~ 0,01 моль/л ?
Поскольку гидроксид железа (III) из 0,01 М раствора начинает осаждаться при рН = 2,3, то титрование можно провести только в кислой среде.
Пример 2. Можно ли разделить ионы Cr3+ и Mg2+ при их концентрациях 0,01 моль/л, регулируя значение рН раствора ?
Cr(OH)3 практически полностью осаждается при рН = 6,8, а начинает растворяться при рН = 9,4. Mg(OH)2 начинает осаждаться при рН = 10,4, полнота осаждения его достигается при рН = 12,4. Следовательно, в интервале 6,8 < рН < 9,4 ион Cr3+ будет находиться в осадке, а ион Mg2+ – в растворе, т. е. разделение возможно.
Таблица 8.
Ионные радиусы
Элемент, ион |
Заряд иона |
Радиус, нм
|
|||
по Гольд-шмидту |
по Полин-гу |
по Белову и Бокию |
по другим авторам |
||
1
|
2 |
3 |
4 |
5 |
6 |
Al
|
+3 |
0,057 |
0,050 |
0,057 |
— |
Ba
|
+2 |
0,143 |
0,135 |
0,138 |
— |
Be |
+ 2
|
0,034 |
0,031 |
0,034 |
— |
Продолжение таблицы 8.
1
|
2 |
3 |
4 |
5 |
6 |
Br |
+7
|
— |
0,039 |
0,039 |
— |
+5
|
— |
— |
— |
0,0147 |
|
–1
|
0,196 |
0,195 |
0,196 |
— |
|
CN |
–1
|
— |
— |
— |
0,192 |
Ca |
+2
|
0,106 |
0,098 |
0,104 |
— |
Cd |
+2
|
0,103 |
0,097 |
0,099 |
— |
Cl |
+7
|
— |
0,026 |
0,026 |
— |
+5
|
— |
— |
— |
0,034 |
|
–1
|
0,181 |
0,181 |
0,181 |
— |
|
ClO4– |
–1
|
— |
— |
— |
0,236 |
Со |
+ 3
|
— |
— |
0,064 |
— |
+ 2
|
0,082 |
0,072 |
0,078 |
— |
|
Cr |
+ 6
|
0,035 |
0,052 |
0,035 |
0,052 |
+3
|
— |
0,064 |
0,064 |
— |
|
+2
|
— |
— |
0,083 |
0,083 |
|
CrO42– |
–2
|
— |
— |
— |
0,300 |
Cs |
+ 1
|
0,165 |
0,169 |
0,165 |
— |
Cu |
+2
|
— |
— |
0,080 |
0,072 |
+1
|
— |
0,096 |
0,098 |
0,096 |
|
F |
– 1
|
0,133 |
0,136 |
0,133 |
— |
Fe |
+3
|
0,067 |
0,060 |
0,067 |
— |
+2
|
0,083 |
0,075 |
0,080 |
— |
|
Be |
+ 2
|
0,034 |
0,031 |
0,034 |
— |
I |
+7
|
— |
0,050 |
0,050 |
— |
+5
|
0,094 |
— |
— |
— |
Продолжение таблицы 8.
I |
–1
|
0,220 |
0,216 |
0,220 |
— |
К |
+1
|
0,133 |
0,133 |
0,133 |
— |
Li |
+1
|
0,078 |
0,060 |
0,068 |
— |
Mg |
+2
|
0,078 |
0,065 |
0,074 |
— |
Mn |
+7
|
— |
0,046 |
0,046 |
— |
+4
|
0,052 |
0,050 |
0,052 |
— |
|
+3
|
0,070 |
0,062 |
0,070 |
— |
|
+2
|
0,091 |
0,080 |
0,091 |
— |
|
NH4+ |
+ 1
|
0,143 |
— |
— |
0,159 |
NO3– |
–1
|
— |
— |
— |
0,189 |
Na |
+1
|
0,098 |
0,095 |
0,098 |
— |
Ni |
+2
|
0,078 |
0,069 |
0,074 |
— |
OH– |
–1
|
— |
— |
— |
0,153 |
PO43– |
–3
|
— |
— |
— |
0,300 |
Pb |
+4
|
0,084 |
0,084 |
0,076 |
— |
+2
|
0,132 |
0,121 |
0,126 |
— |
|
S |
+6
|
0,034 |
0,029 |
0,029 |
— |
+4
|
— |
— |
— |
0,037 |
|
–2
|
0,174 |
0,184 |
0,182 |
— |
Пример использования данных таблицы.
Требуется провести гравиметрическое определение Ba2+ (осадить BaSO4, взвесить BaSO4) в присутствии микроколичеств Pb2+. Можно ли предполагать загрязнение осаждаемой формы за счет изоморфизма ?
Ионы Ba2+ и Pb2+ имеют радиусы 0,143 и 0,132 нм соответственно, их сульфаты BaSO4 и PbSO4 имеют одинаковый тип кристаллической решётки. На основании расчёта
Решение: Ионы Ba2+ и Pb2+ имеют радиусы 0,143 и 0,132 нм соответственно, их сульфаты BaSO4 и PbSO4 имеют одинаковый тип кристаллической решётки. На основании расчёта
Δr = [(0,143 – 0,132) / 0,143]∙100 % = 7,7 %
делаем вывод, что Pb2+ может заместить Ba2+ в кристаллической решётке BaSO4. Следовательно, при проведении анализа необходимо принять меры для уменьшения изоморфизма.
Таблица 9
Гравиметрические факторы
Определяемое вещество |
Гравимет-рическая форма
|
Гравиметрический фактор |
Определяемое вещество |
Гравимет-рическая форма |
Гравиметрический фактор |
1 |
2 |
3 |
4 |
5 |
6 |
Ag |
AgBr AgCl AgI
|
0,5745 0,7526 0,4595 |
Cd |
CdO Cd2P2O7
|
0,8754 0,5638 |
Al |
Al2O3 Al(C9H6ON)3
|
0,5293 0,05872 |
Ce |
CeO2 |
0,8141 |
Ba |
BaCrO4 BaSO4
|
0,5421 0,5884 |
Cl |
AgCl |
0,2474 |
Be |
BeO |
0,3603 |
Со |
Co2P2O7
|
0,4039 |
Bi |
Bi2O3
|
0,8970 |
Cr |
BaCrO4 Cr2O3
|
0,2053 0,6842 |
Br |
AgBr
|
0,4255 |
Cu |
CuO |
0,7989 |
С |
BaCO3
|
0,06087 |
F |
CaF2 |
0,4867 |
Ca |
CaCO3 CaC2O4·H2O
|
0,4004 0,2743 |
Fe |
Fe2O3 |
0,6994 |
Продолжение таблицы 9
1 |
2 |
3 |
4 |
5 |
6 |
Ga |
Ga2O3
|
0,7440 |
N |
Pt
|
0,1436 |
Ge |
GeO2
|
0,6941 |
NH4 |
Pt
|
0,1849 |
HBr |
AgBr
|
0,4309 |
Ni |
NiO
|
0,7858 |
HI |
AgI
|
0,5448 |
P |
Mg2P2O7
|
0,2783 |
H3PO4 |
Mg2P2O7
|
0,8806 |
Pb |
PbCrO4 PbSO4 |
0,641 |
H2SO4 |
BaSO4
|
0,4202 |
S |
BaSO4
|
0,1374 |
I |
AgI
|
0,5405 |
SO42– |
BaSO4
|
0,4116 |
In |
In2O3
|
0,8271 |
Si |
SiO2
|
0,4674 |
К |
KClO4
|
0,2822 |
Sn |
SnO2
|
0,7877 |
Mg |
Mg2P2O7
|
0,2184 |
Sr |
SrC2O4·H2O SrSO4
|
0,452 |
Mn |
Mn2P2O7
|
0,3871 |
Ti |
TiO2
|
0,5994 |
N |
Pt
|
0,1436 |
Zn |
ZnO Zn2P2O7 |
0,8034 0,4292 |
Пример использования данных таблицы.
Рассчитать содержание NH4+ в пробе, если после проведения гравиметрического определения по схеме NH4+ → (NH4)2PtCl6 → Pt
масса гравиметрической формы (Pt) составила 0,0243 г.
Воспользуемся табличным значением F = 0,1849 для этого случая анализа:
m(NH4+) = m(Pt)·F = 0,0243·0,1849 = 0,0045 г.
Таблица 10
Константы ионизации кислот
Название
|
Формула |
Kа |
рKа |
Азотистая |
HNO2 |
5,1·10–4 |
3,29
|
Азиоводородная |
HN3 |
2,0·10–5 |
4,70
|
Азотноватистая К1 К2 |
H2N2O2 |
6,2·10–8 2,9·10–12 |
7,21 11,54
|
Аминоуксусная (Глицин) |
NH2CH2COOH |
1,7·10–10 |
9,77
|
Аскорбиновая К1 К2 |
H2C6H6O6 |
9,1·10–5 4,6·10–12 |
4,04 11,34 |
Бензойная |
C6H5COOH |
6,3·10–5 |
4,20
|
Борная (орто-) К1 K2 K3 |
H3BO3 |
7,1·10–10 1,8·10–13 1,6·10–14 |
9,15 12.74 13.80
|
Борная(тетра-) К1 К2 |
H2B4O7 |
1,8·10–4 2,0·10–8 |
3,74 7,70
|
Бромноватистая |
HBrO |
2,2·10–9 |
8,66
|
Ванадиевая (орто-) K1 К2 К3 |
H3VO4 |
1,8·10–4 3,2·10–10 4,0·10–15 |
3,74 9,5 14,4
|
Винная К1 К2 |
H2C4H4O6 |
9,1·10–4 4,3·10–5 |
3,04 4,37
|
Вольфрамовая К1 К2 |
H2WO4 |
6,3·10–3 2,0·10–4 |
2,20 3,70
|
Германиевая К1 К2 |
H4GeO4 |
7,9·10–10 2,0·10–13 |
9,10 12,7
|
Димолибденовая |
H2Mo2O7 |
9,55·10–6 |
5,02
|
Дихромовая К2 |
H2Cr2O7 |
2,3·10–2 |
1,64
|
Дитионовая К1 К2 |
H2S2O6 |
6,3·10–1 4,0·10–4 |
0,2 3,4
|
Дихлоруксусная |
CHCl2COOH |
5,0·10–2 |
1,30
|
Продолжение таблицы 10
Иодная К1 К2 K3 |
HIO4; H5IO6 |
2,45·10–2 4,3·10–9 1,0·10–15 |
1,61 8,33 15,0
|
Иодноватая |
HIO3 |
1,7·10–1 |
0,77
|
Иодноватистая |
HIO |
2,3·10–11 |
10,64
|
Кремневая (орто) К1 К2 K3 |
H4SiO4 |
1,3·10–10 1,6·10–12 2,0·10–14 |
9,9 11,8 13,7
|
Лимонная К1 К2 K3 |
H3C6H5O7 |
7,4·10–4 2,2·10–5 4,0·10–7 |
3,13 4,66 6,40
|
Марганцовистая К1 К2 |
H2MnO4 |
~10–1 7,1·10–11 |
~ 1 10,15
|
Молибденовая К1 К2 |
H2MoO4 |
2,9·10–3 1,4·10–4 |
2,54 3,86
|
Молочная |
CH3CH(OH)COOH |
1,5·10–4 |
3,83
|
Муравьиная |
HCOOH |
1,8·10–4 |
3,75
|
Мышьяковая К1 К2 К3 |
H3AsO4 |
5,6·10–3 1,7·10–7 2,95·10–12 |
2,25 6,77 11,53
|
Мышьяковистая |
H3AsO3 |
5,9·10–10 |
9,23
|
8-Оксихинолин |
C9H7ON |
1,3·10–10 |
9,90
|
Пероксид водорода |
H2O2 |
2,0·10–12 |
11,70
|
Резорцин К1 К2 |
C6H4(OH)2 (1,3) |
5,0·10–10 8,7·10–12 |
9,30 11,06
|
Салициловая |
C6H4(OH)COOH |
1,1·10–3 |
2,97
|
Селенистая К1 К2 |
H2SeO3 |
1,8·10–3 3,2·10–9 |
2,75 8,50
|
Селеноводородная К1 К2 |
H2Se |
1,3·10–4 1,0·10–11 |
3,89 11,00
|
Селеновая К2 |
H2SeO4 |
1,2·10–2 |
1,92
|
Серная К2 |
H2SO4 |
1,15·10–2 |
1,94
|
Продолжение таблицы 10
Сернистая К1 К2 |
H2SO3 |
1,4·10–2 6,2·10–8 |
1,85 7,20
|
Сероводородная К1 К2 |
H2S |
1,0·10–7 2,5·10–13 |
6,99 12,60
|
Синильная |
HCN |
5,0·10–10 |
9,30
|
Сурьмяная |
H[Sb(OH)6] |
4,0·10–5 |
4,40
|
Теллуристая К1 К2 |
H2TeO3 |
2,7·10–3 1,8·10–8 |
2,57 7,74
|
Теллуроводородная К1 К2 |
H2Te |
2,3·10–3 6,9·10–13 |
2,64 12,06
|
Теллуровая К1 |
|
2,45·10–8 |
7,61
|
Теллуровая К2 К3 |
H6TeО6 |
1,1·10–11 1·10–15 |
10,95 15
|
Тиосерная К1 К2 |
H2S2О3 |
2,5·10–1 1,9·10–2 |
0,60 1,72
|
Трихлоруксусная |
CCl3COOH |
2,0·10–1 |
0,70
|
Угольная К1 К2 |
CO2+ H2O |
4,5·10–7 4,8·10–11 |
6,35 10,32
|
Уксусная |
CH3COOH |
1,74·10–5 |
4,76
|
Фосфористая К1 К2 |
H3PО3 |
1,6·10–2 2,0·10–7 |
1,80 6,79
|
Фосфорная (орто-) К1 К2 K3 |
H3PО4 |
7,1·10–3 6,2·10–8 5,0·10–13 |
2,15 7,21 12,30
|
Фосфорная (пиро-)К1 К2 K3 К4 |
H4P2О7 |
1,2·10–1 7,9·10–3 2,0·10–7 4,8·10–10 |
0,91 2,10 6,70 9,32
|
Фосфорноватая К1 К2 К3 К4 |
H4P2О6 |
6,3·10–3 1,6·10–3 5,4·10–8 9,3·10–11 |
2,20 2,81 7,27 10,03
|
Фосфорноватистая |
H3PО2 |
5,9·10–2 |
1,23
|
Фтороводородная |
HF |
6,2·10–4 |
3,21
|
Продолжение таблицы 10
Фторофосфорная К1 К2 |
H2[PО3F] |
2,8·10–1 1,6·10–5 |
0,55 4,80
|
Хлористая |
HClO2 |
1,1·10–2 |
1,97
|
Хлорноватистая |
HClO |
2,95·10–8 |
7,53
|
Хлоруксусная |
CH2ClCOOH |
1,4·10–3 |
2,86
|
Хромовая К1 К2 |
H2CrO4 |
1,6·10–1 3,2·10–7 |
0,98 6,50
|
Циановая |
HOCN |
2,7·10–4 |
3,57
|
Щавелевая К1 К2 |
H2C2O4 |
5,6·10–2 5,4·10–5 |
1,25 4,27
|
Этилендиаминтетра-уксусная К1 К2 К3 К4 |
H4C10H12O8N2 |
1,0·10–2 2,1·10–3 6,9·10–7 5,5·10–11 |
2,00 2,67 6,16 10,26
|
Яблочная К1 К2 |
H2C4H4O5 |
3,5·10–4 8,9·10–6 |
3,46 5,05
|
Янтарная К1 К2 |
HOOCCH2CH2COOH |
1,6·10–5 2,3·10–6 |
4,21 5,63
|
Таблица 11
Константы ионизации оснований
Название |
Формула |
Кb |
рКb
|
1 |
2 |
3 |
4
|
Аммиака раствор |
NH3 + H2O |
1,76·10–5 |
4,755
|
Бария гидроксид К2 |
Ba(OH)2 |
2,3·10–1
|
0,64
|
Бензидин К1
К2
|
H2NС6H4С6H4NH2 + H2O H2NС6H4С6H4NH3+ + H2O |
9,3·10–10
5,6·10–11
|
9,03
10,25
|
Продолжение таблицы 10
Гидразин |
N2H4 + H2O |
9,8·10–7 |
6,03
|
Гидроксиламин |
NH2OH + H2O |
8,9·10–9 |
8,05
|
Диметиламин |
(СH3)2NH + H2O |
5,4·10–4 |
3,27
|
Дифениламин |
(С6H5)2NH + H2O |
6,2·10–14 |
13,21 |
Диэтиламин |
(С2H5)2NH + H2O |
1,2·10–3 |
2,91
|
Кальция гидроксид К2 |
Ca(OH)2 |
4,0·10–2 |
1,40
|
Лития гидроксид |
LiOH |
6,8·10–1 |
0,17
|
Метиламин |
СH3NH2 + H2O |
4,6·10–3 |
3,34
|
Мочевина |
СO(NH2)2 + H2O |
1,5·10–14 |
13,82
|
8-Оксихинолин |
С9H7ON + H2O |
1,0·10–9 |
8,99
|
Пиридин |
С6H5N + H2O |
1,5·10–9 |
8,82
|
Свинца гидроксид К1 К2 |
Pb(OH)2 |
9,55·10–4 3,0·10–8 |
3,02 7,52
|
Серебра гидроксид |
AgOH |
5,0·10–3 |
2,30
|
Тиомочевина |
СS(NH2)2 + H2O |
1,1·10–12 |
11,97
|
Триметиламин |
(СH3)3N + H2O |
6,5·10–5 |
4,19
|
Уротропин (гексаметилентетрамин) |
(СH2)6N4 + H2O |
1,4·10–9 |
8,87
|
Фенилгидразин |
С6H5NHNH2 + H2O |
1,6·10–9 |
8,80
|
Хинолин |
С9H7N + H2O |
7,4·10–10 |
9,13
|
Этаноламин |
H2NСH2СH2OH + H2O |
1,8·10–5 |
4,75
|
Этиламин |
СH3CH2NH2 + H2O |
6,5·10–4 |
3,19
|
Этилендиамин К1 К2 |
H2NСH2–CH2NH2 + H2O |
1,2·10–4 9,8·10-8 |
3,92 7,01
|
Таблица 12
Интервал рН перехода важнейших индикаторов
Индикатор |
Интервал перехода в единицах рН
|
Изменение окраски |
Тимоловый синий |
1,2–2,8 |
Красная – желтая |
Тропеолин 00 |
1,3–3,2 |
Красная – желтая |
Метиловый оранжевый |
3,1–4,0 |
Розовая – желтая |
Бромфеноловый синий |
3,0–4,6 |
Желтая – синяя |
Метиловый красный |
4,2–6,2 |
Красная – желтая |
Лакмус |
5,0–8,0 |
Красная – синяя |
n-Нитрофенол |
5,6–7,6 |
Бесцветная – желтая |
Бромтимоловый синий |
6,0–7,6 |
Желтая – синяя |
Нейтральный красный |
6,8–8,4 |
Красная – янтарно-желтая |
Крезоловый красный |
7,2–8,8 |
Желтая – пурпурная |
1-Нафтолфталеин |
7,4–8,6 |
Желто-розовая – сине-зеленая |
Тимоловый синий |
8,0–9,6 |
Желтая - синяя |
Фенолфталеин |
8,2–10,0 |
Бесцветная – пурпурная |
Морин |
8,8–9,8 |
Бесцветная – зеленая |
Тимолфталеин |
9,3–10,5 |
Бесцветная – синяя |
Ализариновый желтый |
10,0–12,1 |
Лимонная – коричневая |
Таблица 13
Некоторые смешанные индикаторы
рТ |
Компоненты |
Соотно-шение |
Окраска индикатора |
|
в кислой среде |
в щелоч-ной среде |
|||
3,25 |
Метиловый желтый, метиленовая синяя |
1:1 |
Сине-фиолетовая
|
Зеленая |
4,1 |
Метиловый оранжевый, Индигокармин
|
1:1 |
Фиолетовая |
Зеленая |
4,3 |
Бромкрезоловый синий, метиловый оранжевый
|
1:1 |
Желтая
|
Сине-зеленая |
5,1 |
Бромкрезоловый синий, метиловый красный
|
3:1 |
Винно-красная |
Зеленая |
5,4 |
Метиловый красный, метиленовая синяя
|
1:1 |
Красно-фиолетовая |
Зеленая |
6,1 |
Бромкрезоловый синий, хлорфеноловый красный
|
1:1 |
Желто-зеленая |
Сине-фиолетовая |
6,7 |
Бромкрезоловый пурпуровый, бромтимоловый синий
|
1:1 |
Желтая |
Сине-фиолетовая |
7,0 |
Нейтральный красный, метиленовая синяя
|
1:1 |
Фиолетово-синяя |
Зеленая |
7,2 |
Нейтральный красный, бромтимоловый синий
|
1:1 |
Розовая |
Зеленая |
7,5 |
Бромтимоловый синий, феноловый красный
|
1:1 |
Желтая |
Фиолетовая |
8,3 |
Крезоловый красный, тимоловый синий
|
1:3 |
Желтая |
Фиолетовая |
8,9 |
α-Нафтолфталеин, фенолфталеин
|
1:3 |
Бледно-розовая |
Фиолетовая |
9,0 |
Тимоловый синий, Фенолфталеин
|
1:3 |
Желтая |
Фиолетовая |
9,9 |
Фенолфталеин, Тимолфталеин |
1:1 |
Нет |
Фиолетовая |
Таблица 14
Стандартные электродные потенциалы (е°) при 25°с
Элемент |
Полуреакция |
Eo,В |
1 |
2 |
3 |
Ag |
Ag+ + e = Ag↓ |
+ 0,7994 |
AgBr↓+ e = Ag↓ + Br– |
+ 0,071 |
|
AgCl↓+ e = Ag↓ + Cl– |
+ 0,222 |
|
AgI↓+ e = Ag↓ + I– |
– 0,152 |
|
As |
H3AsO4 + 2H+ + 2е = HAsO2 + 2H2O |
+ 0,56 |
AsO43– + 2H2O+2е = AsO2– + 4ОН– |
– 0,71 |
|
Br |
Br2 + 2e = 2Br– |
+ 1,087 |
2BrO3– + 12H+ + 10e = Br2↓ + 6H2O |
+ 1,52 |
|
2BrO3– +6H2O + 10e = Br2↓ + 12OH– |
+ 0,50 |
|
C |
CO2↑ + 2H+ + 2e = HCOOH |
– 0,20 |
2CO2↑ + 2H+ + 2e = H2C2O4 |
– 0,49 |
|
Са |
Са2++2e = Ca↓ |
– 2,79 |
Cd |
Cd2+ +2e = Cd↓ |
– 0,403 |
Се |
Се4+ +e = Ce3+ |
+ 1,77 |
Сl |
Сl2↑+2e = 2C1– |
+ 1,359 |
2HOС1 + 2Н++2e = Cl2↑+H20 |
+ 1,63 |
|
2C1O–+2H2O+2e = С12↑ +4OH– |
+ 0,40 |
|
HC1O + H+ +2e = Сl– + Н2О |
+ 1,50 |
|
Сl |
ClO– + H2O+2e = Сl– + 2OН– |
+ 0,88 |
НСlO2+2H++2e = HClO + H2O |
+ 1,64 |
Продолжение таблицы 14
Сl |
2HClO2 + 6H++ 6e = Cl2↑+4H2O |
+ 1,63 |
HClO2 + 3H+ + 4e = Cl– + 2H2O |
+ 1,56 |
|
ClO2– + H2O + 2e = ClO– + 2OН– |
+ 0,66 |
|
ClO2– + 2H2О + 4e = C1– + 4OH– |
+ 0,77 |
|
ClO3– +3Н+ +2e = HC1O2 + H2O |
+ 1,21 |
|
ClO3– + H2O+2e = ClO2– + 2OH– |
+ 0,33 |
|
ClO3– + 2H+ +e = C1O2↑ + H2O |
+ 1,15 |
|
ClO3– + 6H+ +6e = Cl– + 3H2O |
+ 1,45 |
|
ClO3– + 3H2O+6e = Сl– + 6OН– |
+ 0,63 |
|
ClO4– + 2H+ + 2e = ClO3– + Н2О |
+ 1,19 |
|
ClO4– +H2O+2e = ClO3– + 2OH– |
+ 0,36 |
|
2 ClO4– + 16H++ 14e = С12↑ +8Н2О |
+ 1,39 |
|
ClO4– + 8H++8e = Сl– + 4Н2О |
+ 1,38 |
|
ClO4– + 4H2O+8e = С1– + 8OН– |
+ 0,56 |
|
|
Со3+ + e = Со2+ |
+ 1,95 |
Со |
Со2++2e = Со↓ |
– 0,29 |
|
Co(NH3)63+ + e = Co(NH3)62+ |
+ 0,1 |
|
||
Cr |
Cr3+ + e = Сr2+ |
– 0,41 |
Сr3++3e = Сr↓ |
– 0,74 |
|
Cr2O72– + 14Н+ + 6e = 2Сr3+ + 7Н2О |
+ 1,33 |
|
CrO4– + 4Н2О + 3e = Сr(ОН)3↓+5ОН– |
– 0,13 |
|
Сu |
Cu2+ + 2e = Сu↓ |
+ 0,345 |
Cu+ + e = Сu↓ |
+ 0,531 |
|
Cu2+ + e = Сu+ |
+ 0,159 |
|
F |
F2↑+2е = 2F– |
+ 2,77 |
Продолжение таблицы 14
Fe |
Fe3+ + е = Fe2+ |
+ 0,771 |
Fe3+ + 3e = Fe↓ |
– 0,058 |
|
Fe2+ + 2е = Fe↓ |
– 0,473 |
|
Fe(CN)63– + e = Fe(CN)64– |
+ 0,364 |
|
Ga |
Ga3++ 3e = Ga↓ |
– 0,56 |
H |
2H++2е =H2↑ |
0,0000 |
2H2O + 2е = H2↑ +2OH– |
– 0,828 |
|
H2O2 + 2H++2е = 2H2O |
+ 1,77 |
|
HO2– + H2O+2e = 3ОH– |
+ 0,88 |
|
Hg |
2Hg2+ + 2е = Hg22+ |
+ 0,907 |
Hg2+ + 2е = Hg↓ |
+ 0,850 |
|
Hg22+ + 2е = Hg↓ |
+ 0,792 |
|
I |
I2↓ + 2е = 2I– |
+ 0,536 |
I2 + 2е = 2I– |
+ 0,621 |
|
I3– + 2е = 3I– |
+ 0,545 |
|
2IBr + 2е = I2↓ + 2Br– |
+ 1,02 |
|
ICN↑ + 2е = I– + CN– |
+ 0,30 |
|
2ICN↑ + 2H+ + 2е =I2↓ +2HCN |
+ 0,63 |
|
2ICl↑ +2е = I2↓ + 2Cl– |
+ 1,19 |
|
2НIО + 2Н+ +2е = I2↓ +2H2O |
+ 1,45 |
|
2IO– + H2O+2е = I2↓ + 4OH– |
+ 0,45 |
|
HIO + H++2е = I– + H2O |
+ 0,99 |
|
IO– + H2O+2е = I– + 2OH– |
+ 0,49 |
|
IO3– + 5H++ 4е = HIO + 2H2O |
+ 1,14 |
|
IO3– +2H2O + 4е = IO– + 4OH– |
+ 0,14 |
|
2 IO3– + 12H+ + 10e = I2↓ + 6H2O |
+ 1,19 |
Продолжение таблицы 14
1 |
2 |
3 |
I |
2 IO3– +6H2O + 10e = I2↓ + 12OH– |
+ 0,21 |
IO3– + 6H+ + 6е = I– + 3H2O |
+ 1,08 |
|
IO3– + 3H2O + 6е = I– + 6OH– |
+ 0,26 |
|
H5IO6 + H+ + 2е = IO3– + 3H2O |
≈+1,6 |
|
H3IO62– + 2е = IO3– + 3OН– |
≈+0,7 |
|
H5IO6 + 7H+ + 8е = I– + 6Н2О |
≈+1,24 |
|
H3IO62– + 3H2O + 8е = I– + 9OН– |
≈+0,37 |
|
In |
In3+ + 3е =In↓ |
– 0,34 |
Ir |
Ir3+ + 3е = Ir↓ |
≈+1,15 |
К |
K++ e = К↓ |
– 2,923 |
La |
La3+ + 3е = La↓ |
– 2,52 |
Li |
Li+ + е = Li↓ |
– 3,04 |
Mg |
Mg2+ + 2е = Mg↓ |
– 2,37 |
Мn |
Мn3+ + е = Мn2+ |
+ 1,51 |
Мn2+ + 2е = Мn↓ |
– 1,17 |
|
Mn(OH)3↓ + e = Мn(ОН)2↓ + OH– |
+ 0,1 |
|
MnO2↓ + 4H++2е = Мn2++2Н2О |
+ 1,23 |
|
MnO42– + 2H2O+2е =MnO2↓ + 4OH– |
+0,58 |
|
MnO4– + е = MnO42– |
+ 0,558 |
|
MnO4– + 4H++3е = MnO2↓ + 2H2O |
+ 1,69 |
|
MnO4– + 2H2O + 3e = MnO2↓ + 4OH– |
+ 0,60 |
|
MnO4– + 8H++ 5е = Mn2+ + 4H2O |
+ 1,51 |
|
Мо |
Мо3++3е = Mo↓ |
– 0,2 |
MoO2+ + 4H++2e = Mo3+ + 2H2O |
0,0 |
|
MoO2+ +e = MoO2+ |
+ 0,48 |
Продолжение таблицы 14
1 |
2 |
3 |
Мо |
H2MoO4 + 6H+ + 6е = Mo↓ + 4H2O |
0,0 |
Mo42–+ 4Н2О + 6е = Mo↓ + 8OH– |
– 1,05 |
|
N |
HN3 + 11H+ + 8e = 3NH4+ |
+ 0,69 |
3N2↑ + 2H+ + 2е = 2HN3 |
– 3,1 |
|
3N2↑ + 2е = 2N3– |
– 3,4 |
|
N2↑ + 2H2O + 4H+ + 2е = 2(NH2OH·H+) |
– 1,87 |
|
N2↑ + 4H2O + 2е = 2NH2OH+ 2OH– |
– 3,04 |
|
N2↑ + 5H+ + 4е = N2H4·H+ |
– 0,23 |
|
N2↑ + 4H2O + 4е = N2H4 + 4OH– |
– 1,16 |
|
N2↑ + 8H+ + 6е = 2 NH4+ |
+ 0,26 |
|
N2↑ + 8H2O + 6е = 2NH4OH+ 6OH– |
– 0,74 |
|
N2H4·H+ + 3H+ + 2е =2 NH4+ |
+ 1,27 |
|
N2H4 + 4H2O + 2е = 2NH4OH+ 2OH– |
+ 0,1 |
|
NH2OH·H++2H+ + 2е = NH4+ + H2O |
+ 1,35 |
|
NH2OH + 2H2O + 2е = NH4OH + 2OH– |
+ 0,42 |
|
H2N2O2 + 2H+ + 2е = N2↑ +2H2O |
+ 2,65 |
|
H2N2O2 + 6H+ + 4е = 2(NH2OH·H+) |
+ 0,50 |
|
2HNO2+ 4H+ + 4e = H2N2O2 + 2H2O |
+ 0,83 |
|
HNO2 + H+ +е = NO↑ + H2O |
+ 0,98 |
|
NO2– + H2O + е = NO↑ + 2OH– |
– 0,46 |
|
2HNO2 + 4H+ + 4e = N2O↑ + 3H2O |
+ 1,29 |
|
2HNO2 + 6H+ + 4e =N2↑ + 4H2O |
+ 1,44 |
|
2NO2– + 4H2O + 6е = N2↑ + 8OH– |
+ 0,41 |
|
HNO2 + 7H+ + 6е = NH4+ + 2H2O |
+ 0,86 |
|
2NO2– + 6H2O + 6е = NH4OH + 7OH– |
– 0,15 |
Продолжение таблицы 14
1 |
2 |
3 |
N |
N2O↑ + 2H+ + 2е = N2↑ + H2O |
+ 1,77 |
N2O↑ + H2O + 2е = N2↑ + +2OH– |
+ 0,94 |
|
2NO↑ +4H+ + 4e = N2↑ + 2H2O |
+ 1,68 |
|
2NO↑ +2H2O + 4e = N2↑ + 4OH– |
+ 0,85 |
|
N2O4↑ + 2H+ + 2е = 2HNO2 |
+ 1,07 |
|
N2O4↑ + 2е = 2 NO2– |
+ 0,88 |
|
N2O4↑ + 8H++8е = N2↑ + 4H2O |
+ 1,35 |
|
N2O4↑ + 4H2O + 8е = N2↑+8OH– |
+ 0,53 |
|
NO3+ + 3H+ + 2е = HNO2 + H2O |
+ 0,94 |
|
NO3+ + H2O + 2е = NO2– + 2OH– |
+ 0,01 |
|
NO3+ + 2H+ + е = NO2↑ + H2O |
+ 0,80 |
|
NO3+ + H2O + e = NO2↑ +2OH– |
– 0,86 |
|
NO3+ + 4H+ + 3е = NO↑ + 2H2O |
+ 0,96 |
|
NO3+ + 2H2O + 3е = NO↑ + 4OH– |
– 0,14 |
|
2 NO3+ + 12H+ + 10e = N2↑+6H2O |
+ 1,24 |
|
NO3+ + 8H+ + 6е = NH2OH·H+ + 2H2O |
+ 0,73 |
|
2 NO3+ + 17H++ 14е = N2H4·H+ + 6H2O |
+ 0,84 |
|
NO3+ + 10H+ + 8е = NH4+ + 3H2O |
+ 0,87 |
|
NO3+ + 7H2O + 8е = NH4OH +9OH– |
– 0,12 |
|
Na |
Na+ + e = Na↓ |
– 2,713 |
Nb |
Nb3+ + 3е = Nb↓ |
– 1,1 |
Ni |
Ni2+ + 2е = Ni↓ |
– 0,228 |
O |
O2↑ + 4H+ + 4e = 2H2O |
+ 1,229 |
O2↑ + 2H2O + 4e = 4OH– |
+ 0,401 |
|
O2↑ + 2H+ + 2е = H2O2 |
+ 0,682 |
Продолжение таблицы 14
1 |
2 |
3 |
O |
O2↑ + H2O + 2е = HO2– + OH– |
– 0,076 |
H2O2 + 2H+ + 2е = 2H2O |
+ 1,77 |
|
HO2– + H2O + 2е = 3OH– |
+ 0,88 |
|
O3↑ + 2H+ + 2е = O2↑ + H2O |
+ 2,07 |
|
O3↑ + H2O + 2е = O2↑ + 2OH– |
+ 0,02 |
|
Os |
Os2+ + 2е = Os↓ |
+ 0,85 |
OsO4↓ + 8H++ 8е = Os↓ + 4H2O |
+ 0,85 |
|
P |
P↓ + 3H+ + 3e = PH3↑ |
+ 0,06 |
P↓ + 3H2O + 3e = PH3↑+3OH– |
– 0,89 |
|
H3PO2 + H ++ е = P↓ +2H2O |
– 0,51 |
|
H2PO2– + е = P↓ + 2OH– |
– 2,05 |
|
H3PO3 + 3H+ + 3е = P↓ + 3H2O |
– 0,50 |
|
H3PO3+ 2H++ 2е = H3PO2 + H2O |
– 0,50 |
|
HPO32– + 2Н2O + 2е = H2PO2– + 3OH– |
– 1,57 |
|
H4P2O6 + 2H+ + 2е = 2H3PO3 |
+ 0,38 |
|
H3PO4 + 5H+ + 5е = P↓+4H2O |
– 0,41 |
|
H3PO4 + 4H+ + 4е = H3PO2 + 2H2O |
– 0,39 |
|
2H3PO4 + 2H+ + 2е = H4P2O6 + 2H2O |
– 0,94 |
|
H3PO4 + 2H+ + 2е = H3PO3 + H2O |
– 0,276 |
|
PO43– + 2H2O+2е =HPO32– + 3ОН– |
– 1,12 |
|
Рb |
Рb2+ + 2е = Pb↓ |
– 0,126 |
Pb4+ + 2е = Рb2+ |
+ 1,66 |
|
Pb4+ + 4е = Pb↓ |
+ 0,77 |
|
PbO2↓ + H2O + 2е = PbO↓ + 2OН– |
+ 0,28 |
|
PbO2↓ + 4H+ + 2е = Рb2+ + 2H2O |
+ 1,455 |
|
Pd |
Pd2+ + 2е = Pd↓ |
+ 0,915 |
Продолжение таблицы 14
1 |
2 |
3 |
Pt |
Pt2+ + 2е = Pt↓ |
+ 1,2 |
S |
S↓ + 2е = S2– |
– 0,476 |
S↓ + 2H+ + 2е = H2S↑ |
+ 0,171 |
|
(SCN)2↑ + 2е = 2SCN– |
+ 0,77 |
|
S4O62– + 2е = 2 S2O32– |
+ 0,09 |
|
S2O32– + 6H+ + 4e = 2S↓+3Н2О |
+ 0,5 |
|
2Н2SО3 + 2Н+ + 4e = S2O32– + 3H2O |
+ 0,40 |
|
2 SO32– + 3H2O + 4e = S2O32– + 6OH– |
– 0,58 |
|
2H2SO3+H+ + 2е = HS2O42– + 2Н2О |
– 0,08 |
|
2 SO32– + 2H2O + 2е =S2O42– + 4OH– |
– 1,12 |
|
SO42– + 4H+ + 2е = H2SO3 + H2O |
+ 0,17 |
|
SO42– + H2O + 2е = SO32– + 2OH– |
– 0,93 |
|
2 SO42– + 10H+ + 8e = S2O32– + 5Н2О |
+ 0,29 |
|
2 SO42– + 5H2O + 8е = S2O32– + 10OH– |
– 0,76 |
|
SO42– + 8H+ + 6е = S↓ + 4H2O |
+ 0,36 |
|
SO42– + 4H2O + 6е = S↓ + 8OH– |
– 0,75 |
|
S2O82–+ 2e = 2SO42– |
+ 2,01 |
|
Sb |
SbО+ + 2Н+ + 3е = Sb↓+H2O |
+ 0,212 |
Sc |
Sc3+ + 3е = Sc↓ |
– 2,08 |
Se |
SeO42– + H2O + 2е = SeO32– + 2OH– |
+ 0,05 |
Si |
SiO32– + 3H2O + 4е = Si↓ + 6OH– |
– 1,7 |
Sn |
Sn2+ + 2е = Sn↓ |
– 0,140 |
Sn4+ + 2е = Sn2+ |
+ 0,15 |
|
Sn4+ + 4е =Sn↓ |
+ 0,01 |
|
Sr |
Sr2+ + 2е = Sr↓ |
– 2,89 |
Te |
TeO42– + H2O + 2e =TeO32– + 2OH– |
+ 0,4 |
Продолжение таблицы 14
1 |
2 |
3 |
Th |
Th4+ + 4е = Th↓ |
– 1,90 |
Ti |
Ti2+ + 2е = Тi↓ |
– 1,63 |
TiO2↓ + 4H+ + 4е = Ti↓ + 2H2O |
– 0,86 |
|
TiO2+ + 2H+ + 4e = Ti↓ + H2O |
– 0,88 |
|
TiO2+ + 2H+ + е = Ti3+ + H2O |
+ 0,1 |
|
Ti3+ + е = Ti2+ |
– 0,37 |
|
Tl |
Tl+ + е= Tl↓ |
– 0,357 |
Тl3+ + 2е = Tl+ |
+ 1,25 |
|
U |
U3+ +3е = U↓ |
– 1,80 |
U4+ + е = U3+ |
– 0,61 |
|
UO22+ + 4H+ + 2е = U4+ + 2H2O |
+ 0,33 |
|
V |
V2+ + 2е = V↓ |
– 1,18 |
V3+ + е = V2+ |
– 0,255 |
|
VO2+ + 2H+ +e =V3+ + H2O |
+ 0,337 |
|
VO2+ + e = VO+ |
–0,044 |
|
VO2+ + 2H+ + е = VO2+ + H2O |
+1,000 |
|
VO2+ + 4H+ +2е = V3++ 2H2O |
+ 0,668 |
|
VO2+ +4H+ + 3е = V2++2H2O |
+ 0,360 |
|
VO2+ + 4H+ + 5е = V↓ + 2H2O |
– 0,25 |
|
VO43– + 6H+ + 2е =VO+ + 3H2O |
+ 1,26 |
|
H2VO4– + 4H++е = VO2+ + 3H2O |
+ 1,31 |
|
W |
WO42– + 8H+ + 6е = W↓ + 4H2O |
+0,05 |
Zn |
Zn2+ + 2е = Zn↓ |
–0,764 |
|
Zn(OH)2 + 2e = Zn↓ + 2OH– |
– 1,245 |
|
ZnO22– + 2H2O = Zn + 4OH– |
– 1,216 |
Zr |
ZrO2↓ + 4H+ + 4e = Zr↓ + 2H2O |
– 1,43 |
Таблица 15
Окислительно-восстановительные индикаторы
Индикатор |
|
Окраска окисленной и восстановленной форм |
Нейтральный красный |
+ 0,24 |
Красная – бесцветная
|
Индиготрисульфоновая кислота |
+ 0,33 |
Синяя – бесцветная
|
Метиленовая синяя |
+ 0,53 |
Синяя – бесцветная
|
Вариаминовый синий |
+ 0,71 |
Синяя – бесцветная
|
Дифениламин |
+ 0,76 |
Синяя – бесцветная
|
Этоксихризоидин |
+ 0,76 |
Желтая – красная
|
Дифенилбензидин |
+ 0,78 |
Фиолетовая – бесцветная
|
о-Дианизидин |
+ 0,85 |
Красная – бесцветная
|
2,2'-Дипиридил (комплекс с Fe2+) |
+ 0,97 |
Голубая – красная |
Эриоглауцин |
+ 1,00 |
Зеленая – синяя
|
Ферроин |
+ 1,06 |
Бледно-голубая – красная
|
Фенилантраниловая кислота |
+ 1,08 |
Красно-фиолетовая – Бесцветная
|
Ритрозо-о-фенантролин, ( комплекс с Fe2+)
|
+ 1,25 |
Бледно-голубая – красная |
Таблица 16
Логарифмы суммарных констант устойчивости комплексных соединений
Лиганд |
Центральный ион
|
lg i при i |
|||||
1 |
2 |
3 |
4 |
5 |
6 |
||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
Br– |
Ag+ |
4,38 |
7,34 |
8,00 |
8,73 |
8,44 |
– |
Hg2+ |
9,05 |
17,33 |
19,74 |
21,00 |
– |
– |
|
Br– |
Pb2+ |
2,23 |
3,00 |
2,83 |
2,93 |
– |
– |
CN– |
Ag+ |
? |
19,85 |
20,55 |
19,42 |
– |
– |
|
Fe2+ |
? |
? |
? |
? |
18,6 |
36,9 |
|
Fe3+ |
? |
? |
? |
? |
? |
43,9 |
|
Hg2+ |
17,00 |
32,75 |
36,31 |
38,97 |
39,83 |
40,62 |
CO32– |
Ca2+ |
3,2 |
– |
– |
– |
– |
– |
|
Cu2+ |
6,77 |
10,01 |
– |
– |
– |
– |
|
Pb2+ |
? |
9,09 |
– |
– |
– |
– |
Cl– |
Ag+ |
3,04 |
5,04 |
5,04 |
5,30 |
– |
– |
|
Bi3+ |
2,43 |
4,7 |
5,0 |
5,6 |
6,1 |
6,42 |
|
Ce3+ |
0,48 |
– |
– |
– |
– |
– |
|
Cu+ |
? |
5,35 |
5,63 |
– |
– |
– |
|
Fe3+ |
1,45 |
2,10 |
1,10 |
0,85 |
– |
– |
|
Hg2+ |
6,74 |
13,22 |
14,17 |
15,22 |
– |
– |
|
Tl3+ |
7,72 |
13,48 |
16,48 |
18,29 |
– |
– |
|
Pt2+ |
? |
11,48 |
14,48 |
16,00 |
– |
– |
F– |
Al3+ |
7,10 |
11,98 |
15,83 |
18,53 |
20,20 |
20,67 |
|
Fe3+ |
6,04 |
10,74 |
13,74 |
15,74 |
16,10 |
16,10 |
HPO42– |
Fe2+ |
7,2 |
– |
– |
– |
– |
– |
|
Fe3+ |
9,75 |
– |
– |
– |
– |
– |
H2PO4– |
Fe3+ |
3,5 |
? |
? |
9,15 |
– |
– |
Продолжение таблицы 16
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
I– |
Ag+ |
6,58 |
11,74 |
13,68 |
13,10 |
– |
– |
|
Hg2+ |
12,87 |
23,82 |
27,60 |
29,83 |
– |
– |
|
Pb2+ |
1,26 |
2,80 |
3,42 |
3,92 |
– |
– |
NH3 |
Ag+ |
3,32 |
7,23 |
– |
– |
– |
– |
|
Cu2+ |
3,99 |
7,33 |
10,06 |
12,03 |
11,43 |
8,9 |
|
Hg2+ |
8,8 |
17,5 |
18,5 |
19,3 |
– |
– |
|
Ni2+ |
2,67 |
4,79 |
6,40 |
7,47 |
8,10 |
8,01 |
ОН– |
Ag+ |
2,30 |
4,0 |
5,2 |
– |
– |
– |
Al3+ |
9,0 |
? |
27 |
33 |
– |
– |
|
Bi3+ |
12,4 |
15,8 |
? |
35,2 |
– |
– |
|
Ca2+ |
1,46 |
11,0 |
|
|
– |
– |
|
Ce3+ |
4,6 |
– |
– |
– |
– |
– |
|
Ce4+ |
13,28 |
27,06 |
– |
– |
– |
– |
|
Cr3+ |
10,1 |
17,8 |
– |
29,9 |
– |
– |
|
Cu2+ |
6,0 |
13,18 |
14,42 |
14,56 |
– |
– |
|
Fe2+ |
5,56 |
9,77 |
9,67 |
8,56 |
– |
– |
|
Fe3+ |
11,87 |
21,17 |
30,67 |
– |
– |
– |
|
Hg22+ |
9,0 |
– |
– |
– |
– |
– |
|
Hg2+ |
10,30 |
21,70 |
21,20 |
– |
– |
– |
|
Ni2+ |
4,97 |
8,55 |
11,33 |
– |
– |
– |
|
Pb2+ |
7,52 |
10,54 |
13,95 |
– |
– |
– |
|
Sn2+ |
11,93 |
20,94 |
25,40 |
– |
– |
– |
|
Sn4+ |
? |
? |
? |
? |
? |
63,0 |
|
Tl+ |
0,82 |
– |
– |
– |
– |
– |
|
Tl3+ |
12,86 |
25,37 |
– |
– |
– |
– |
|
SCN– |
Ag+ |
4,75 |
8,23 |
9,45 |
9,67 |
– |
– |
Al3+ |
0,42 |
– |
– |
– |
– |
– |
|
Cu+ |
? |
? |
9,90 |
10,05 |
9,59 |
9,27 |
|
Cu2+ |
2,30 |
3,65 |
5,19 |
6,62 |
– |
– |
Продолжение таблицы 16
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
SCN– |
Fe2+ |
1,31 |
0,43 |
– |
– |
– |
– |
Fe3+ |
3,03 |
4,33 |
4,63 |
4,53 |
4,23 |
3,23 |
|
Hg2+ |
– |
17,60 |
20,40 |
21,20 |
– |
– |
|
SO42– |
Al3+ |
3,2 |
5,1 |
– |
– |
– |
– |
|
Fe2+ |
2,30 |
– |
– |
– |
– |
– |
|
Fe3+ |
4,04 |
5,38 |
– |
– |
– |
– |
|
Pb2+ |
2,62 |
3,47 |
– |
– |
– |
– |
Таблица 17
Логарифмы констант устойчивости комплексонатов металлов
Катион |
lg |
Катион |
lg |
1 |
2 |
3 |
4 |
Ag+ |
7,31 |
Mg2+ |
9,12 |
Al3+ |
16,5 |
Mn2+ |
14,04 |
Ва2+ |
7,78 |
Na+ |
1,79 |
Са2+ |
10,59 |
Ni2+ |
18,62 |
Сd2+ |
16,46 |
Рb2+ |
18,04 |
Сe3+ |
15,81 |
Pd3+ |
18,5 |
Со2+ |
16,31 |
Sc3+ |
23,0 |
Сo3+ |
40,6 |
Sr2+ |
8,80 |
Сr3+ |
23,40 |
Th4+ |
25,3 |
Сu2+ |
18,80 |
Ti3+ |
21,3 |
Fe2+ |
14,20 |
TiO2+ |
17,5 |
Fe3+ |
24,23 |
Т13+ |
37,8 |
Продолжение таблицы 17
1 |
2 |
3 |
4 |
Ga3+ |
20,5 |
V2+ |
12,70 |
Hg2+ |
21,8 |
V3+ |
25,9 |
In3+ |
25,3 |
VO2+ |
18,0 |
La3+ |
15,5 |
Zn2+ |
16,26 |
Данные таблицы 17 используются аналогично данным таблицы 16 применительно к конкретному лиганду – этилендиаминтетраацетату (Y4–). Кроме того, они необходимы для расчёта индикаторной погрешности комплексонометрического титрования.
Таблица 18
Индикаторы для комплексонометрического титрования
Индикатор |
Определяемый ион |
pH |
Изменение окраски |
Раствор индикатора |
1 |
2 |
3 |
4 |
5 |
Ксиленоловый оранжевый |
Zn2+, Fe2+, Со2+ Fe3+ Al3+, Fe3+, Ni2+ обратное титрование солью Zn2+ |
5–6 1,5 5–6 |
Красная –желтая |
0,5 %-ный раствор в этаноле |
Метилтимоловый синий |
Ba2+, Sr2+ Ca2+ Mg2+ Со2+, Cd2+
Cu2+
Mn2+, Pb2+, Zn2+
In3+ |
10–11 12 10–11,5 5–6 12 11,5
6–6,5
3–4 |
Синяя – серая То же » » » Синяя – серо-зеленая Синяя – желтая То же |
Твердая смесь с KNO3 (1:100) или 0,1%-ный в воде |
Продолжение таблицы 18
1 |
2 |
3 |
4 |
5 |
Мурексид |
Ca2+ Co2+ Cu2+ Ni2+ |
≥12 8 7–8 8,5–9,5 |
Красная – фиолетовая То же Оранжевая – фиолетовая |
Твердая смесь с NaCl (1:100) |
ПАН 1-(пиридил-2)-азо-нафтол |
Cu2+
Ni2+
Zn2+
Al3+, Ca2+, Co2+, Fe3+, Mg2+, Mn2+, Ni2+ (обратное титрование солью Cu2+) |
3–5
9–10
4
4–6
3–5 |
Розовая – желто-зеленая Фиолетовая–желтая Фиолетово-красная–желтая Розовая –желтая Желто-зеленая– розовая
|
0,01–0,1%-ный в этаноле |
ПАР 4-(пиридил-2)-азорезорцин натриевая соль |
Cu2+
Mn2+
Ni2+ Zn2+ |
5–6 11,5
9
5 5–11,5 |
Винно-красная – зеленая Красная – желтая То же » |
0,1%-ный в воде |
Пирокатехиновыи фиолетовый |
Co2+, Ni2+ Cu2+ Mn2+, Zn2+, Mg2+
Al3+, Fe3+, Ga3+ (обратное титрование солью Cu2+) |
8 – 9,3 5 – 6,5 9 – 10
5 – 6,5 |
Зеленовато-голубая – красно-фиолетовая То же |
0,1%-ный в воде |
Продолжение таблицы 18
1 |
2 |
3 |
4 |
5 |
Сульфосалициловая кислота |
Fe3+ |
2–3 |
Красная – желтая |
5%-ный в воде |
Тайрон |
Fe3+ |
2–3 |
Синяя – бесцветная
|
2%-ный в воде |
Фталеин комплексон |
Sr2+, Ba2+, Ca2+
|
10,5 – 11 |
Красно-фиолетовая – бледно-розовая |
2%-ный в воде |
Флуорексон (кальцеин) |
Ca2+ Sr2+, Ba2+
Cu2+ Mn2+ |
>12 11,5 – 12,5 10 – 11 8 – 11 |
Зеленая флуоресценция – розовая То же » |
2%-ный в воде |
Эриохром черный T
|
Ca2+, Cd2+, Со2+, Zn2+, Mg2+, Mn2+
Ni2+,Pb2+ обратное титрование солью Zn2+ |
10 |
Винно-красная – голубая То же |
Твердая смесь c NaCl (1:100) |
Пример использования данных таблицы. Необходимо выбрать индикатор для комплексонометрического определения Са2+ в многокомпонентном растворе.
Ион Са2+ можно оттитровать раствором ЭДТА со многими индикаторами - кальцонкарбоновой кислотой, ксиленоловым оранжевым, метилтимоловым синим, мурексидом, ПАН, ПАР, флуорексоном и фталеинкомплексоном – в сильнощелочной, слабощелочной и слабокислой среде. Однако для определения Са2+ в многокомпонентном растворе пригодна только очень селективная методика, какой и является титрование с кальцонкарбоновой кислотой при рН > 12. Во всех остальных случаях с конкретным индикатором при определённом значении рН титруется сразу несколько ионов металлов.
Литература
1. Основы аналитической химии: В двух книгах /Под ред. Ю.А. Золотова.-
Кн.2:Методы химического анализа. – М.: Высш. шк..,2002.
2. Цитович И.К. Курс аналитической химии: Учеб. для с.-х. спец. вузов –
6-е изд., испр. и доп.– М.: Высш. шк., 1994
3. Алексеев В. Н. Курс качественного химического полумикроанализа. "Химия", М., 1979.
4. Алексеев В. Н. Количественный анализ. "Химия", М., 1974.
5. Крешков А. П. Основы аналитической химии. Книги 1,2,3. "Химия", М., 1976
6. Задачник по аналитической химии. "Химия", М., 1993.
7. Лурье Ю. Ю. Справочник по аналитической химии.– М.: Химия, 1989.
