
- •Содержание
- •Введение
- •Диссоциация электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Ионное произведение воды
- •Расчет рН сильных кислот и оснований
- •Расчет рН слабых бинарных кислот и оснований
- •Влияние сильных электролитов и одноименных ионов на ионные равновесия в слабых электролитах
- •Буферные растворы
- •Гидролиз солей
- •Вопросы и задачи для самостоятельного решения
- •Тест для самоконтроля «Ионные равновесия в гомогенных системах»
- •Равновесия в гетерогенных системах
- •Произведение растворимости
- •Задачи на применение условия выпадения осадка
- •Расчет растворимости осадков в присутствии одноименных ионов
- •Расчет растворимости осадка в присутствии разноименных ионов (солевой эффект)
- •Дробное осаждение
- •Вопросы и задачи для самостоятельного решения
- •Окислительно-восстановительное равновесие
- •Расчет констант равновесия окислительно-восстановительных реакций
- •Расчет окислительно-восстановительного потенциала
- •Вопросы и задачи для самостоятельного решения
- •Равновесия в растворах комплексных соединений
- •Вопросы и задачи для самостоятельного решения
- •Тест для самоконтроля «Ионные равновесия в реакциях осаждения, комплексообразования и окисления-восстановления»
- •Качественный анализ
- •Вопросы и задачи для самостоятельной работы
- •Гравиметрический анализ
- •Расчет количества осадителя
- •Рассчитаем массу 4 %-ного раствора Na2hpo4:
- •Расчет потерь осадка при промывании
- •Выбор оптимального интервала значений рН
- •Расчёт результатов гравиметрического определения
- •0,0623 Г Ag содержится в 125 мл раствора;
- •Вопросы и задачи для самостоятельного решения
- •Титриметрические методы анализа
- •Способы выражения концентраций растворов
- •Определение фактора эквивалентности
- •Пример 2. Какой объем 0,1 н. Раствора серной кислоты необходимо отмерить для приготовления 100 мл 0,02 н. Раствора?
- •Способы титрования
- •Кислотно-основное титрование
- •Выбор индикатора
- •Вопросы и задачи для самостоятельного решения
- •Окислительно-восстановительное титрование
- •Оксидиметрические индикаторы
- •Вопросы и задачи для самостоятельного решения
- •Комплексонометрическое титрование
- •Выбор индикатора и условий проведения анализа
- •Вопросы и задачи для самостоятельного решения
- •Примеры построения кривых титрования
- •Титрование сильных кислот и оснований
- •Титрование слабой кислоты сильным основанием
- •0,40 Моль/л раствором koh.
- •Вопросы и задачи для самостоятельного решения
- •Окислительно-восстановительное титрование
- •Вопросы и задачи для самостоятельного решения
- •Физико-химические методы анализа
- •Потенциометрия и потенциометрическое титрование.
- •Вольтамперометрия
- •Кулонометрия.
- •Вопросы и задачи для самостоятельного решения
- •Спектроскопические методы анализа
- •Фотометрические методы анализа.
- •Вопросы и задачи для самостоятельного решения
- •Атомно-абсорбционная спектроскопия
- •Вопросы и задачи для самостоятельного решения
- •Эмиссионный спектральный анализ
- •Вопросы и задачи для самостоятельного решения
- •Люминесцентный анализ
- •Вопросы и задачи для самостоятельного решения
- •Хроматографические методы анализа
- •Ионообменная хроматография.
- •100,0 ∙ 0,09567 Ммоль NaOh.
- •17,80 ∙ 0,09051 Ммоль щелочи,
- •Газовая хроматография.
- •Вопросы и задачи для самостоятельного решения
- •Метрологические характеристики методов анализа
- •Вопросы и задачи для самостоятельного решения
- •Справочные материалы
- •Коэффициенты активности ионов
- •Коэффициенты активности при высоких значениях ионной силы
- •Относительные атомные массы элементов
- •Растворимость неорганических и некоторых органических соединений в воде
- •Плотности водных растворов некоторых веществ при 20оС
- •Произведения растворимости важнейших малорастворимых веществ
- •Значения рН осаждения гидроксидов металлов
- •Гравиметрические факторы
- •Константы ионизации кислот
- •Константы ионизации оснований
- •Интервал рН перехода важнейших индикаторов
- •Некоторые смешанные индикаторы
- •Стандартные электродные потенциалы (е°) при 25°с
- •Окислительно-восстановительные индикаторы
- •Логарифмы суммарных констант устойчивости комплексных соединений
- •Логарифмы констант устойчивости комплексонатов металлов
- •Литература
Дробное осаждение
Если в растворе присутствуют несколько веществ, способных осаждаться одним осадителем, то осадки будут выпадать последовательно, по мере достижения произведения растворимости. Зная исходные концентрации веществ и произведения растворимости можно рассчитать последовательность и полноту выделения осадков.
Пример 8. Какой осадок будет выделяться первым при приливании AgNO3 с концентрацией 0,1 моль/л к 1 литру раствора, содержащего 0,1 моль KCl и 0,1 моль K2CrO4? Возможно ли раздельное выделение ионов Cl– и CrO42– в данных условиях?
Решение. Первым будет выпадать тот осадок, произведение растворимости которого будет достигнуто при меньшей концентрации Ag+:
AgCl
⇄
Ag+
+ Cl-
![]()
![]()
Ag2CrO4
⇄
2Ag+
+ CrO42-
![]()
![]()
Первым будет выпадать осадок AgCl.
Образование осадка Ag2CrO4 начнется тогда, когда концентрация хлорид-иона вследствие образования осадка AgCl снизится, а, следовательно, концентрация ионов Ag+ повысится настолько, что будет достигнута величина произведения растворимости Ag2CrO4. При совместном выделении осадков концентрация ионов серебра будет равна:
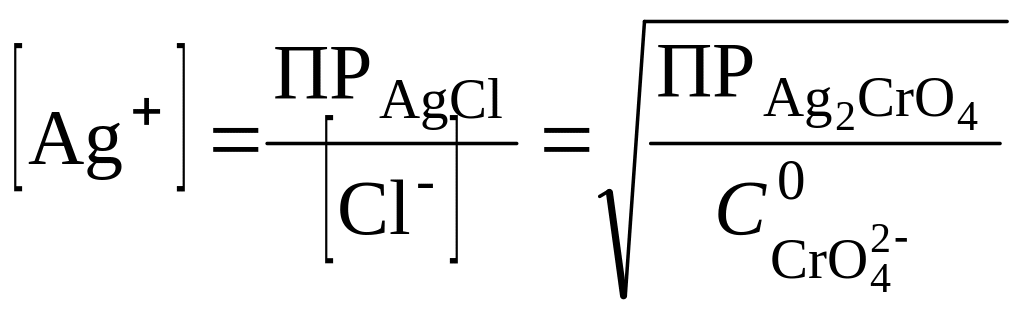 ,
откуда
,
откуда

В качественном химическом анализе считается, что ион полностью выделен из раствора, если его концентрация в растворе меньше 1.10-6 моль/л. В данном случае раздельное выделение ионов невозможно.
Вопросы и задачи для самостоятельного решения
Чем величина произведения растворимости отличается от константы ионизации малорастворимого соединения?
Опираясь на правило произведения растворимости, сформулируйте условия образования и растворения осадков.
Что такое солевой эффект? Приведите примеры.
Как влияет на растворимость осадков введение сильных электролитов, содержащих одноименные ионы с одним из ионов осадка?
5. Напишите выражение для произведения растворимости осадков:
BaSO4, CuS, Ag2SO4, Ca3(PO4).
6. Рассчитайте растворимость CaC2O4 в г/л в 0,01 М растворе Na2C2O4.
Ответ: 3,3 ∙ 10–5 г/л.
7. К 1 мл 0,1 н раствора соляной кислоты прилили 1 мл 0,01 н раствора нитрата серебра. Выпадет ли при этом осадок?
Ответ: да.
8. По растворимости сульфата кальция, равной 2 г/л, вычислить произ-
ведение растворимости этого соединения. При вычислении учитывать коэффициенты активности ионов.
Ответ: 6,5 ∙ 10–5.
9. Во сколько раз растворимость CaC2O4 меньше в 0,01 М растворе
(NH4)2C2O4 по сравнению с растворимостью его в чистой воде? При вычислении учитывать коэффициенты активности ионов.
Ответ: приблизительно в 108 раз
10. Во сколько раз растворимость хлорида серебра меньше в 0,03 М рас-
творе соляной кислоты по сравнению с растворимостью его в чистой воде? При вычислении учитывать коэффициенты активности ионов.
Ответ: в 2222 раза.
Вычислите ПР хлорида свинца, если известно, что растворимость PbCl2
при 20 С в 100 мл воды равна 0,99 г (плотность раствора ρ = 1,007 г/см3).
Ответ: ПР = 3,4.10-5.
Вычислите растворимость BaSO4 в 0,1 М растворе Na2SO4.
Ответ: S = 1,05.10-5.
Вычислите растворимость Co(OH)2 в 1 М растворе уксусной кислоты.
Ответ: S = 0,49 М.
Какую концентрацию муравьиной кислоты нужно создать, чтобы в
100 мл ее растворилось 0,2137 г Fe(OH)3?
Ответ: С = 2,1 моль/л.
Вычислите растворимость сульфида кадмия с учетом гидролиза аниона,
пренебрегая гидролизом катиона.
Ответ: 1,15.10-10.
