

Механізм дії ферментів
•В класичних роботах Міхаеліса і Ментен процес ферментативного каталіза складається зтрьох стадій:
• |
E+S |
|
k1 |
|
ES |
|
|
ES* |
|
|
|
EP |
k2 |
E+P |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
k-1 |
|
|
|
|
|
|
|
|
|
|
|
•1 |
. Диф узія субстрат у |
до ферменту та утворення |
Е |
(Sферментосубстратного ) |
||||||||||
комплексу. Це швидка та зворотна стадія . |
Протягом цієї стадії реал ізується точн а |
|||||||||||||
просторова, геометрич на та електростатична відповідність (комплементарність) м іж активним центром ферменту та субстратом .
•2 . П еретворення первинного ES комплексу у активований - ЕS*. Ця стадія
відбувається повільно , при цьому за допомогою функціональних груп ферменту зв’язки субстрату розхитуються та зменшується енергія активації реакції.
•3 . |
Відокремлення продукт ів реакц ії від активного центр у та |
їхня |
дифузія у |
|
середовище. Фермент |
не входить до складу кінцевих продуктів реакції. |
|
||
Ефективність ферментативного катал ізу пояснюється наступними |
молекулярн ими |
|||
ефектами: |
|
|
|
|
1. Орієнтацією реагентів: |
|
|
||
субстрат з’єднується з |
ферментом як мінімум у трьох місцях (триточкова фіксація), |
|||
що забезпечує високу вибірковість (комплементарність) зв’язування та |
ор ієнтацію |
|||
субстрату. Це призводить до збільшення швидкості реакції у сотні та тисячі разів, що неможливо при безладних взаємодіях.
2. Напруженням і деформацією (ефект “диби”):
при зв’язуванні з активним центром молекула субстрату деформується, напружується , і місця деформації розриваються більш легко.
3. Кислотно -основним каталізом:
ферменти як білки мають у активному центрі кислотні та основні групи, тому вони
можуть бути |
донорами або акцепторами протон ів, що відрізняє ферменти від |
||
неорганічних каталізаторів. Це полегшує перебудову |
та розрив зв ’язків у субстрат і. |
||
Наприклад , т ак |
працює залишок |
амінокислоти |
гістидину в активном у центрі |
ферменту, при його блокуванні фермент утрачає активність.
4. Ковалентним каталізом:
до активного центру ферментів можуть входити групи, здатні утворювати ковалентні зв’язки з субстратом із наступним формуванням несталих ES комплексів та швидким вивільненням продуктів реакції .
Як правило , для ферментів притаманно поєднання усих цих механізмів, що забезпечує
їхню високу активність. |
11 |
Кінетика ферментативних реакцій
• Досліджує законом ірності впливу хімічної природ и реактант ів і різноманітних зовнішніх умов (рH, температури та інших ) на швидкість ферментативн их реакц ій для з’ясування механізмів біохімічних процесів.
“Вивчити кінетику та не з’ясувати механізм реакції – це те ж саме, що знайти капелюх і втратити йоговласника” (Інгольд ).
• Як вже відомо , швидкість ферментативної реакції залежить від температури , рН середовища . Крім того, на швидкість реакції впливають концентрація ферменту (прямо пропорційно) та концентрація субстрату.
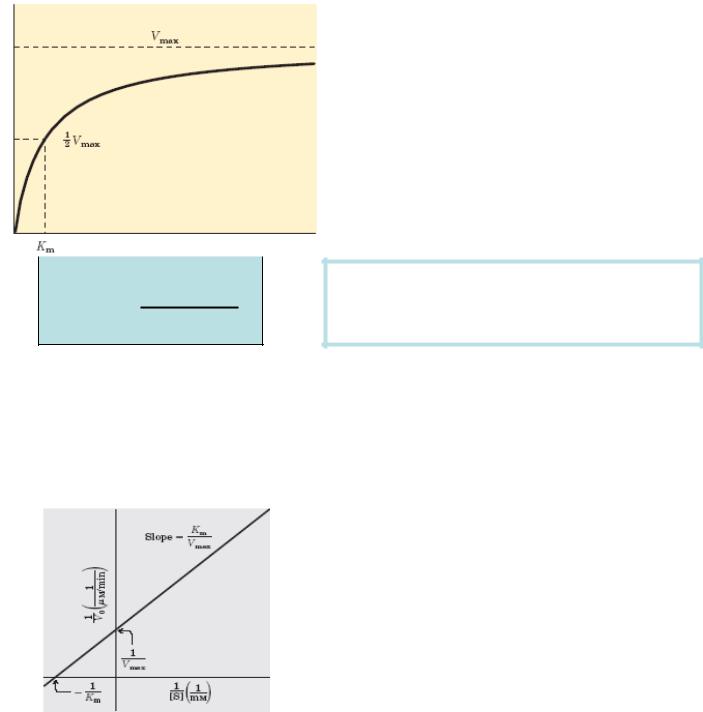
Залежність швидкості ферментативної реакції від концентрації субстрату
швидкість
концентрація субстрату
Vmax . [S]
V = КM + [S]
Як видно з граф |
іка, при низ |
ькій |
|||
концентрації субстрат |
у |
[S] |
залежність |
||
швидкості |
реакц ії |
V від |
концентрації |
||
субстрату лінійна. |
|
|
|
|
|
При в исокій концентрац |
ії субстрат |
у |
|||
швидкість реакц ії максимальна |
Vmax та не |
||||
залежить від |
концентрації субстрату, тобто |
||||
спостерігається ефект |
насичення фермента |
||||
субстратом . |
|
|
|
|
|
Рівняння Міхаеліса-Ментен відображує швидкість ферментативної реакції в залежності від концентрації субстрату.
КM – константа Міхаеліса – чисельно дорівнює концентрації субстрату за умов, коли швидкість ферментативної реакції дорівнює половині від максимальної
(КM має розмірність концентрації).
КM |
- це |
експериментально |
визначаєма величин а, визначення якої має практич не |
значення |
для з’ясування дії |
ефекторів (активаторів або інгібіторів) на активн ість |
|
ферменту (КM обернено пропорційна активності ферменту).
Більш зручним для обр обки результат ів є граф ік у координатах Лайну ївера-Берка, кот рий відображує прямо пропорційну за лежність . Це дозволяє легко обчислити значення константи Міхаеліса й оцінити активність ферменту за конкретних умов.
12

Регуляція активності ферментів
Для оцінки активності ферментів визначають кількість розщепленого субстрату або кількість утвореного продукту реакції .
Активність ферментів досліджують устандартних умовах:
• температура - 25 С
• рH середовища оптимальне значення
• повне насичення ферменту субстратом (швидкість реакції максимальна )
• повне насичення складного ферменту кофактором
Міжнародна одиниця активності ферменту (МО)– це така кількість ферменту , котра перетворює 1 мікромоль субстрату за 1 хвилину у стандартних умовах (мікромоль /хв).
Питома активність - дорівнює числу одиниць ферментативної активності , що припадає на міліграм білка (мкмоль /(хв мг білка).
Катал (кат) - кількість ферменту , здатного перетворити 1 моль субстрату за 1 секунду у стандартних умовах (моль/с). ОднаМО дорівнює 1/60 мккат або 16,67 нкат.
Чинники , що впливають на активність ферментів :
• температура
• рH середовища
• концентрація ферменту
• концентрація субстрату
• наявність активаторів або інгібіторів
Таким чином , ферменти належать до каталізаторів з регульованою активністю , що дуже важливо для підтримки гомеостазу .
Активація ферментів
1. Алостерична регуляція
Багато ферментів належать доалостеричних , тобто до регуляторних . Крім активного
центру , вони маютьалостеричний центр, який знаходиться у іншому місці молекули ферменту . Такі ферменти , як правило , складаються з декількох субодиниць , тобто належать до білків із четвертинною структурою . В одній із субодиниць міститься активний центр, а в іншій - алостеричний центр, до якого приєднуються низькомолекулярні сполуки -ефектори. Структура ефектору повинна бути комплементарною до структури алостеричного центру подібно тому, як структура субстрату компле -ментарна до активного центру ферменту .
Ефектори можуть бути активаторами або інгібіторами реакцій .
Після приєднання алостеричного ефектору до регуляторної субоединиці відбуваєть -
ся зміна її конформації , що сприяє конформаційним змінам у каталітичній субодини - ці. Внаслідок цього активний центр стає більш або менш комплементарним до субстрату (алостерична активаціяабо алостеричне інгібування).
13
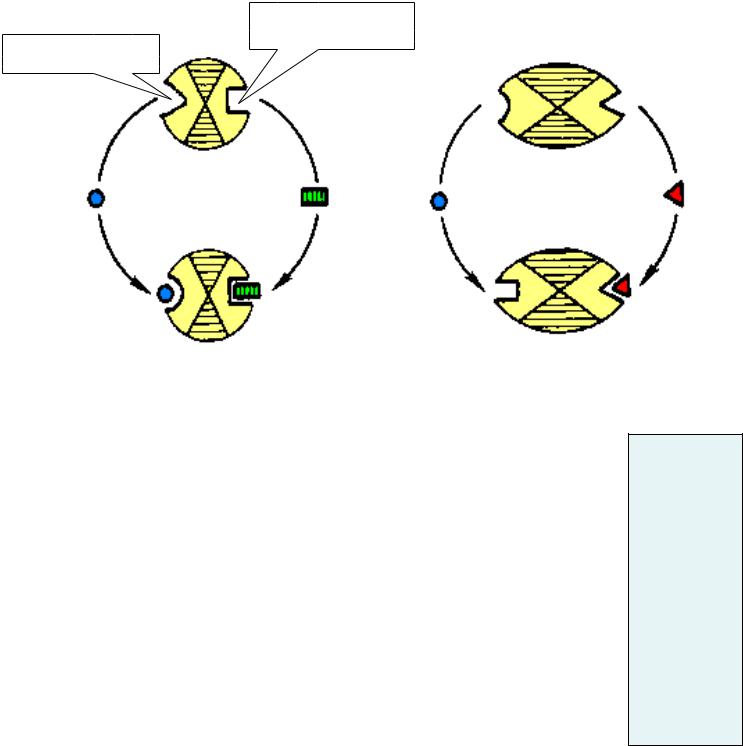
•Гетеротропні алостеричні ефектори– це сполуки , котрі відрізняються від субстрату за хімічною структурою.
• Гомотропна алостерична регуляція притаманна ферментам, які складаються із однакових протомерів, і в кожному з протомерів міститься свійактивний центр. У цьому випадку субстрат сам стає ефектором , і після його зв’язування з одним протомером відбувається активація інших .
алостеричний
центр
активний центр
субстрат |
активатор |
інгібітор |
алостерична активація |
алостеричне інгібування |
2. Активація кофакторами
Наявність кофакторів – необхідна умова активності складних ферментів. Функції кофакторів найчастіше всього виконують активн і форм и вітамінів або іони двох-, іноді одновалентн их метал ів. Ч верть відомих ферментів потребує метали для своєї активност і. Наприклад , амілаза слини активується ионами натрію .
Активація металами здійснюється за різними механізмами :
- іони металів приймають участь у формуванні та стабілізації активного центру; - іони металів виконують роль простетичних груп;
- іони металів полегшують зв’язування субстрату з активним центром ферменту; - метал приєднується до субстрат у, утворюючи металосубстратн ий
комплекс (справжній субстрат ), на який діє фермент .
Деякі металикофактори
Cu2+
Fe2+
Fe3+
K+
Mg2+
Mn2+
Mo+
Ni2+
Se+
Zn2+
14
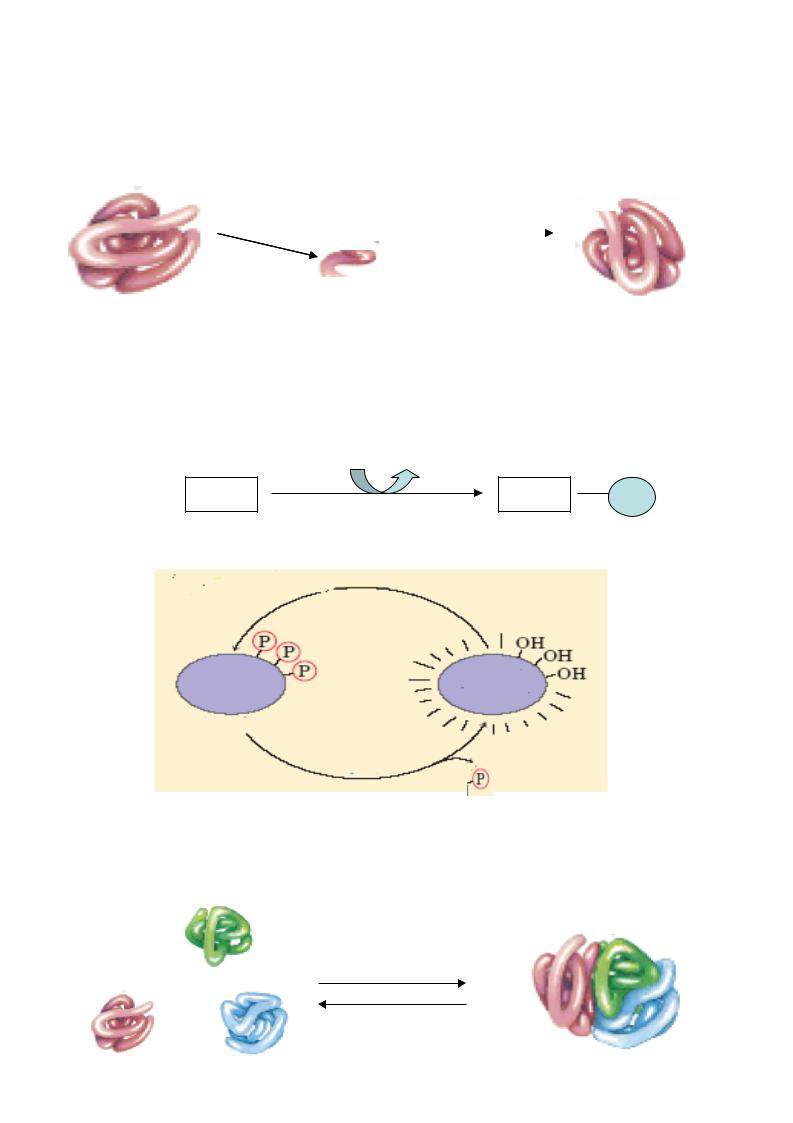
3. Част ковий протеол із - п еретворення неактивного фермент у (зимогену або проферменту) у активний шляхом відщеплення поліпептидного фрагменту. За цих умов гідролізується од ин пептидн ий зв’язок, т обто головним наслідком є зміна перви нної структури фермент у. Цей механізм притаманний для протеол ітичних ферментів, які приймають участь у перетравленні білків.
|
|
Н2О |
|
|
|
|
|
|
|
||||
|
|
поліпептидний фрагмент |
||||
неактивниыйфермент |
|
|
|
|
активний фермент |
|
Це еволюційно сформований механізм за хисту структурн их б ілків кл ітин від дії протеаз .
4. Фосфорилювання - дефосфорилювання ферментів
Деякі фермент и активуються при фосфорил юванні (введені негативно заря дженої фосфатної групи) під дією ферменту протеїнкінази , наприклад:
АТФ АДФ
ліпаза |
протеїнкіназа |
ліпаза |
Ф |
неактивна |
|
активна |
|
Інші ферменти активуються при дефосфорилюванні:
глікоген- |
глікоген- |
синтаза |
синтаза |
неактивна
Н2О |
|
активна |
|
|
|
|
|
протеїнфосфатаза |
|
|
|
5. Асоціація та дисоціація протомерів |
|
|
|
Ряд ферментів актив ується після при |
єднання |
або відщеплення |
регуляторних |
субодиниць або білків-регуляторів. При |
цьому |
головним є зміна |
четвертинної |
структури ферменту. |
|
|
|
асоціація
дисоціація
15
Інгібування ферментів
• Дослідження інгібування має дуже важливе значення для порозуміння механізмів дії
багатьох ферментів, |
а також ферментативного каталізу. Воно допомагає вивчати |
|
метаболічні процес и. |
Інгібітори активності ферментів використовуються |
в |
фармакології, промисловості. |
|
|
• Інгібітори характеризуються міцністю зв’язування з субстратом , (встановлюється за допомогою діалізу), тому вони розподіляються на дві групи:
•1 . Незворотні інгібітори – с полуки, що специфічно зв’язують функц іональні груп и ферментів, утворюючи з ними міцніковалентні зв’язки.
•2 . Зворотні інгібітори – утворюють неміцні, нековалентн і зв’язки з ферментами та можуть дисоціювати від ферментів.
|
|
інгібітори |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
зворотні |
|
|
незворотні |
|
|
|
|
||||
інгібітори |
|
|
|
|
|
інгібітори |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
конкурентні |
|
|
|
неконкурентні |
|
|
|
|
інгібітори |
|
|
|
інгібітори |
|
|
|
|
|
|
|
|
|
|
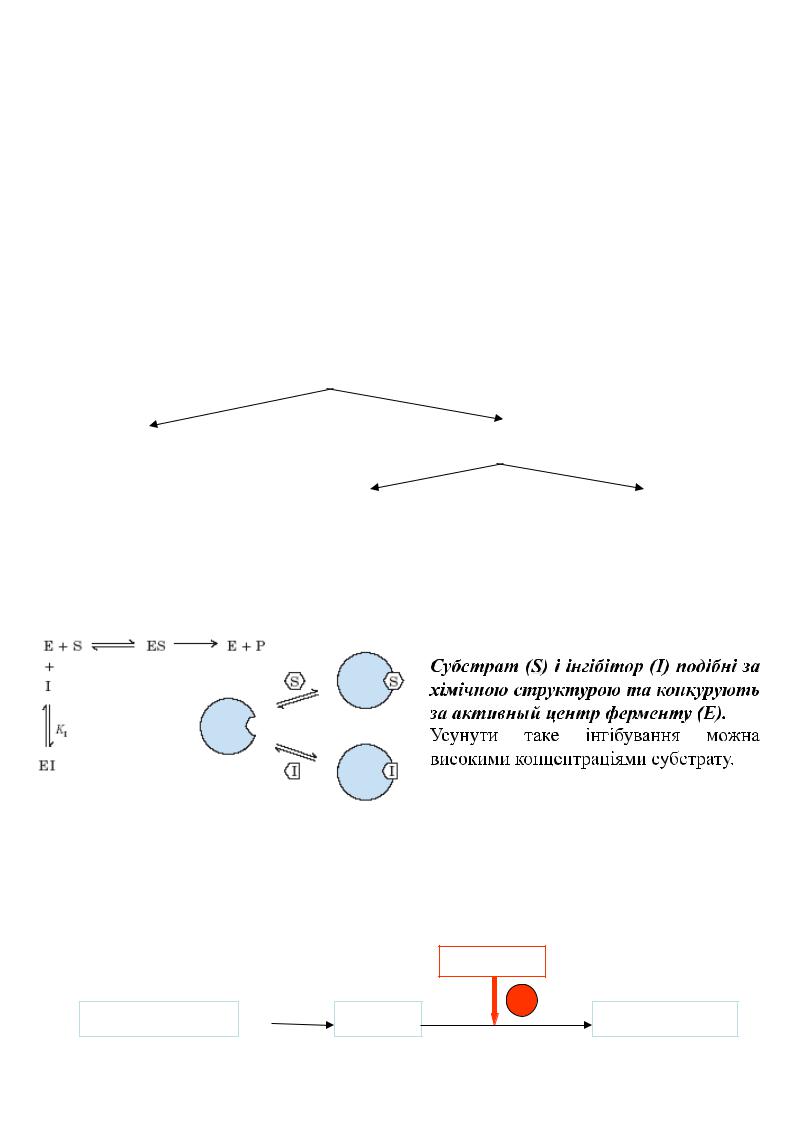
1. Конкурентне інгібування
Е
Е
Е
Дія багатьох лікарських засобівбазується на конкурентному інгібуванні.
Наприклад, для л ікування подагри, с причиненої накопиченням сечової кислоти , використовується конкурентн ий інгібітор ксантиноксидази алопуринол, який є структурним аналогом ксантину – проміжного продукту у процесі утворення сечової кислоти:
|
|
алопуринол |
|
|
_ |
пуринові основи |
ксантин |
сечова кислота |
16 |
|
ксантиноксидаза |
|
|
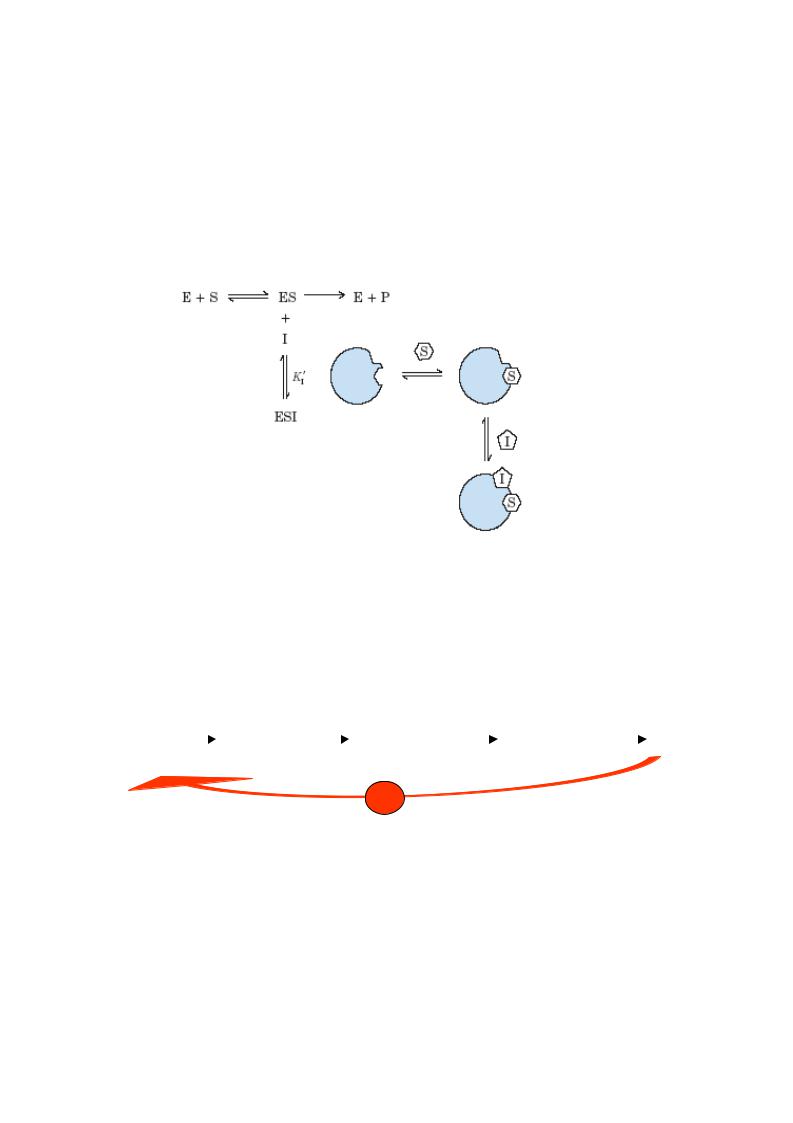
2. Неконкурентне інгібування
Інгібітор (I) не має структурної подібності з субстратом (S), тобто спорідненості
до |
активно го центру фермен -ту, |
тому зв’язування інгібітору з ферментом часто |
||
відбувається не в активному центрі, а в іншому місці |
молекули субстрату. При цьому |
|||
може утворюватися |
потрійний комплекс ESI. Ус унути неконкурентне інгібування |
|||
високими концентрац іями субстрат у |
неможливо, для |
цього потрібні речовини, що |
||
зв’язують інгібітор . |
|
|
|
|
Е |
Е |
|
|
Е |
|
|
|
Неконкурентний інгібітор |
|
|
|
|
|
зменшує Vmax, але не впливає |
|
Конкурентний інгібітор |
на спорідненність ферменту із |
|
підвищує KM, але не впливає |
субстратом . |
|
на Vmax |
Алостеричне інгібування належить до неконкурентного, і часто здійснюється за механізмом оборотного негативного зв’язку:
|
S |
|
|
Р1 |
|
Р |
2 |
|
|
Р |
3 |
|
|
Р |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
Е1 |
|
Е2 |
|
Е3 |
|
|
Еn |
n |
|
|||
|
|
|
|
|
_ |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Іноді при тривалій дії неконкурентного інгібітору |
та утворенні міцних |
зв’язків із |
|||||||||||||
ферментом таке інгібування стає незворотним . Незворотні інгібітори часто б увають токсичними.
•Наприклад , цианіди, міцно зв’язуючись із залізом , що входить до цитохромоксидази, блокують дихальний ланцюг, що призводить до клітинної смерті.
•Іони важких метал ів також дуже токсичні , тому що вони блокують SH-групи у активному центрі ферментів , при цьому субстрат може зв’язуватися з активн им центром ферменту, але продукти реакції не утворюються.
•Інгібітори холінестерази, кот ра розщеплює ацетилхол ін, незворотно фосфорилюють каталітичну групу ферменту (отрути з нервово -паралітичною дієюзарин, зоман).
17
Використання ферментів у медицині
Використання ферментів у медицині здійснюється у трьох головних напрямках :
1. Ензимопатологія - дослідження ферментативної активності в норм і та патології з метою виявлення спадкових захворювань - ензимопатій, спричинених генетич ними дефектами ферментів. Внаслідок цього порушуються синтез і активність ферментів, що призводить до аномалій метаболізму.
2. Ензимотерапія - використання ферментів і регуляторів дії ферментів як лікарських засобів. Наприклад , інгібітори протеолітичних ферментів (які в нормі продуцуються підшлунковою залозою у неактивному стані) використуються для запобігання аутолізу підшлункової залози при гострому панкреатиті .
3. Ензимодіагностика розвивається у двох напрямках:
 Використання високоочищених ферментів як аналітичних реактивів, тобто у якості специфічних реагентів , необхідних для кількісного визначення у біологічних рідинах хімічних речовин ,нормальних або патологічних, з діагностичною метою .Цей метод діагностики характеризується високими специфічністю та чутливістю . У клініці за допомогою ферментів визначають вміст глюкози , лактату , сечовини , сечової кислоти та інших сполук .
Використання високоочищених ферментів як аналітичних реактивів, тобто у якості специфічних реагентів , необхідних для кількісного визначення у біологічних рідинах хімічних речовин ,нормальних або патологічних, з діагностичною метою .Цей метод діагностики характеризується високими специфічністю та чутливістю . У клініці за допомогою ферментів визначають вміст глюкози , лактату , сечовини , сечової кислоти та інших сполук .
 Визначення активності ферментів у біологічних рідинах при ураженні органів і тканин. Зміна концентрації або активності ферментів у багатьох випадках може бути наслідком , а не причиною патологічних процесів . Для цих аналізів використовуються сироватка або плазма крові, а також сеча, слина, секрет підшлункової залози та інші біологічні рідини .
Визначення активності ферментів у біологічних рідинах при ураженні органів і тканин. Зміна концентрації або активності ферментів у багатьох випадках може бути наслідком , а не причиною патологічних процесів . Для цих аналізів використовуються сироватка або плазма крові, а також сеча, слина, секрет підшлункової залози та інші біологічні рідини .
Більшість ферментів, активність яких досліджується у плазмі крові, є внутрішньоклітинними . У невеликій кількості внутрішньоклітинні ферменти визначаються у крові як наслідок клітинного оновлення . Але після пошкодження клітинних мембран вони вивільняються у кров, і тоді їхні концентрація й активність суттєво підвищуються , що й свідчить про ураження того або іншого органа або тканини . Тому такі ферменти називаються “індикаторними ферментами”.
18
Тести до теми “Ферменти ”
1. У |
сироватці |
крові хворого визначено високу активність ізоферменту ЛДГ1. |
|
Про патологічний |
процес в якому органі йде мова? |
A.У нирках
B.У печінці
C.У скелетних м'язах
D.У підшлунковій залозі
E.У серці
2. У хворого гострий панкреатит . Які препарати повинен призначити лікар, щоб уникнути аутолізу (руйнування ) підшлункової залози ?
A.Активатори протеаз
B.Інгібітори протеаз
C.Трипсин
D.Хімотрипсин
E.Амілазу
3. α-Амілаза слини каталізує гідроліз 1,4-глікозидних зв’язків крохмалю . Активатором цього ферменту є іони:
A.Натрію
B.Калію
C.Міді
D.Свинцю
E.Заліза
4. У регуляції активності ферментів важливу роль відіграє їх ковалентна модифікація . Який із зазначених механізмів здійснюється при регуляції активності глікогенфосфорилази і глікогенсинтетази ?
A.Обмежений протеоліз
B.Метилювання
C.Аденілювання
D.Фосфорилювання -дефосфорилювання
E.АДФ-рибозилювання
5. Важливим кишковим ферментом є трипсин , який розщеплює пептони , що надійшли зі шлунку . До якого класу ферментів він належить ?
A.Оксидоредуктаз
B.Трансфераз
C.Гідролаз
D.Ліаз
E.Лігаз
Еталони відповідей : |
|
1- Е; 2 – В; 3 – А; 4 – D; 5 – C. |
19 |

ВІТАМІНИ
”Аміни жизни ” (К.Функ)
Вітаміни - це необх ідні для нормально ї життєдіяльності харчові низькомолекулярні органічні сполуки, синтез яких у организмів даного виду відсутній або ограничен .
• Джерела вітамінів у людини – продукти харчування та бактерії кишечнику. Деякі вітаміни надходять в орган ізм у вигляді попередників - провитамінів, кот рі в тканинах перетворюються в активн і речовини (наприклад, каротино їди, котрі містяться в моркві, томатах , червоному перці, - це провітаміни вітаміну А).
• Вітаміни мають характерні особливості . Вони:
не включаються до структури органів і тканин; невикористовуються як джерела енергії .
Класифікація та номенклатура вітамінів
Кожний вітамін має свій буквений символ, а також хімічну та фізіологічну назву. Наприклад ,
вітамін С = аскорбінова кислота = антискорбутний вітамін.
Вітаміни класифікуються на жиророзчинні та водорозчинні.
1. Жиророзчинні вітаміни – вітаміни А, D, Е, К, а також вітаміноподібні речовини - убіхінон (вітамін Q), есенціальні жирні кислоти
( ітамінв F)
2. Водорозчинні вітаміни – вітаміні групи В, вітаміни Н, С, вітаміноподібні речови - ни -холін, ліпоєва кислота , карнітин, оротова кислота та інші
Дисбаланс витамінів в організмі
Гіповітаміноз – часткова нестача вітамінів (має клінічні та біохімічні прояви). Авітаміноз – повний дефіцит вітамінів.
Гіпервітаміноз - надлишок вітамінов (стосується головним чином жиро розчинних вітамінів, які можуть накопичуватися в організмі та призводити до інтоксикації).
Причини дисбалансу вітамінів:
Екзогенні причини: нераціональне харчування .
Ендогенні причини: - порушення всмоктування у кишечнику
-збільшена потреба (наприклад, при вагітності)
-захворювання печінки
-посилення розпаду вітамінів
-поразка мікрофлори кишечника
20
