
- •Тема 1: основы
- •1.Организационный момент.
- •2.Основной материал:
- •1.Магнитное поле и его свойства:
- •II. Силовая характеристика магнитного
- •1) Для прямых токов
- •2) Для круговых токов:
- •III. Действие магнитного поля на проводник с током:
- •V. Применение закона Ампера:
- •1) Принцип действия электродвигателя:
- •2) Электроизмерительные приборы:
- •5. Закрепление пройденного материала:
- •7. Домашнее задание:
- •1.Организационный момент:
- •2. Проверка домашнего задания:
- •3.Основной материал:
- •1. Действие магнитного поля на движущийся электрический заряд:
- •2. Движение заряженных частиц в однородном магнитном поле:
- •3. Применение силы Лоренца:
- •4. Проявление силы Лоренца в природе:
- •4. Закрепление пройденного материала:
- •1. Организационный момент:
- •2. Проверка домашнего задания:
- •1). Магнитная проницаемость –
- •2). Три класса магнитных веществ:
- •3. Применение ферромагнетиков.
- •4. Закрепление пройденного материала:
- •1.Организационный момент:
- •2. Проверка домашнего задания:
- •3.Основной материал:
- •1. Опыты Фарадея:
- •2. Магнитный поток:
- •3.Явление электромагнитной индукции:
- •4. Правило Ленца:
- •5. Закон электромагнитной индукции:
- •6. Применение правила Ленца в законе электромагнитной индукции:
- •7. Вихревое электрическое поле:
- •8. Применение явления электромагнитной индукции:
- •I. Эдс индукции в движущемся проводнике.
- •II. Электродинамический микрофон.
- •III. Применение явления электромагнитной индукции:
- •1) Схема замыкания:
- •2) Схема размыкания:
- •2) Аналогия самоиндукции и инерции.
- •3) Индуктивность.
- •1.Организационный момент.
- •3.Основной материал:
- •III. Аналогия механических и электромагнитных колебаний:
- •I. Уравнение колебаний в контуре.
- •II. Аналогия уравнений механических и электромагнитных колебаний.
- •III. Гармонические колебания.
- •IV. Характеристики гармонических колебаний:
- •V. Гармонические колебания силы тока:
- •II. Активное сопротивление (r):
- •III. Мощность в цепи переменного тока с активным сопротивлением:
- •IV. Действующие значения силы тока и напряжения.
- •V. Емкостное сопротивление (хс):
- •VI. Индуктивное сопротивление (хl):
- •VII. Закон Ома для цепи переменного тока:
- •I. Резонанс в электрической цепи.
- •III. Работа генератора на транзисторе:
- •IV. Основные элементы автоколебательной системы:
- •2.Устройство и принцип действия индукционного генератора переменного
- •I. Подготовка к усвоению новой темы:
- •II. Основной материал:
- •2 . Работа нагруженного трансформатора:
- •3). Демонстрация работы трансформатора:
- •III. Закрепление пройденного материала:
- •1). Лабораторные исследования по фрагменту фильма:
- •IV. Подведение итогов урока:
- •Холостой ход трансформатора (без нагрузки):
- •2. Работа нагруженного трансформатора
- •Применение в источниках питания
- •Другие применения трансформатора
- •1.Организационный момент:
- •2. Проверка домашнего задания:
- •3.Основной материал:
- •1. Механизм распространения упругих
- •2. Виды волн:
- •4. Уравнение плоской волны:
- •7) Стоячие волны:
- •3. Характеристики волн:
- •3)Скорость распространения волны (V):
- •5. Энергия волны:
- •1) Условие максимума:
- •2) Условие минимума:
- •4. Закрепление пройденного материала:
- •1.Организационный момент:
- •2. Проверка домашнего задания:
- •3.Основной материал:
- •1.Звуковые волны:
- •2. Приемники звуковых волн:
- •3. Звуковые явления:
- •4. Физические характеристики звука:
- •3) Интенсивность звуковой волны
- •Электромагнитные волны распространяются в веществе с конечной скоростью
- •4. Электромагнитные волны переносят энергию.
- •6. Электромагнитные волны могут возбуждаться только ускоренно
- •Создать электромагнитные колебания высокой частоты;
- •Открыть колебательный контур.
- •I. Основы фотометрии:
- •1) Интерференция на тонких пленках (Гюйгенс)
- •2) Кольца Ньютона
- •1 Луч образовался при отражении света от выпуклой поверхности линзы;
- •I. Виды излучений:
- •II. Распределение энергии в спектре:
- •III. Спектральные аппараты.
- •Основы специальной теории относительности:
- •I. Принцип относительности и законы электродинамики:
- •II. Постулаты теории относительности
- •1. Принцип относительности
- •III. Относительность одновременности:
- •IV. Следствия из постулатов Эйнштейна: Основы специальной теории относительности:
- •1) Относительность промежутков времени:
- •2) Относительность расстояний
- •3) Релятивистский закон сложения скоростей (V ≈ c)
- •4) Зависимость массы от скорости
- •5) Основной закон релятивистской механики
- •5. Связь между массой и энергией:
- •I. Тепловое излучение тел:
- •II. "Ультрафиолетовая катастрофа":
- •1) Наблюдение фотоэффекта:
- •2) Изучение фотоэффекта:
- •2. Для каждого вещества существует так называемая красная граница фотоэффекта, т. Е. Наименьшая частота νmin , при которой еще возможен внешний фотоэффект.
- •3. Число фотоэлектронов, вырываемых светом из катода за 1 с, прямо пропорционально интенсивности света.
- •IV. Фотоны.
- •V. Корпускулярно-волновой дуализм:
- •VI. Применение фотоэффекта:
- •1. Вакуумные фотоэлементы:
- •2. Полупроводниковые фотоэлементы:
- •Физика атома и атомного ядра
- •I. Строение атома:
- •III. Модель атома водорода по Бору.
- •IV. Опыты Франка и Герца.
- •V. Лазеры
- •I. Методы регистрации заряженных частиц:
- •1) Сцинтилляционный счетчик
- •2) Счетчик Гейгера:
- •II. Открытие радиоактивности
- •III. Закон радиоактивного распада.
- •I. Открытие протона:
- •II. Открытие нейтрона:
- •III. Строение атома:
- •IV. Особенности взаимодействия нуклонов:
- •V. Энергия связи атомных ядер:
- •1. Механизм деления ядра урана:
- •2. Цепная ядерная реакции:
- •В атомных бомбах цепная неуправляемая ядерная реакция возникает при быстром соединении двух кусков , каждый из которых имеет массу несколько ниже критической.
- •Предпосылки
- •Принцип действия
- •I. Тепловое излучение тел:
- •II. "Ультрафиолетовая катастрофа":
- •1) Наблюдение фотоэффекта:
- •2) Изучение фотоэффекта:
- •2. Для каждого вещества существует так называемая красная граница фотоэффекта, т. Е. Наименьшая частота νmin, при которой еще возможен внешний фотоэффект.
- •3. Число фотоэлектронов, вырываемых светом из катода за 1 с, прямо пропорционально интенсивности света.
- •IV. Фотоны.
- •V. Корпускулярно-волновой дуализм:
- •VI. Применение фотоэффекта:
- •1. Вакуумные фотоэлементы:
- •2. Полупроводниковые фотоэлементы:
- •Физика атома и атомного ядра
- •I. Строение атома:
- •1. Электронная модель - Модель Лоренца:
- •III. Модель атома водорода по Бору.
- •IV. Опыты Франка и Герца.
- •V. Лазеры
- •Физика атома и атомного ядра
- •I. Строение атома:
- •III. Модель атома водорода по Бору.
- •IV. Опыты Франка и Герца.
III. Закон радиоактивного распада.
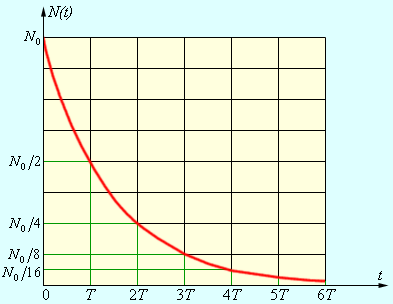
Закон радиоактивного распада установил Ф.Содди. Опытным путем Э.Резерфорд установил, что активность радиоактивного распада убывает с течением времени. Для каждого вещества существует интервал времени, на протяжении которого активность убывает в 2 раза, т.е. период полураспада (Т) вещества.
В любом образце радиоактивного вещества содержится огромное число радиоактивных атомов. Так как радиоактивный распад имеет случайный характер и не зависит от внешних условий, то закон убывания количества N(t) не распавшихся к данному моменту времени t ядер может служить важной статистической характеристикой процесса радиоактивного распада.
Пусть за малый промежуток времени Δt количество не распавшихся ядер N(t) изменилось на ΔN < 0. Так как вероятность распада каждого ядра неизменна во времени, что число распадов будет пропорционально количеству ядер N(t) и промежутку времени Δt: ΔN = –λN(t)Δt
Коэффициент
пропорциональности λ
– это вероятность распада ядра за время
Δt = 1 с.
Эта формула означает, что скорость![]() изменения функции N(t)
прямо пропорциональна самой функции
изменения функции N(t)
прямо пропорциональна самой функции
![]() .
Подобная зависимость возникает во
многих физических задачах (например,
при разряде конденсатора через резистор).
Решение этого уравнения приводит
к экспоненциальному закону: N(t) = N0e–λt
.
Подобная зависимость возникает во
многих физических задачах (например,
при разряде конденсатора через резистор).
Решение этого уравнения приводит
к экспоненциальному закону: N(t) = N0e–λt
где N0 – начальное число радиоактивных ядер при t = 0. За время τ = 1 / λ количество нераспавшихся ядер уменьшится в e ≈ 2,7 раза. Величину τ называют средним временем жизни радиоактивного ядра.
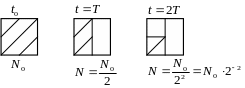
Для практического использования закон радиоактивного распада удобно записать в другом виде, используя в качестве основания число 2, а не e: N(t) = N0 · 2–t/T.
Величина
T
называется
периодом
полураспада
–
время, за которое распадается половина
первоначального количества радиоактивных
ядер.
Величины T
и τ связаны соотношением:![]()
Иллюстрация закона радиоактивного распада:
![]()
![]()
![]()
Период полураспада – основная величина, характеризующая скорость радиоактивного распада.
Так, для урана T ≈ 4,5 млрд лет, а для радия T ≈ 1600 лет => активность радия значительно выше, чем урана =>
Чем меньше период полураспада, тем интенсивнее протекает распад.
Существуют радиоактивные элементы с периодом полураспада в доли секунды.
При α- и β-радиоактивном распаде дочернее ядро также может оказаться нестабильным. Поэтому возможны серии последовательных радиоактивных распадов, которые заканчиваются образованием стабильных ядер. В природе существует несколько таких серий.
С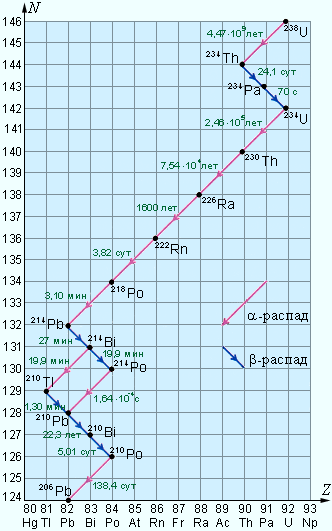 хема
распада радиоактивной серии
хема
распада радиоактивной серии![]() :
(указаны
периоды полураспада)
:
(указаны
периоды полураспада)
Наиболее
длинной является серия
состоящая из 14 последовательных распадов
(8α -распадов и 6β бета-распадов). Эта
серия заканчивается стабильным изотопом
свинца![]() .
.
![]()
В
природе существуют еще несколько
радиоактивных серий, аналогичных серии
.
Известна также серия, которая начинается
с нептуния![]() не обнаруженного в естественных условиях,
и заканчивается на висмуте
не обнаруженного в естественных условиях,
и заканчивается на висмуте![]() Эта серия радиоактивных распадов
возникает в ядерных
реакторах.
Эта серия радиоактивных распадов
возникает в ядерных
реакторах.
Радиоуглеродный анализ (1950 г. Либби): метод датирования (определения возраста) археологических и геологических находок по концентрации остатка не распавшихся радиоактивных изотопов.
Нестабильный
изотоп углерода
![]() возникает в атмосфере вследствие ядерных
реакций, вызываемых космическими лучами.
Небольшой процент этого изотопа
содержится в воздухе наряду с обычным
стабильным изотопом
.
Растения и другие организмы потребляют
углерод из воздуха, и в них накапливаются
оба изотопа в той же пропорции, как и в
воздухе. После гибели растений они
перестают потреблять углерод и
нестабильный изотоп в результате
β-распада постепенно превращается в
азот
возникает в атмосфере вследствие ядерных
реакций, вызываемых космическими лучами.
Небольшой процент этого изотопа
содержится в воздухе наряду с обычным
стабильным изотопом
.
Растения и другие организмы потребляют
углерод из воздуха, и в них накапливаются
оба изотопа в той же пропорции, как и в
воздухе. После гибели растений они
перестают потреблять углерод и
нестабильный изотоп в результате
β-распада постепенно превращается в
азот
![]() с
периодом полураспада 5730 лет. Путем
точного измерения относительной
концентрации радиоактивного углерода
в останках древних организмов можно
определить время их гибели.
с
периодом полураспада 5730 лет. Путем
точного измерения относительной
концентрации радиоактивного углерода
в останках древних организмов можно
определить время их гибели.
Урок 55/3. Лабораторная работа № 5 «Изучение треков заряженных частиц по
готовым фотографиям. ПЕРЕДЕЛАТЬ!!!!
P.S. Перед л/р просмотр видеофрагмента «Невидимые лучи» кинофильма «Операция гелий».
Цель: Изучить треки заряженных частиц по фотографиям и объяснить характер их
движения.
Оборудование: фотографии треков заряженных частиц, полученные в камере
Вильсона, пузырьковой камере и в слое фотоэмульсии.
Теоретическое обоснование: (Уровень «А» - на оценку «4»):
Мы знаем, что с помощью треков заряженных частиц можно получить их характеристики: 1) чем длиннее трек, тем большей энергией обладала частица;
чем больше капелек воды в треке, тем с большей скоростью двигалась частица;
чем шире трек, тем больше заряд частицы.
(Уровень «Б» - на оценку «5»):
Траектория движение α+-частиц в магнитном поле искривяется под действие силы Лоренца, направление которой можно определить по правилу левой руки и определить радиус кривизны траектории, если учесть, что скорость α+-частиц
п ри
движении по дуге окружности направлена
по касательной к траектории, а частица
получает центростремительное ускорение:
ри
движении по дуге окружности направлена
по касательной к траектории, а частица
получает центростремительное ускорение:
![]()
по II
закону Ньютона:
![]()
Ход работы:
1) По фотографиям на рис. 156-158 определить, где изображены траектории
движения заряженных частиц и почему.
2) Сравнить длины треков и выяснить:
а) направление движения;
б) значения энергии;
в) скоростей движения частиц.
3) По фотографии треков α+-частиц в камере Вильсона в магнитном поле на рис.157
определить:
а) как меняется радиус кривизны трека и его толщина, почему и о чем это
свидетельствует;
б) направление движения частиц;
----------------------------------------------------------------------------------------------------------
(Уровень «Б» - на оценку «5»):
в) охарактеризовать движение α+-частицы в магнитном поле, определить
направление силы Лоренца и вывести формулу радиуса кривизны траектории.
P.S. выполняется в теоретическом обосновании.
----------------------------------------------------------------------------------------------------------
3) По фотографии трека электрона в пузырьковой камере в магнитном поле на рис.158:
а) объяснить форму траектории;
б) определить направление;
в) сравнить длины треков электрона и α+-частицы, и объяснить этот факт.
Вывод: Изучили треки заряженных частиц по фотографиям и научились выяснять
характеристики частиц (m, q, v, E) по виду треков.
IV. Изотопы (изос – одинаковый, топос – место) – это химические элементы,
имеющие одинаковый порядковый номер (заряд ядра) => обладают одинаковыми химическими свойствами, но разное массовое число (а.м.) => обладают разной радиоактивностью.
Изотопы отличаются друг от друга числом нейтронов в ядре.
Существование изотопов предсказал в 1911 г. Содди, в 1912 г. Томсон подтвердил, что каждый химический элемент имеет изотопы.
Например:
![]() - изотопы;
- изотопы;
![]() - обычный водород;
- обычный водород;
![]() - тяжелый водород
- тяжелый водород
(![]() - дейтерий (стабилен));
- дейтерий (стабилен));
![]() - сверхтяжелый
водород
- сверхтяжелый
водород
(![]() - тритий (радиоактивен)).
- тритий (радиоактивен)).
У
большинства химических элементов
имеется несколько изотопов.
Например:
у водорода три изотопа:
![]() –
обычный водород,
–
обычный водород,
![]() –
дейтерий и
–
дейтерий и
![]() –
тритий. У углерода
– 6 изотопов, у кислорода – 3.
–
тритий. У углерода
– 6 изотопов, у кислорода – 3.
Химические элементы в природных условиях обычно представляют собой смесь изотопов. Присутствие изотопов определяет значение атомной массы природного элемента в периодической таблице Менделеева. Так, например, относительная атомная масса природного углерода равна 12,011.
Состав атомных ядер.
