
- •Часть 2: жидкости и процессы в них
- •Часть 3: твердые тела и процессы в них
- •Часть 2: жидкости и процессы в них
- •2.1. Определение вязкости по методу Стокса.
- •2.2. Определение вязкости с помощью капиллярного визкозиметра.
- •3.Установка и порядок работы.
- •3.1. Определение вязкости по методу Стокса.
- •Порядок выполнения работы:
- •3.2. Определение вязкости с помощью капиллярного вискозиметра.
- •Порядок выполнения работы:
- •4. Контрольные вопросы.
- •Лабораторная работа 2-2
- •Цель работы
- •2. Теоретические пояснения
- •2.1. Поверхностное натяжение
- •2.2. Краевые углы. Условия равновесия на границе жидкости и твердого тела
- •2.3. Формула Лапласа.
- •2.4. Капиллярные явления.
- •3. Определение коэффициента поверхностного натяжения жидкости методом отрыва кольца.
- •4. Определение коэффициента поверхностного натяжения жидкости методом компенсации разности давлений в капилляре.
- •5. Порядок выполнения работы.
- •5.1. Определение σ по методу отрыва кольца.
- •5.2. Определение σ капиллярным методом.
- •6. Контрольные вопросы.
- •Лабораторная работа 2-3 определение фазовых переходов химически однородных веществ
- •Цель работы
- •2. Теоретические пояснения
- •2.1. Фаза. Фазовые превращения. Условие фазового равновесия.
- •2.2. Фазовые переходы первого и второго рода.
- •2.3. Диаграмма состояния с тройной точкой.
- •3. Методика выполнения работы и описание установки.
- •3.2. Методика выполнения работы.
- •4. Порядок выполнения работы.
- •4.2. Нахождение точки фазового перехода исследуемого вещества.
- •5. Контрольные вопросы.
- •Часть 3: твердые тела и процессы в них
- •Лабораторная работа 3-1
- •Измерение коэффициента теплопроводности
- •Твердого тела
- •Цель работы
- •2. Теоретические пояснения.
- •3. Экспериментальная установка.
- •4. Порядок выполнения работы.
- •5. Контрольные вопросы.
- •Лабораторная работа 3-2 определение коэффициента линейного расширения твердого тела
- •Цель работы
- •2. Теоретические пояснения
- •3. Методика выполнения работы
- •4. Описание установки
- •5. Порядок выполнения работы
- •6. Контрольные вопросы
- •Список литературы
6. Контрольные вопросы.
1. Суть явления поверхностного натяжения. Определение коэффициента поверхностного натяжения.
2. Краевые углы. Смачивание и несмачивание.
3. Определить дополнительное давление Лапласа для цилиндрической поверхности жидкости.
4. Определить дополнительное давление Лапласа сферической поверхности жидкости.
5. Капиллярные явления. Опустится или поднимется уровень жидкости в капилляре, если жидкость:
а) не смачивает капилляр,
б) смачивает капилляр?
Почему?
Лабораторная работа 2-3 определение фазовых переходов химически однородных веществ
Цель работы
Определение точки фазового перехода при плавлении и кристаллизации твердого химического вещества (высшие предельные углеводороды – пальмитиновая кислота).
2. Теоретические пояснения
2.1. Фаза. Фазовые превращения. Условие фазового равновесия.
Опр. Фазой называется макроскопическая часть вещества, отделенная от остальных частей системы границами раздела, так что она может быть извлечена из системы механическим путём.
Если две или больше различных фаз при данных температуре и давлении существуют одновременно, соприкасаясь друг с другом, и если при этом масса одной из фаз не растет за счет другой, то говорят о фазовом равновесии. Переход вещества из одного состояния в другое называется фазовым переходом, или фазовым превращением.
Примером фазовых превращений могут служить изменения агрегатного состояния вещества. Под агрегатными состояниями понимают твердое, жидкое и газообразное состояния вещества. Твердое и жидкое состояния называют конденсированными. Испарением называют переход вещества из конденсированного состояния в газообразное. Обратный переход называется конденсацией. Переход из твердого состояния непосредственно в газообразное называется сублимацией или возгонкой. Переход из твердого состояния в жидкое называется плавлением, а обратный переход из жидкого состояния в твердое - кристаллизацией.
Для описания системы вводятся следующие функции состояния: энтропия S, свободная энергия Гельмголъца ψ и термодинамический потенциал Гиббса Ф.
Опр. Разность энтропий в двух равновесных состояниях 2 и 1 равна приведенному количеству тепла, которое надо сообщить системе, чтобы перевести ее из состояния 1 в состояние 2 по любому квазистатическому пути.
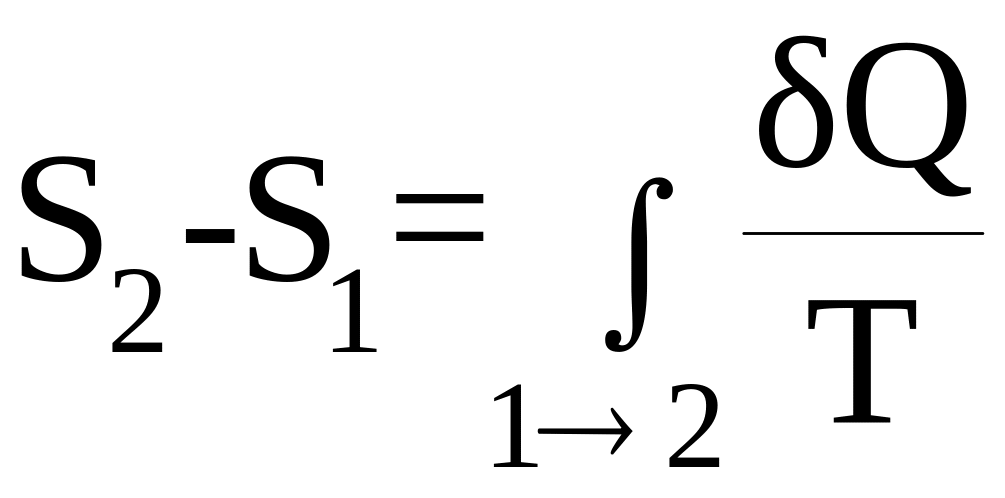 (1)
(1)
Свободная энергия Гельмголъца:
Ψ = U - TS (2)
Термодинамический потенциал Гиббса:
Ф = ψ + РV = U – TS + РV (3)
Для их дифференциалов легко получить:
dψ = -SdT – PdV
dФ = -SdT+VdР (4)
Пусть
имеется система из
двух
фаз
1 и 2 химически однородного вещества.
Обозначим через
![]() и
и
![]() удельные
термодинамические потенциалы вещества
в этих фазах. Условием
равновесия фаз является равенство их
удельных термодинамических потенциалов:
удельные
термодинамические потенциалы вещества
в этих фазах. Условием
равновесия фаз является равенство их
удельных термодинамических потенциалов:
![]() (5)
или
(5)
или
![]()
Смысл условия (5) состоит в том, что при любых фазовых превращениях величина удельного термодинамического потенциала остаётся неизменной. Таким образом, при всех изменениях состояния вещества его удельный термодинамический потенциал всегда изменяется непрерывно.
