
- •295 Основнi уявлення квантової механiки розділ 9. Елементи квантової механiки
- •Основнi уявлення квантової механiки
- •9.1.1. Мiсце квантової механiки в системi наук про рух тiл
- •9.1.2. Гiпотеза де Бройля
- •9.1.3. Спiввiдношення невизначеностей Гейзенберга
- •9.1.4. Основне рiвняння квантової механiки – рiвняння Шредiнгера
- •Знайдемо відповідні частиннi похiднi, а саме:
- •9.1.5. Рiвняння Шредiнгера для атома водню
- •9.1.6. Багатоелектроннi атоми
- •Випромiнювання та поглинання енергiї атомами та молекулами
- •9.2.1. Атомнi спектри
- •9.2.2. Молекулярні спектри
- •Люмiнесценцiя
- •9.3.1. Види люмінесценції
- •9.3.2. Фотолюмiнесценцiя, закон Стокса
- •9.3.3. Механізми люмінесценції
- •Індуковане випромінювання
- •9.4.1. Рівноважна та інверсна заселеність
- •9.4.2. Будова та принцип дiї лазера
- •Електронний парамагнiтний резонанс, ядерний магнiтний резонанс та їх медико-бiологiчнi застосування
- •9.5.1. Метод електронного парамагнiтного резонансу
- •9.5.2. Метод спiнових мiток (спiнових зондiв)
- •9.5.3. Спiн-iмунологiчний метод
- •9.5.4. Метод ядерного магнiтного резонансу
- •Практикум з квантової механіки
- •9.6.1. Практичне заняття “Основні уявлення квантової механіки”
- •Теоретичнi питання, що розглядаються на практичному занятті
- •Додаткова лiтература для пiдготовки до практичого заняття
- •Завдання для самостiйної роботи I самоконтролю
- •Типовi задачi з еталонами розв’язкiв
- •1. Хвильовi властивостi частинок. Формула де Бройля.
- •Розрахуємо довжину хвилi де Бойля для електрона
- •2. Електронний мiкроскоп, його межа розрiзнення.
- •3. Спiввiдношення невизначеностей Гейзенберга.
- •4. Квантовi числа, їх фiзичний змiст
- •5. Атомнi спектри
- •Завдання для перевiрки кiнцевого рiвня знань
- •Порядок виконання
- •Порядок виконання:
- •Контрольні питання
9.1.5. Рiвняння Шредiнгера для атома водню
Потенцiальна енергiя системи електрон-ядро в атомі водню має вигляд кулонівської потенціальної енергії
![]() .
.
З врахуванням цього виразу запишемо рiвняння Шредiнгера для найпростiшої атомної системи – атома водню:
![]() (9.14)
(9.14)
Фiзичний змiст 2 накладає на -функцiю вимоги скiнченностi, однозначностi та неперервностi. Рiвняння Шредiнгера для атома водню має розв’язок, що задовольняє вище перерахованим вимогам: при Е > 0 -функцiя описує стан електрона, що є вільним і вже не належить даному атому, а при Е < 0 -функція описує стан електрона всерединi атома. В останньому випадку повна енергiя системи дорiвнює:
![]() .
.
Хвильова функцiя, що є розв’язком рiвняння Шредiнгера, містить в собі три цiлочисельнi параметри, якi називаються квантовими числами.
Головне квантове число n, що характеризує енергiю електрона i розмiри його орбiталi (розмiри електронної хмари), може приймати значення:
![]()
де К, L, M, N – позначення вiдповiдних енергетичних рiвнiв.
Орбiтальне квантове число l, характеризує величину моменту кiлькостi руху, тобто характеризує форму орбiталi:
![]()
де l може набувати значення
![]()
Вiдповiднi форми орбiталей наведенi на мал. 9.4.
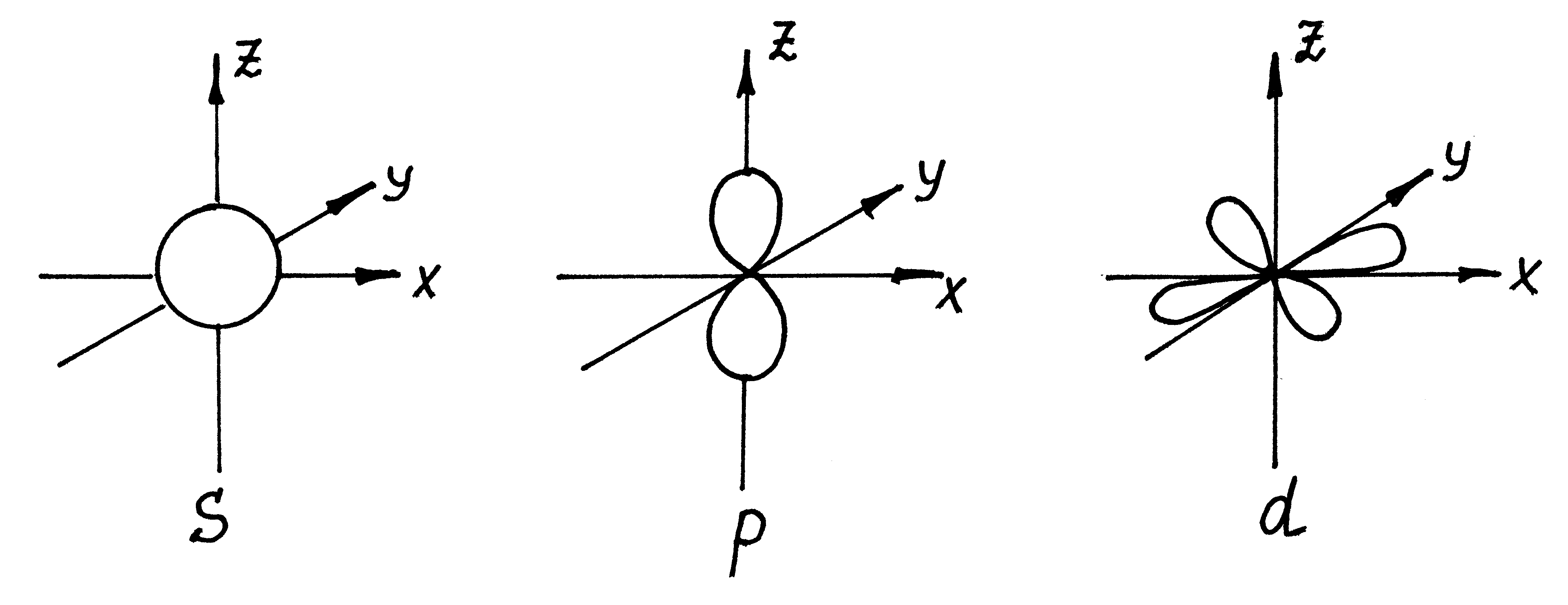
Мал. 9.4. Різні форми електронних орбіталей.
При наявностi зовнiшнього магнiтного поля можливi лише певнi орiєнтацiї вектора момента кiлькостi руху L (мал. 9.5) до напрямку зовнiшнього поля, а саме лише тi, для яких проекцiя L на напрям поля дорiвнює:
![]()
де
ml =
![]() .
.
М
Мал.
9.5.
Можливі орієнтації вектора
моменту кількості руху відносно напрямку
зовнішнього поля.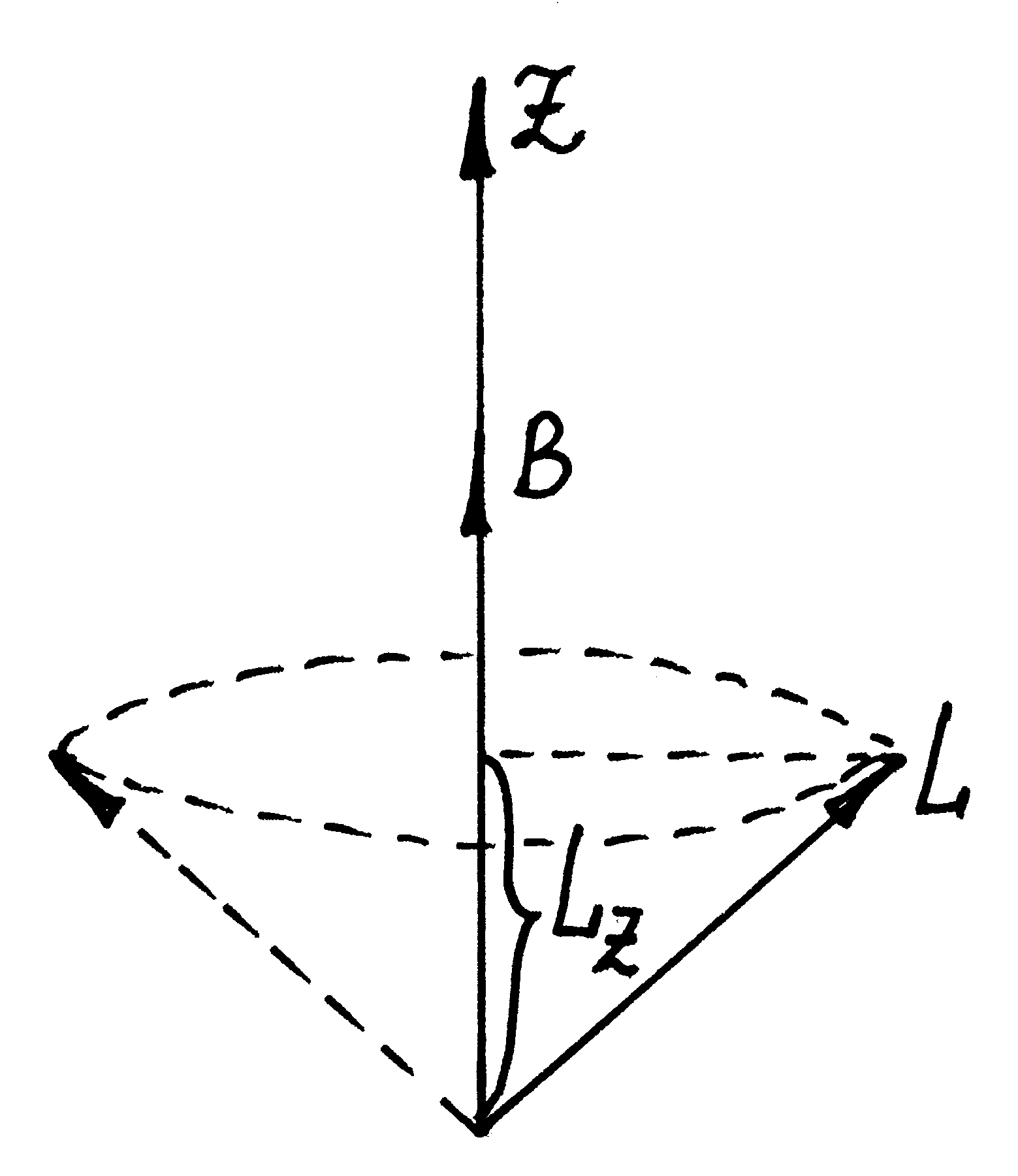
![]()
де S – спiнове квантове число, для електрона S = 1/2.
При наявностi зовнiшнього магнітного поля В проекцiя LsZ на його напрямок може набувати значення:
![]()
де mS = +1/2, –1/2. Таким чином, магнiтне спiнове число mS визначає проекцiю LSZ на напрямок магнітного поля.
9.1.6. Багатоелектроннi атоми
Одержати точний розв’язок рiвняння Шредiнгера для багатоелектронної системи неможливо. Складнiсть задачi полягає в тому, що електрон рухається не тільки в силовому полi ядра, але й в полi iнших електронiв. I все ж розподiл електронiв по орбiталях багатоелектронного атома може бути достатньо добре описаний в припущеннi, що цi орбiталi подiбнi до орбiталей атома водню. При цьому розподiл електронiв атому по орбiталях пiдпорядкований фундаментальному принципу Паулі. Цей принцип полягає в тому, що в атомi не може бути двох чи бiльше електронiв з чотирма однаковими квантовими числами n, l, ml і mS. Згiдно з ще одним важливим принципом – принципом найменшої енергiї – електрон, що пiд’єднується до атома, посiдає в ньому вiльний рiвень з найменшою енергiєю. Обидвi вказанi фундаментальнi умови складають принцип будови електронних конфiгурацiй атомiв і молекул, тобто розподiл електронiв по їх орбiталях.
Слiд пiдкреслити, що на вiдмiну вiд атома з одним електроном (атома водню) енергiя електрона в багатоелектронному атомi залежить вiд двох квантових чисел – n та l. Тому при даному значеннi n енергiя електронiв змiнюється при змiнi квантового числа l. Сукупнiсть електронiв з даним значенням n в багатоелектронному атомi називають шаром i позначається певним символом, вiдповідно до значення n:
![]()
Всерединi шару електрони розподiляються на пiдрiвнi, вiдповiдно до значення квантового числа l.
Щоб побудувати електронну конфiгурацiю багатоелектронного атома необхiдно визначити, яка кiлькiсть електронiв може знаходитись в одному шарi, на пiдрiвнi, на атомнiй орбiталi.
В одному шарi (n):
l =
![]() .
.
Одному
пiдрiвню (l) вiдповiдає (2l + 1) орбiталь
![]()
(ml
=
![]() ).
).
На однiй орбiталi (n, l, ml) – 2 електрона (ms = +1/2, –1/2).
Таким чином, на одному пiдрiвнi може знаходитись (2l + 1)2 електронiв, а в одному шарi кiлькiсть електронiв становить:
![]() .
.
У наведенiй нижче таблицi вказано максимальну кiлькiсть електронiв, що може знаходитись на рiзних пiдiвнях та шарах атомiв.
Шар |
Кiлькiсть електронiв |
Підрiвень |
Кiлькість електронiв |
K L M |
2 8 18 |
s p d |
2 6 10 |
Як приклад, електронна конфiгурацiя атома Na виглядає так:
![]() .
.
