
- •І.С.Боровик Аналітична хімія Збірник задач
- •Передмова
- •І. Теоретичні основи аналітичної хімії
- •1.1. Обчислення еквівалента, фактора еквівалентності, молярної маси речовини еквівалента
- •Розв’язування:
- •1.2. Способи вираження концентрації розчину
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Обчислення концентрації іонів водню та рН розчинів сильних кислот і основ
- •Розвязування:
- •Розвязування:
- •Обчислення концентрацій іонів водню та рН розчинів слабких кислот і основ
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Обчислення можливості випадання осаду
- •Алгоритм обчислення можливості випадання осаду:
- •Розв’язування:
- •Обчислення добутку розчинності та розчинності малорозчинних сполук
- •Алгоритм обчислення добутку розчинності
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Обчислення послідовності утворення осадів малорозчинних сполук
- •Розв’язок:
- •Задачі для розв’язування
- •Відповіді на задачі
- •Іі. Кількісний аналіз
- •2.1. Розрахунки у ваговому (гравіметричному) аналізі
- •2.1.1. Обчислення наважки досліджуваної речовини
- •СаСо3 СаСі2 СаС2о4 СаО
- •СаСо3 СаСі2 СаС2о4∙ н2о СаО Розв’язування:
- •Розв’язування:
- •2.1.2. Обчислення масової частки компоненту в досліджуваному зразку
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •2.1.3. Обчислення масової частки гігроскопічної вологи
- •Розв’язування:
- •Розв’язування:
- •Задачі для розв’язування
- •Відповіді на задачі
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Задачі для розв’язування
- •Відповіді на задачі
- •Література
Обчислення концентрацій іонів водню та рН розчинів слабких кислот і основ
Памятайте!
Слабкі електроліти (кислоти, основи) частково дисоціюють на іони у розчинах будь-яких концентрацій;
Концентрацію іонів водню в розчині слабкої одноосновної кислоти ообчислюють:
![]() ,
де
,
де
Ккисл – констаната дисоціації слабкої кислоти;
Скисл – концентрація слабкої кислоти.
рН розчину слабкої одноосновної кислоти можна обчислити:
![]() ,
де
,
де
рКкисл = ‑ lgKкисл
рСкисл = ‑lgCкисл
Концентрацію іонів водню в розчині слабкої основи обчислюють:
![]() ;
;
рН розчину слабкої основи обчислюють:
рН = 14 – рОН, де
[OH-]
=
![]() ;
рОН = ‑ lg[OH-].
;
рОН = ‑ lg[OH-].
Концентрацію іонів водню в розчині слабкої одноосновної кислоти у присутності солі цієї кислоти можна обчислити:
![]() ;
;
Водневий показник для буферної суміші слабкої кислоти з її сіллю має вигляд:
![]() або
або
![]()
Задача №7
Обчислити рН в 0,1М розчині боратної (ІІІ) кислоти, враховуючи лише першу стадію електролітичної дисоціації, Н3ВО3. Константа дисоціації Н3ВО3 дорівноє 5,75∙10-10.
Дано:
См(Н3ВО3)= 0,1моль/л
К1дис(Н3ВО3) = 5,75∙ 10-10
Обчислити:
рН ‑ ?
Розв’язування:
Н3ВО3 – слабка кислота, яка дисоціює за першою стадією: Н3ВО3 ↔ Н+ + Н2ВО3-
Обчислимо концентрацію іонів водню за формулою:
![]()
рН = -lg[H+] ; pH = -lg7,6 ∙ 10-6 = 5,12
Відповідь: рН = 5,12; кисле середовище.
Задача №8
Обчислити рН у 0,01М водному розчині амоніаку (NH3 ∙Н2О).
Дано:
С(NH3∙Н2О) = 0,01моль/л
Обчислити:
рН ‑ ?
Розв’язування:
З довідника необхідно взяти значення константи дисоціації амоній гідроксиду(NH3∙ Н2О): Кдис( NH3∙ Н2О) = 1,76 ∙ 10-5.
Рівняння дисоціації амоній гідроксиду:
NH4OH ↔ NH4+ + OH-
[OH-]
=
![]() ;
;
Враховуючи іонний добуток води, одержимо
![]() Обчислимо
рН розчину слабкої основи:
Обчислимо
рН розчину слабкої основи:
рН = ‑ lg[H+] = ‑ lg 2,4∙ 10-11 = 10,38
Відповідь: рН = 10,38, лужне середовище.
Задача №9
Обчислити концентрацію іонів водню та рН розчину, в 1л якого міститься 0,03моль СН3СООН і 0,01моль СН3СООNa (Кдис. оцтової кислоти = 1,74 ∙ 10-5).
Дано:
V (розчину) = 1л
n (СН3СООН) = 0,03моль
n (СН3СООNa) = 0,01моль
Кдис. оцтової кислоти= 1,74 ∙ 10-5
Обчислити:
[H+] = ?
pH = ?
Розв’язування:
Суміш слабкої кислоти СН3СООН з її сіллю СН3СООNа є буферною сумішшю.
Концентрацію іонів водню обчислимо за рівнянням: ;
Після підстановки чисельних значень одержимо:

рН буферної суміші дорівнює:
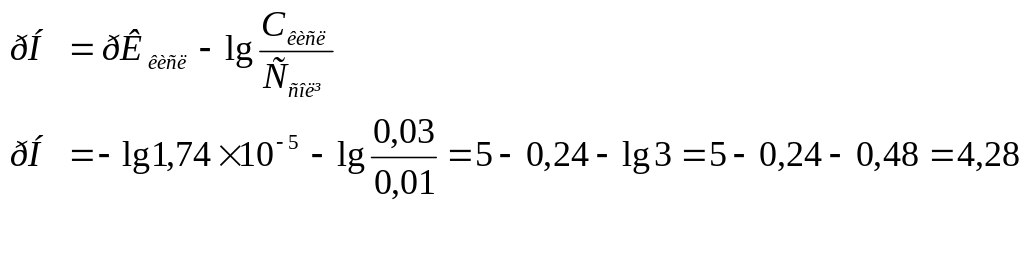 Відповідь:
рН = 4,28 ; [Н+] = 5,22 ∙ 10-5моль/л.
Відповідь:
рН = 4,28 ; [Н+] = 5,22 ∙ 10-5моль/л.
Обчислення можливості випадання осаду
У практиці якісного аналізу, виявляючи іони чи цілі групи іонів, доводиться постійно мати справу з реакціями осадження чи розчинення осадів.
Пам’ятайте!
Напрям реакції обміну між двома електролітами у водному розчині визначається можливістю утворення між іонами малорозчинної сполуки (осаду).
Осад малорозчинного електроліту утворюється, якщо після змішування розчинів реагентів добуток молярних концентрацій речовин катіонів і аніонів буде більшим, ніж ДР осаду: ЙД > ДР осаду.
[А+]а·[В-]b > ДР(АаВb) – утворення осаду (пересичений розчин, переважає процес осадження, процес розчинення термодинамічно неможливий). При невеликому перевищенні ДР розчин стає пересиченим, але осад деякий час не випадає.
[А+]а·[В-]b = ДР(АаВb) – осад не випадає (насичений розчин, динамічна рівновага).
[А+]а·[В-]b < ДР(АаВb) – розчинення осаду (ненасичений розчин).
Осадження можна вважати практично повним, якщо в розчині залишається така кількість речовини осаджуваних іонів, яка не заважає в подальших операціях розділення і виявлення іонів. (ДР ≠ 0, осадження ніколи не буває повним).
Для більш повного осадження до розчину додають надлишок реагенту – осаджувача, проте дуже великий надлишок осаджувача викликає розчинення осаду (сольовий ефект).
Добуток розчинності (ДР) – добуток концентрацій іонів малорозчинного електроліту в його насиченому водному розчині є величиною сталою:
ДР(АаВb) = [А+]а · [В-]b; Одиниці вимірювання: моль/л, моль/дм3.
Якщо електроліти мають однотипну формулу, то чим менше значення добутку розчинності, тим менша розчинність малорозчинного електроліту.
