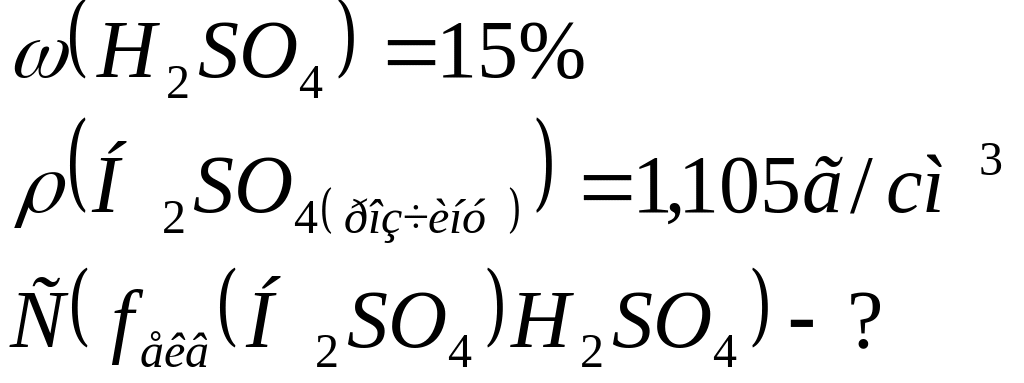- •І.С.Боровик Аналітична хімія Збірник задач
- •Передмова
- •І. Теоретичні основи аналітичної хімії
- •1.1. Обчислення еквівалента, фактора еквівалентності, молярної маси речовини еквівалента
- •Розв’язування:
- •1.2. Способи вираження концентрації розчину
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Обчислення концентрації іонів водню та рН розчинів сильних кислот і основ
- •Розвязування:
- •Розвязування:
- •Обчислення концентрацій іонів водню та рН розчинів слабких кислот і основ
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Обчислення можливості випадання осаду
- •Алгоритм обчислення можливості випадання осаду:
- •Розв’язування:
- •Обчислення добутку розчинності та розчинності малорозчинних сполук
- •Алгоритм обчислення добутку розчинності
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Обчислення послідовності утворення осадів малорозчинних сполук
- •Розв’язок:
- •Задачі для розв’язування
- •Відповіді на задачі
- •Іі. Кількісний аналіз
- •2.1. Розрахунки у ваговому (гравіметричному) аналізі
- •2.1.1. Обчислення наважки досліджуваної речовини
- •СаСо3 СаСі2 СаС2о4 СаО
- •СаСо3 СаСі2 СаС2о4∙ н2о СаО Розв’язування:
- •Розв’язування:
- •2.1.2. Обчислення масової частки компоненту в досліджуваному зразку
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •2.1.3. Обчислення масової частки гігроскопічної вологи
- •Розв’язування:
- •Розв’язування:
- •Задачі для розв’язування
- •Відповіді на задачі
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Задачі для розв’язування
- •Відповіді на задачі
- •Література
Розв’язування:
Кількість речовини еквівалента можна обчислити:
Молярну масу речовини еквівалента кальцій гідроксиду обчислимо за формулою:
![]()
![]() =
=
![]()
![]() ;
(основа, містить дві гідроксогрупи);
;
(основа, містить дві гідроксогрупи);
![]() =
40,08 + 2∙ (15,999 + 1) = 74,08г/моль;
=
40,08 + 2∙ (15,999 + 1) = 74,08г/моль;
=
![]() = 37,04г/моль.
= 37,04г/моль.
Після підстановки чисельних значень обчислимо кількість речовини еквівалента:
![]() =
=
![]() = 0,06196моль
= 0,06196моль
Відповідь: = 0,06196 моль.
1.2. Способи вираження концентрації розчину
Концентрація кількості речовини у розчині (молярна концентрація)
Концентрація
кількості речовини (молярна концентрація
речовини) у розчині – це відношення
кількості речовини
![]() у розчині до об’єму цього розчину.
у розчині до об’єму цього розчину.
Форма
запису:
![]() ,
,
![]() ,
М (молярність);
,
М (молярність);
Одиниці вимірювання: моль/л, моль/дм3.
Обчислити кількість речовини у розчині (молярну концентрацію) можна за формулою:
![]() , де
, де
V![]() = 1 дм3 = 1 л
= 1 дм3 = 1 л
Запис 0,01М означає, що в 1 л розчину міститься 0,01моль речовини.
Концентрація кількості речовини еквівалента
Концентрація
кількості речовини еквівалента (молярна
концентрація речовини еквівалента) у
розчині – це відношення кількості
речовини еквівалента (![]() )
у розчині до об’єму цього розчину.
)
у розчині до об’єму цього розчину.
Форма
запису:
![]() ,
,
![]() ,
Н, N (нормальність);
,
Н, N (нормальність);
Одиниці вимірювання: моль/л, моль/дм3.
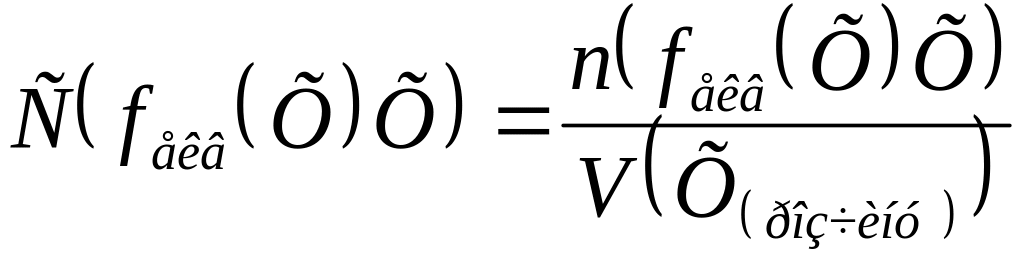 ,
де
,
де
V = 1 дм3 = 1 л
Запис 0,01Н означає, що в 1л розчину міститься 0,01моль речовини еквівалента.
Пам’ятайте!
Нормальний розчин речовини Х – це розчин, що має молярну концентрацію речовини еквівалента ‑ , рівну 1моль/дм3, тобто 1моль/л (
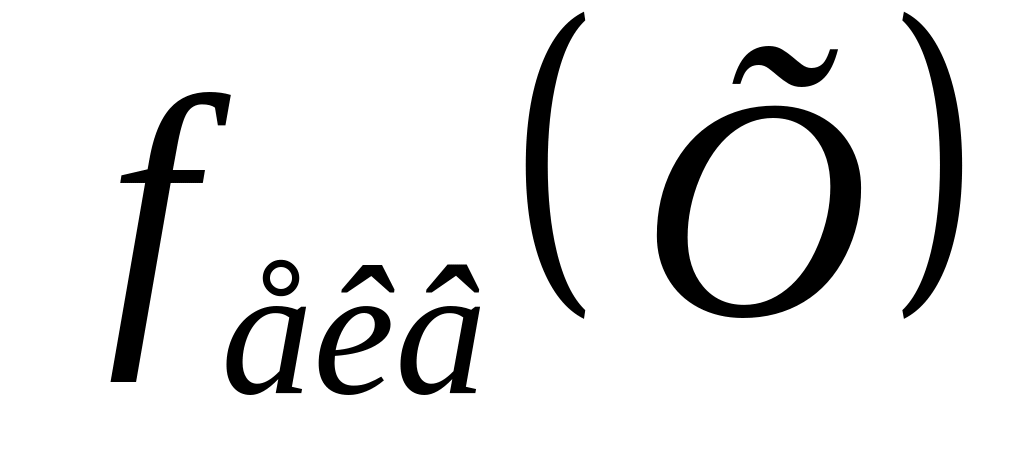 ‑ фактор еквівалентності речовини
Х в реакції.
‑ фактор еквівалентності речовини
Х в реакції.
Наприклад, С(1/5 КМnО4) = 0,1моль/л.
Розчин з = 1моль/дм3 називається однонормальним розчином речовини Х, тобто розчин, що містить 1моль речовини еквівалента
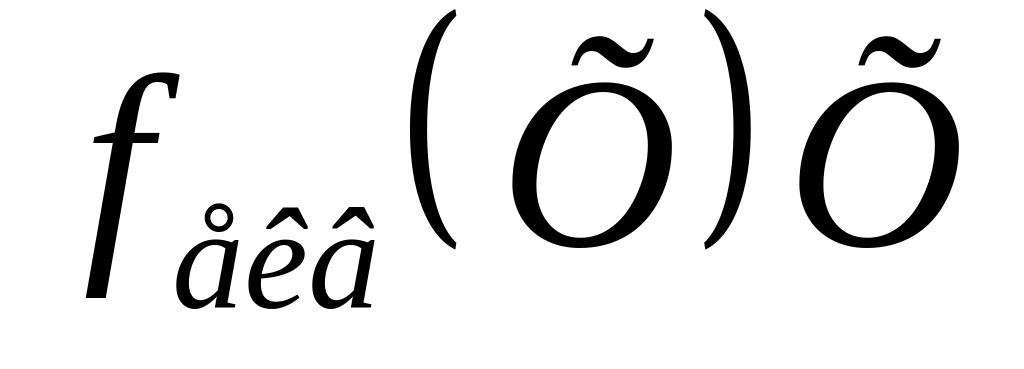 в
1дм3.
в
1дм3.
Якщо =1, то використовувати термін „нормальний” розчин не рекомендується. Тоді слід користуватися терміном „молярний” розчин.
Використання розчинів з нормальною концентрацією на практиці чи поняття „нормальний” розчин в розрахунках обов’язково вимагає знань рівнянь відповідних реакцій.
Зв’язок між молярною концентрацією речовини Х у розчині та молярною концентрацією речовини еквівалента Х у розчині:
![]()
Молярна концентрація речовини Х у розчині дорівнює нормальній концентрації речовини Х у розчині, помноженій на фактор еквівалентності речовини Х:
=
![]()
Звідси,
![]() ,
або
,
або ![]()
Масова частка речовини у розчині
Масова частка речовини у розчині – це маса речовини Х, що міститься в 100г розчину, дорівнює відношенню маси розчиненої речовини до загальної маси розчину.
Форма запису: ω(Х), одиниці вимірювання: долі одиниці, відсотки.
Масову частку речовини у розчині обчислюють за формулою:
![]() ,
де
,
де
![]() ‑ маса
розчиненої речовини, в г;
‑ маса
розчиненої речовини, в г;
![]() ‑ маса
розчину, в г.
‑ маса
розчину, в г.
Задача № 2
Обчислити молярну концентрацію речовини НСI у розчині хлоридної кислоти з масовою часткою речовини НСІ 20,00%, якщо густина розчину дорівнює 1,100г/см3?
Дано:
![]()
ρ(розчину) = 1,100г/см3
Обчислити:
С(НСІ) ‑ ?
Розв’язування:
Обчислимо масу 1л (дм3) хлоридної кислоти:
![]()
Обчислимо масу безводної речовини НСІ в 1 дм3 цього розчину:
![]()
Молярна концентрація речовини НСІ у розчині дорівнює:
![]()
Відповідь: С(НСІ) = 6моль/л.
Приклад №3
Обчислити молярну концентрацію речовини еквівалента Н2SО4 у розчині, якщо густина розчину сульфатної кислоти з масовою часткою Н2SО4 15,00% дорівнює 1,105г/см3.
Дано: