
- •І.С.Боровик Аналітична хімія Збірник задач
- •Передмова
- •І. Теоретичні основи аналітичної хімії
- •1.1. Обчислення еквівалента, фактора еквівалентності, молярної маси речовини еквівалента
- •Розв’язування:
- •1.2. Способи вираження концентрації розчину
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Обчислення концентрації іонів водню та рН розчинів сильних кислот і основ
- •Розвязування:
- •Розвязування:
- •Обчислення концентрацій іонів водню та рН розчинів слабких кислот і основ
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Обчислення можливості випадання осаду
- •Алгоритм обчислення можливості випадання осаду:
- •Розв’язування:
- •Обчислення добутку розчинності та розчинності малорозчинних сполук
- •Алгоритм обчислення добутку розчинності
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Обчислення послідовності утворення осадів малорозчинних сполук
- •Розв’язок:
- •Задачі для розв’язування
- •Відповіді на задачі
- •Іі. Кількісний аналіз
- •2.1. Розрахунки у ваговому (гравіметричному) аналізі
- •2.1.1. Обчислення наважки досліджуваної речовини
- •СаСо3 СаСі2 СаС2о4 СаО
- •СаСо3 СаСі2 СаС2о4∙ н2о СаО Розв’язування:
- •Розв’язування:
- •2.1.2. Обчислення масової частки компоненту в досліджуваному зразку
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •2.1.3. Обчислення масової частки гігроскопічної вологи
- •Розв’язування:
- •Розв’язування:
- •Задачі для розв’язування
- •Відповіді на задачі
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Задачі для розв’язування
- •Відповіді на задачі
- •Література
Розв’язування:
Обчислимо молярну концентрацію речовини еквівалента (нормальну концентрацію) оцтової кислоти у розчині (2) за результатами титрування розчином лугу:
С2(СН3СООН)=![]()
500мл 0,0931Н розчину СН3СООН утворилось при розбавлянні 32мл розчину СН3СООН з концентрацією Х моль/л.
Звідси,
Х=С1(СН3СООН) =
![]()
200мл 1,4547Н розчину СН3СООН утворилось при розбавлянні 20мл розчину СН3СООН з концентрацією Х моль/л.
Звідси,
Х=С(СН3СООН)
=
![]()
Запис С(СН3СООН) = 14,55моль/л означає, що в 1л розчину міститься 14,55 моль СН3СООН.
Звідси,
m(СН3СООН) = n (СН3СООН) ∙ М (СН3СООН) = 14,55моль ∙ 60г/моль = 873г
m(розчину СН3СООН) = ρ∙V(розчину СН3СООН) = =1,07г/мл ∙1000мл = 1070г
Обчислимо масову частку речовини оцтової кислоти в оцтовій есенції.
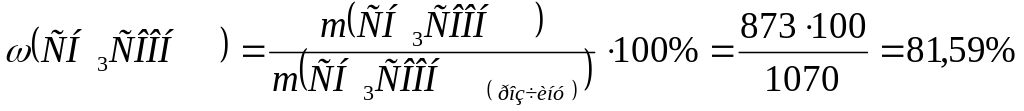
Відповідь: ω(СН3СООН) = 81,59%
Задача №11*
З 20,00г наважки м’якушки хліба приготували 250мл витяжки. На титрування 25мл витяжки витрачено 4,91мл 0,1015Н розчину нітрату срібла. Скільки відсотків кухонної солі міститься у хлібові в перерахунку на суху речовину, якщо вміст вологи в ньому 48%.
Дано:
m(наважки)= 20,00г
V(витяжки) = 250мл
V(аліквотний) = 25мл
V(AgNO3) = 4,91мл
Сн(AgNO3) = 0,1015моль/л
ω(Н2О) = 48%
Обчислити:
ω(NaCI) ‑ ?
Розв’язування:
Якщо для титрування використовують лише певну частину досліджуваного розчину (аліквотний об’єм), то результати титрування обчислюють за формулою:
m(NaCI)=
![]()
=![]()
Вміст води (%) у харчовому продукті розраховують за формулою:
(Н2О)
=
![]()
Звідси,
можна знайти масу
води в наважці хліба:
![]()
та масу сухої речовини:
m(сухої речовини) = 20,00 – 9,6 = 10,4г
Масова частка солі у перерахунку на суху речовину становить:
ω(NaCI)
=![]()
Відповідь: масова частка солі в хлібі в перерахунку на суху речовину складає 2,80%
Задача №12*
На титрування 40см3 води при визначенні загальної твердості води комплексонометричним методом витратили 5,10см3 0,0150 М розчину ЕДТА. Обчислити загальну твердість води в (мг/дм3) карбонату кальцію.
Дано:
V(H2O) = 40см3
V(ЕДТА) = 5,10см3
С(ЕДТА) = 0,0150моль/л
М(СаСО3) = 100,09г/моль
Обчислити:
Твердість(Н2О) ‑
Розв’язування:
Загальну твердість води (сумарний вміст іонів кальцію та магнію) обчислюють за формулою:
Твердість
води =
![]() ,
,
Звідси,
твердість води =
![]() ммоль/дм3
ммоль/дм3
Твердість води на СаСО3 = М(СаСО3) n = 1,9125 ∙ 100,09 = =191,5мг/дм3
Відповідь: твердість води на СаСО3 ‑ 191,5мг/дм3
2.2.4. Обчислення молярної маси речовини еквіваленту окисника і відновника в окислювально-відновних методах
Еквівалент речовини, фактор еквівалентності, молярна маса речовини еквівалента в окислювально-відновних реакціях відрізняються від їх значень в реакціях обміну.
Еквівалент окислювача або відновника – умовна частина речовини, яка в даній окислювально-відновній реакції еквівалентна одному здобутому або втраченому електрону однією молекулою речовини.
Число, що вказує на кількість відданих або приєднаних електронів одним атомом, іоном або молекулою, називається фактором еквівалентності (fекв).
Для обчислення фактора еквівалентності та молярної маси речовини еквівалента необхідно:
написати рівняння окислювально-відновної реакції;
скласти електронний баланс;
по кількості електронів, які були віддані або прийняті однією молекулою або іоном, визначити фактор еквівалентності fекв;
обчислити молярну масу речовини еквівалента окислювача та відновника:
![]()
Приклад №1
Розчинення міді в концентрованій азотній кислоті супроводжується виділенням NO2:
Cu + 4HNO3 Cu(NO3)2 + 2NO2↑ + 2H2O
C u0
– 2e
Cu+2
1
u0
– 2e
Cu+2
1
відновник 2
N+5 + 1e N+4 2
окислювач
Cu0 + 2N+5 Cu+2 + 2N+4
Обчислимо молярні маси речовини еквівалента окислювача (HNO3) та відновника (Cu); знаючи, що fекв(HNO3) = 1, fекв(Cu) = 1/2.
Мекв(HNO3)
=
![]() 63,01г/моль
63,01г/моль
Мекв(Cu)
=
![]() = 31,77г/моль
= 31,77г/моль
При розчиненні міді в розведеній азотній кислоті реакція супроводжується виділенням NO:
3Cu + 8HNO3 3Cu(NO3)2 + 2NO↑ + 4H2O
C u0
– 2e
Cu+2
3 fекв(Cu)=1/2
u0
– 2e
Cu+2
3 fекв(Cu)=1/2
відновник 6
N+5 + 3e N+2 2 fекв(HNO3)=1/3
окислювач
3Cu0 + 2N+5 3Cu+2 + 2N+2
Обчислимо молярні маси речовини еквівалента окислювача (HNO3) та відновника (Cu):
Мекв(HNO3)
=
![]() = 21,00г/моль
= 21,00г/моль
Мекв(Сu) = = 31,77г/моль
2.2.5. Обчислення з використанням титру по визначуваній речовині (складного титру):
Титр по визначуваній речовині (складний титр) показує, яка маса цієї речовини еквівалентна 1мл стандартного розчину.
Запис Т(KМnO4/Na2C2O4)=0,0006701г/мл показує, що 1мл розчину KМnO4 еквівалентний 0,006701г Na2C2O4 або з 1мл розчину KМnO4 взаємодіє 0,006701г Na2C2O4.
Тстандарт.
розчину / визначув. реч. =![]()
Тстандарт.
розч. / визначув. реч.=
![]()
Одиниці вимірювання титру по визначуваній речовині: г/мл.
Задача №13
Титр розчину KМnO4 дорівнює 0,003160г/мл. Визначити Т(KМnO4/FeSO4).
Дано:
Т(KМnO4)=0,003160г/мл
М(FeSO4)=151,91г/моль
М(KМnO4)=158,04г/моль
Обчислити:
Т(KМnO4/FeSO4)-?
Розв’язування:
Хімізм процесу:
10FeSO4 + 2KMnO4+ 8H2SO4 5Fe2(SO4)3 + 2MnSO4 + К2SO4 + 8H2O
2 Fe+2
– 2e
2Fe+3
5 fекв(FeSO4)=1
Fe+2
– 2e
2Fe+3
5 fекв(FeSO4)=1
Mn+7 + 5e Mn+2 2 fекв(KМnO4)=1/5
Мекв(KМnO4)=![]() =31,61г/моль;
=31,61г/моль;
Мекв(FeSO4)=![]() =
=151,91г/моль, тому, що катіон Fe+2,
який входить до складу молекули FeSO4,
в реакції з KМnO4
віддає один електрон.
=
=151,91г/моль, тому, що катіон Fe+2,
який входить до складу молекули FeSO4,
в реакції з KМnO4
віддає один електрон.
Записуємо формулу для розрахунку:
Т(KМnO4/FeSO4)=![]()
Т(KМnO4/FeSO4)=![]() = 0,01519г/мл
= 0,01519г/мл
Відповідь: Т(KМnO4/FeSO4)=0,01519г/моль.
Задача №14
Обчислити титр розчину KМnO4 по Н2С2О4, якщо (молярна концентрація речовини еквівалента) нормальна концентрація розчину KМnO4 дорівнює 0,1моль/л.
Дано:
Сн(KМnO4) = 0,1моль/л
М(Н2С2О4) = 90г/моль
Обчислити:
Т(KМnO4/Н2С2О4) ‑ ?
Розв’язування:
Рівняння хімічної реакції:
5Н2С2О4 + 2KМnO4 + 3H2SO4 10СО2 + 2МnSO4 + K2SO4+8H2O
С 2О42-
‑ 2е
2СО2
5 fекв(Н2С2О4)
= 1/2
2О42-
‑ 2е
2СО2
5 fекв(Н2С2О4)
= 1/2
10
Mn+7 +5е Mn+2 2
Мекв(Н2С2О4)
=
![]() = 45г/моль
= 45г/моль
Т(KМnO4/Н2С2О4)
=![]()
Т(KМnO4/Н2С2О4)
=![]() =
0,0045г/мл
=
0,0045г/мл
Відповідь: Т(KМnO4/Н2С2О4) = 0,0045г/мл
Задача №15
На
титрування 20мл розчину соляної кислоти
з Т = 0,003517 затрачено 21,55мл розчину
гідроксиду натрію. Обчислити: а) ТNаOH
/ HCI; б) ТNаOH;
в) ТNаOH
/
![]()
Дано:
V(NaOH)=21,55мл
V(НСІ)=20,00мл
Т(НСІ) = 0,003517г/мл
Обчислити:
ТNаOH / HCI ‑ ?
ТNаOH ‑ ?
ТNаOH / Н2SO4 ‑ ?
