
- •3.Криволинейное движение.
- •6. Внешние и внутренние силы.
- •7. Связь между импульсом тела и импульсом силы.
- •8. Центр масс. Закон движения центра масс.
- •9. Степени свободы твёрдого тела.
- •10. Момент силы, момент импульса.
- •11.Уравнение динамики тела, вращающегося относительно неподвижной оси
- •12. Момент инерции мат. Точки.
- •13. Теорема Штейнера.
- •14. Работа силы.
- •15. Потенциальная сила и её работа.
- •16. Работа внешних и внутренних сил.
- •17. Кинетическая энергия.
- •18. Потенциальная энергия.
- •19. Законы сохранения в механике и их связь со свойствами пространства и времени.
- •20. Абсолютно упругий удар.
- •21. Абсолютно неупругий удар.
- •22. Гидростатическое давление
- •23. Уравнение неразрывности
- •24. Уравнение Берноули
- •25. Вязкость жидкостей
- •26. Ламинарный и турбулентный режим течения жидкостей.
- •27. Скорость и ускорение мат.Точки при движении относительно неинерциальной системы отсчёта.
- •28. Основное уравнение динамики относительного движения. Силы инерции.
- •29.Преобразования Галилея. Принцип относительности Галилея.
- •30. Постулаты сто.
- •31.Преобразования Лоренца.
- •32. Однородность длин и промежутков времени.
- •33.Пространственно-временной интервал.
- •34. Основное уравнение релятивистской механики.
- •35.Масса и энергия в сто.
- •36. Статистический и термодинамический метод исследования макросистем.
- •37.Термодинамические системы.
- •38. Термодинамические процессы.
- •39. Термодинамические параметры.
- •40. Идеальный газ и его законы.
- •41. Основное уравнение кинетической теории газов.
- •42. Уравнение кинетической теории для давления идеального газа.
- •43. Средняя квадратичная скорость.
- •44. Закон равномерного распределения энергии по степеням свободы
- •45. Классическая теория теплоёмкости идеального газа.
- •46. Распределение Максвелла.
- •47. Барометрическая формула.
- •48. Зависимость концентрации газа от высоты.
- •49. Среднее число столкновений и средняя длина свободного пробега молекул.
- •50. Явление теплопроводности.
- •53.Вакуум и его свойства.
- •54. Способы обмена энергии между системой и внешней средой.
- •55. Первое начало термодинамики.
- •56.Применение первого начала к изопроцессам.
- •58. Политропный процесс.
- •59. Круговой процесс.
- •60. Цикл Карно
- •Смысл формулы Больцмана
47. Барометрическая формула.
Для идеального газа, имеющего постоянную температуру T и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения g одинаково), барометрическая формула имеет следующий вид:
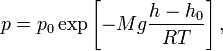
где p — давление газа в слое, расположенном на высоте h, p0 — давление на нулевом уровне (h = h0), M — молярная масса газа, R — газовая постоянная, T — абсолютная температура
Барометрическая формула может быть получена из закона распределения молекул идеального газа по скоростям и координатам в потенциальном силовом поле (см. Статистика Максвелла — Больцмана). При этом должны выполняться два условия: постоянство температуры газа и однородность силового поля. Аналогичные условия могут выполняться и для мельчайших твёрдых частичек, взвешенных в жидкости или газе. Основываясь на этом, французский физик Ж. Перрен в 1908 году применил барометрическую формулу к распределению по высоте частичек эмульсии, что позволило ему непосредственно определить значение постоянной Больцмана.
48. Зависимость концентрации газа от высоты.
Из барометрической формулы следует, что концентрация молекул n (или плотность газа) убывает с высотой по тому же закону:
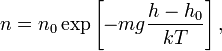
где m — масса молекулы газа, k — постоянная Больцмана.
Барометрическая формула
показывает, что плотность газа уменьшается
с высотой по экспоненциальному закону.
Величина ![]() ,
определяющая быстроту спада плотности,
представляет собой отношение потенциальной
энергии частиц к их средней кинетической
энергии, пропорциональной kT.
Чем выше температура T,
тем медленнее убывает плотность с
высотой. С другой стороны, возрастание
силы тяжести mg (при
неизменной температуре) приводит к
значительно большему уплотнению нижних
слоев и увеличению перепада (градиента)
плотности. Действующая на частицы сила
тяжести mg может
изменяться за счёт двух величин:
ускорения g и
массы частиц m.
,
определяющая быстроту спада плотности,
представляет собой отношение потенциальной
энергии частиц к их средней кинетической
энергии, пропорциональной kT.
Чем выше температура T,
тем медленнее убывает плотность с
высотой. С другой стороны, возрастание
силы тяжести mg (при
неизменной температуре) приводит к
значительно большему уплотнению нижних
слоев и увеличению перепада (градиента)
плотности. Действующая на частицы сила
тяжести mg может
изменяться за счёт двух величин:
ускорения g и
массы частиц m.
Следовательно, в смеси газов, находящейся в поле тяжести, молекулы различной массы по-разному распределяются по высоте.
Реальное распределение давления и плотности воздуха в земной атмосфере не следует барометрической формуле, так как в пределах атмосферы температура и ускорение свободного падения меняются с высотой и географической широтой. Кроме того, атмосферное давление увеличивается с концентрацией в атмосфере паров воды.
49. Среднее число столкновений и средняя длина свободного пробега молекул.
Средние
скорости молекул, газа очень велики -
порядка сотен метров в секунду при
обычных условиях. Для оценки скорости
движения молекул вводится понятие
средней длины свободного пробега. Таким
образом, средняя дли свободного
пробега ![]() -
это среднее расстояние, которое проходит
молекула от столкновения до столкновения.
-
это среднее расстояние, которое проходит
молекула от столкновения до столкновения.
Для
определения
вычислим
сначала среднее число соударений ![]() выбранной
молекулы с другими молекулами за единицу
времени. Движущаяся со средней скоростью
молекула в течении одной секунды
столкнется со всеми молекулами, центры
которых находятся в объеме ограниченном
цилиндром с радиусом 2r и длиной
выбранной
молекулы с другими молекулами за единицу
времени. Движущаяся со средней скоростью
молекула в течении одной секунды
столкнется со всеми молекулами, центры
которых находятся в объеме ограниченном
цилиндром с радиусом 2r и длиной ![]() ,
т.е.
,
т.е.
![]() .
.
Если концентрация молекул n , то внутри рассмотренного цилиндра находится число молекул, равное
![]()
Это число и определяет среднее число соударений за единицу времени.
Предположение
о том, что все молекулы, кроме одной,
неподвижны, является, конечно не верным.
В действительности все молекулы движутся,
и возможность соударения двух частиц
зависит от их относительной скорости.
Поэтому вместо среднеарифметической
скорости
должны
входить средняя относительная скорость
молекул ![]() .
Если скорости молекул распределены по
закону Максвелла, то, как можно показать,
средняя относительная скорость двух
молекул однородного газа в
.
Если скорости молекул распределены по
закону Максвелла, то, как можно показать,
средняя относительная скорость двух
молекул однородного газа в ![]() раз
превышает
.
раз
превышает
.
|
|
Средний
путь, проходимый молекулой за единицу
времени, численно равен
.
Поэтому средняя длина свободного пробега
равна ![]() или
или
|
|
|
