
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Законы — начала термодинамики
- •Внешняя и внутренняя сферы.
- •Комплексообразователь (центральный атом – акцептор), лиганды – доноры электронных пар, координационное число комплексообразователя.
- •Два типа диссоциации комплексов – как ионных солей и по внутренней сфере
- •Понятие о термодинамической прочности (устойчивости) комплексов
- •Значение комплексных соединений в природе, науке и технике
- •Билет №25
- •1.Овр(окислительно-восстановительные реакции)
- •2.Степень окисления.
- •3.Окислители восстановители.
- •4.Эквиваленты и эквивалентные массы окислителей и востановителей.
- •5.Типы окислительно-востановительных реакций.
- •6.Составление ионно-электронных уравнений. Примеры.
- •Билет №26
- •1.Электрохимические процессы.
- •2.Равновесие на границе металл-раствор соли металла.
- •3.Металлический электродный потенциал.
- •4.Электродный потенциал.
- •5.Водородный электрод. (см. Записи в тетр. За 2.12)
- •6.Стандартный электродный потенциал.
- •Билет №27
- •Вопрос 1: Ряд стандартных электродных потенциалов (ряд напряжений) и следствие из него.
- •Вопрос 2: Направление окислительно-восстановительных реакций (овр).
- •Вопрос 3: Стандартные потенциалы для химических окислительно-восстановительных систем. Табличные данные.
- •Гальванические элементы
- •Электрические аккумуляторы
- •Топливные элементы
- •Взаимодействие со щелочными и щёлочноземельными металлами
- •Взаимодействие с оксидами металлов (как правило, d-элементов)
- •Гидрирование органических соединений
- •Классификация
- •35.Водородные соединения галогенов. Получение. Физико- химические свойства. Восстановительные и кислотные свойства растворов галогенводородов.
- •36.Кислородные соединения галогенов. Оксиды хлора, кислородные кислоты галогенов и их соли. Химические свойства. Применение.
- •Билет 37
- •Билет 38
- •Получение
- •Получение
- •Химические свойства
- •Химические свойства
- •Применение
- •Химические свойства
- •Получение и свойства
- •Химические свойства
- •Применение
- •Применение
- •Вопрос 43
- •Вопрос 44
- •Вопрос 45
- •Билет №46
- •Билет №47 Водородные и кислородные соединения фосфора. Фосфин, фосфиды. Оксиды фосфора. Строение молекул. Получение. Свойства.
- •Билет №48
- •Билет №49 Орто - и метафосфорные кислоты и их соли. Фосфорные удобрения. Получение и свойства.
- •Билет № 51
- •Билет № 52
- •Нахождение в природе
- •Марганцовая кислота
- •Свойства элементов VIII b группы.
- •Железо, нахождение в природе
- •Соли железа
- •Физиологические функции:
- •Свойства солей железа
- •Био цинк. Содержит микроэлемент цинк (Zn)
- •Био медь. Содержит микроэлемент медь (Cu)
- •Аллотропия
- •Получение
- •Химические свойства
- •Получение
- •Химические свойства
- •Классификация
- •Получение
- •Химические свойства
- •Классификация
- •Средние соли Получение
- •Химические свойства
4.Электродный потенциал.
Каждая ОВР слагается из полуреакций окисления и восстановления. Когда реакция протекает в гальваническом элементе или осуществляется путем электролиза, то каждая полуреакция протекает на соответствующем электроде; поэтому полуреакции также называют электродными процессами.
Протекающей в гальваническом элементе ОВР соответствует э.д.с. этого элемента E, связанная с изменением энергии Гиббса ∆G реакции уравнением:
∆G= -zFE
В соответствии с разделением ОВР на две полуреакции, электродвижущие силы также принято представлять в виде разности двух величин, каждая из которых отвечает данной полуреакции. Эти величины называются электродными потенциалами.
5.Водородный электрод. (см. Записи в тетр. За 2.12)
Стандартные потенциалы всех электродов принято определять относительно стандартного (нормального) водородного электрода. Его потенциал, устанавливающийся при нормальных условиях, принят равным нулю. На рис. 15 (Смотри И.Е.Макашева 1 часть стр.120) представлен водородный электрод, на котором протекает обратимый процесс 2H+ + 2 e- ↔H20
Выражение потенциала водородного электрода:
Ѳ H+/H0 = - 0,059 pH , учитывая, что Ѳ0 H+/H0 = 0 и -lg (H+)= pH
6.Стандартный электродный потенциал.
При погружении Me в воду ионы его поверхностного слоя под действием полярных молекул воды отрываются и гидратированными переходят в жидкость.В результате слой жидкости вблизи металла заряжается положительно, а металл – отрицательно, поскольку в нем создается относительный избыток электронов. По мере перехода ионов металла в раствор в нем нарастает положительный заряд. Положительные ионы металла притягиваются отрицательно заряженным металлом, и устанавливается подвижное равновесие
Me + mH2O ↔ Men+ mH2O + ne-
Состояние равновесия зависит как от активности металла, так и от концентрации его ионов в растворе.
Равновесие зависит от темпиратуры, заряда иона металла, кислотности среды.
Электростатическое напряжение между катионами в растворе и избыточными электронами на поверхности (или наоборот) образует двойной электрический слой. Это приводит к возникновению на границе соприкосновения металла и жидкости определенной разности потенциалов, или скачка потенциала.
Такая разность потенциалов называется электродным потенциалом Ѳ (фита)
Если металл находится в растворе его соли, содержащей один грамм/моль металла в одном литре раствора ( точнее, активность aMe = 1 моль/л), то электродный потенциал будет постоянной величиной при P = 1,03 * 105 Па (1 атмосфера) и температуре T = 298 К. Такой потенциал называется нормальным ( или стандартным) электродным потенциалом Ѳ0.
Билет №27
1.Гальванические элементы(ГЭ)
Устройства в которых происходит преобразование энергии химической реакции в электрическую, называются гальваническими элементами. Действие любого ГЭ основано на окислительно – восстановительной реакции и обменной ионной реакции. В простейшем случае г.э. состоит из двух соединенных пластин или стержней различных металлов, погруженных в растворы электролитов. Система г.э. делает возможным пространственное разделение ОВР: окисление протекает на одном металле, восстановление на другом. Электроны передаются от восстановителя к окислителю по внешней цепи.
2.Электроды
В электрохимии — часть электрохимической системы, включающая в себя проводник (металлический или полупроводниковый) и окружающий его раствор (например, Водородный электрод, Хлорсеребряный электрод, Электрод сравнения, Стеклянный электрод)
3.Анодный и катодный процесс
Электрод, на котором протекает окисление называют анодом, а электрод на котором протекает восстановление катодом.Знак электродного потенциала определяется направлением тока при замыкании цепи. Если электроны текут по металлическому проводнику от изучаемого электрода к водородному, то его потенциал отрицательнее, чем у стандартного водородного электрода. В г.э. на отрицательном электроде идет процесс окисления, и с него электроны поступают во внешнюю цепь. Если, наоборот, электроны поступают от стандартного водородного электрона к изучаемому, то это значит, что потенциал последнего положительнее, чем у стандартного водородного электрона. В г.э. на положительном электроде идет процесс восстановления.
4.Уравнение Нернста для электродного потенциала и гальванического элемента
Потенциалы электродов описываются уравнениями:
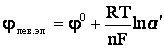
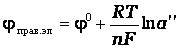
а э.д.с. концентрационного гальванического элемента выражением
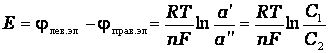
5.Электродвижущая сила (E) гальванического элемента (ЭДС) равна разности потенциалов положительного электрода и отрицательного электрода при отсутствии тока в цепи.
E=Ѳкатода-Ѳанода
6.Разность потенциалов
Энергия переноса электронов определяется разностью потенциалов E=Ѳ2-Ѳ1, свободная энергия реакции равна электрической энергии ∆G=Efn,
Где E-ЭДС г.э.; F-число Фарадея; n-число переносимых электронов
7.Устройство и электрохимическое изображение гальванических элементов
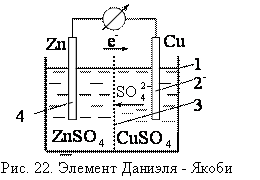
Рассмотрим устройство и принцип работы гальванического элемента Даниэля-Якоби. Он состоит из корпуса 1 (рис. 22), разделенного на две части пористой перегородкой 2. В каждую из частей помещаются электроды: медный 3 и цинковый 4. Медный электрод погружается в раствор сульфата меди, цинковый – в раствор сульфата цинка. Пористая перегородка предотвращает смешивание соприкасающихся растворов и пространственно разделяет окислительно-восстановительную реакцию, протекающую при замкнутой внешней цепи: окисление цинка и восстановление меди.
На поверхности цинка атомы, соприкасаясь с раствором, превращаются в ионы, гидратируются и переходят в раствор. В результате возникает двойной электрический слой, устанавливается равновесие и возникает электродный потенциал цинка.
.![]()
На медном электроде протекает аналогичный процесс, приводящий к возникновению электродного потенциала медного электрода.
![]()
Потенциал цинкового электрода отрицательный по сравнению с медным электродом, поэтому при замыкании внешней цепи электроны будут переходить от цинка к меди. В результате этого равновесие на цинковом электроде сместится вправо и в раствор перейдет дополнительное число ионов цинка. На медном электроде равновесие сместится влево и произойдет разряд ионов меди. Эти процессы будут продолжаться до тех пор, пока не растворится весь цинк или не высадится на медном электроде вся медь.
Итак, при работе элемента Даниэля-Якоби протекают процессы:
Окисление цинка
![]()
Этот процесс окисления называют анодным, а электрод – анодом.
Восстановление ионов меди
![]()
Процессы восстановления называют в электрохимии катодными, а электроды, на которых идут процессы восстановления – катодами.
Движение электронов во внешней цепи.
Движение ионов в растворе: анионов
![]() к аноду, катионов
к аноду, катионов
![]() к катоду. Движение ионов в растворе
замыкает электрическую цепь гальванического
элемента.
к катоду. Движение ионов в растворе
замыкает электрическую цепь гальванического
элемента.
Суммируя электродные реакции, получим:
![]()
Это, так называемая, токообразующая реакция.
При схематическом отображении гальванического элемента границу раздела между проводником первого рода (металлом) и проводником второго рода (электролит) обозначают одной вертикальной чертой, а границу раздела между проводниками второго рода – двумя чертами:
![]()
Или
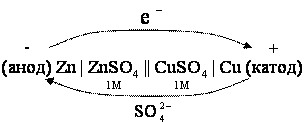
P.S смотри уч. И.Е. Макашева 1 часть стр.121
Билет №28
