
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Законы — начала термодинамики
- •Внешняя и внутренняя сферы.
- •Комплексообразователь (центральный атом – акцептор), лиганды – доноры электронных пар, координационное число комплексообразователя.
- •Два типа диссоциации комплексов – как ионных солей и по внутренней сфере
- •Понятие о термодинамической прочности (устойчивости) комплексов
- •Значение комплексных соединений в природе, науке и технике
- •Билет №25
- •1.Овр(окислительно-восстановительные реакции)
- •2.Степень окисления.
- •3.Окислители восстановители.
- •4.Эквиваленты и эквивалентные массы окислителей и востановителей.
- •5.Типы окислительно-востановительных реакций.
- •6.Составление ионно-электронных уравнений. Примеры.
- •Билет №26
- •1.Электрохимические процессы.
- •2.Равновесие на границе металл-раствор соли металла.
- •3.Металлический электродный потенциал.
- •4.Электродный потенциал.
- •5.Водородный электрод. (см. Записи в тетр. За 2.12)
- •6.Стандартный электродный потенциал.
- •Билет №27
- •Вопрос 1: Ряд стандартных электродных потенциалов (ряд напряжений) и следствие из него.
- •Вопрос 2: Направление окислительно-восстановительных реакций (овр).
- •Вопрос 3: Стандартные потенциалы для химических окислительно-восстановительных систем. Табличные данные.
- •Гальванические элементы
- •Электрические аккумуляторы
- •Топливные элементы
- •Взаимодействие со щелочными и щёлочноземельными металлами
- •Взаимодействие с оксидами металлов (как правило, d-элементов)
- •Гидрирование органических соединений
- •Классификация
- •35.Водородные соединения галогенов. Получение. Физико- химические свойства. Восстановительные и кислотные свойства растворов галогенводородов.
- •36.Кислородные соединения галогенов. Оксиды хлора, кислородные кислоты галогенов и их соли. Химические свойства. Применение.
- •Билет 37
- •Билет 38
- •Получение
- •Получение
- •Химические свойства
- •Химические свойства
- •Применение
- •Химические свойства
- •Получение и свойства
- •Химические свойства
- •Применение
- •Применение
- •Вопрос 43
- •Вопрос 44
- •Вопрос 45
- •Билет №46
- •Билет №47 Водородные и кислородные соединения фосфора. Фосфин, фосфиды. Оксиды фосфора. Строение молекул. Получение. Свойства.
- •Билет №48
- •Билет №49 Орто - и метафосфорные кислоты и их соли. Фосфорные удобрения. Получение и свойства.
- •Билет № 51
- •Билет № 52
- •Нахождение в природе
- •Марганцовая кислота
- •Свойства элементов VIII b группы.
- •Железо, нахождение в природе
- •Соли железа
- •Физиологические функции:
- •Свойства солей железа
- •Био цинк. Содержит микроэлемент цинк (Zn)
- •Био медь. Содержит микроэлемент медь (Cu)
- •Аллотропия
- •Получение
- •Химические свойства
- •Получение
- •Химические свойства
- •Классификация
- •Получение
- •Химические свойства
- •Классификация
- •Средние соли Получение
- •Химические свойства
35.Водородные соединения галогенов. Получение. Физико- химические свойства. Восстановительные и кислотные свойства растворов галогенводородов.
Галогеноводороды
это газообразные соединения, легко
растворяются в воде. Водные растворы
галогеноводородов являются кислотами.
Получение.Галогены реагируют с
водородом, образуя HX, причем со фтором
и хлором реакция протекает со взрывом
при небольшой активации ее. Медленнее
идет взаимодействие c Br2 и I2. Для протекания
реакции с водородом достаточно
активировать небольшую долю реагентов
с помощью освещения или нагревания.
Более удобные методы получения
галоиодоводородов, чем прямой синтез,
дают, например, следующие реакции: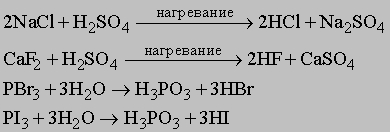
Физико- химические свойства.С уменьшением прочности связи в молекулах галогеноводородов падает и их термическая устойчивость.Галогеноводороды- газы с резким запахом. Они хорошо растворимы в воде и образают сильные кислоты, кроме HF, молекулы которой связаны сильными водородными связями, что затрудняет сильную диссоциацию.
Ионы галогенов (кроме F-)способны отдавать электроны, поэтому они являются восстановителями.Восстановительная способность галогенид-ионов увеличивается от хлорид иона к йодид иону.
В ряду кислот HF-HCL –Hbr-HI происходит усиление кислотных свойств.Из всех бескислородных кислот йодоводородная кислота является самой сильной.
36.Кислородные соединения галогенов. Оксиды хлора, кислородные кислоты галогенов и их соли. Химические свойства. Применение.
Галогены могут проявлять в своих кислородных соединениях разнообразные степени окисления: от +7 до +1
Все хлора оксиды имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду. гемиоксид Cl2O (жёлто-оранжевый газ), диоксид ClO2 (зеленовато-жёлтый газ), триоксид Cl2O6 (ярко-красная жидкость), хлорный ангидрид Cl2O7 (бесцветная жидкость). Сильные окислители, взрывоопасны
Галогены и их кислоты используются при получении химических препаратов, лекарств, взрывчатых и боевых отравляющих веществ, полимеров.
Билет 37
Элементы VI A группы периодической системы. Халькогены. Общая характеристика. Нахождение в природе. Получение. Физические и химические свойства. Сера. Общая характеристика. Электронная оболочка ,положение в ПТ, валентность, свойства.
Сера, кислород, селен, теллур, полоний- элементы VI A группы периодической системы, именнуемые халькогены и имееющие следующее строение внешней электронной оболочки ns2 (как степень)и np4. На внешнем электронном уровне 6 электронов и в их числе 2 неспаренных электрона. Типичная степень окисления -2,также встречается -1.
В подгруппе халькогенов сверху вниз с увеличением заряда ядра атома закономерно изменяются свойства элементов: уменьшается их неметаллический характер и усиливаются металлические свойства. Так кислород- типичный неметалл, а полоний- металл.
У кислорода валентность II является постоянной, это обьясняется так у атома кислорода отсутствует d подуровень и поэтому невозможно возбуждение атомов в пределах второго энергетического уровня, а для перехода спаренных электронов второго уровня на третий требуются затраты большого количества энергии. У других элементов данной подгруппы спаренные электроны s и p орбиталей легко возбуждаются и могут переходить на соответствующие d-орбитали, при этом увеличивается число электронов и валентность электронов(до IV и VI).
Нахождение в природе кислорода и серы. В природе кислород состоит из трёх стабильных изотопов: (O-16, O-17, O-18). Кислород ввиде простого вещества входит в состав атмосферного воздуха. В связанном виде элемент кислород составная часть воды, различных минералов, многих органических веществ. На долю кислорода приходится 47% массы земной коры. Кислород составляет 50-85% массы тканей растений и животных.
В природе сера находится как в свободном состоянии, так и ввиде соединений, важнейшие из них следующие: FeS2(пирит), CuS(медный блеск), Ag2S(серебрянный блеск). Сера часто встречается ввиде сульфатов(гипс). Сера входит в состав нефти, каменного угля, содержится в растительных и животных организмах.
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода, является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
2KMnO4 → K2MnO4 + MnO2 + O2↑;
используют также реакцию каталитического разложения пероксида водорода Н2О2:
2Н2О2 → 2Н2О + О2↑.
Катализатором является диоксид марганца (MnO2) или кусочек сырых овощей (в них содержатся ферменты, ускоряющие разложение пероксида водорода).
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
2KClO3 → 2KCl + 3O2↑.
Термическое разложение нитратов щелочных металлов
2NaNO3->2NaNO2+O2
Получение серы. В лабораторных условиях свободную серу можно получить: 1)при сливании раствора сероводорода и сернистой кислот, 2)при неполном сгорании сероводорода.
1)H2SO3+2H2S=3S+3H2O
2)3H2S+O2=2H2O+2S.
Все параметры халькогенов характеризуют их типичные неметаллические свойства: большие значения потенциалов ионизации, а также большие значения сродства электронов. Температура плавления невелики, но удельные массы, начиная с теллура, характеризует плотные металлические решётки.
Халькогены- окислители. Для завершения внешнего электронного уровня, халькогены присоединяют по два недостающих электрона. И в соединения с металлами имеют отрицательную степень окисления -2. Сверху вниз в подгруппе окислительная способность халькогенов уменьшается, халькогенид- ионы могут отдавать только электроны и поэтому являются восстановителями. Восстановительная способность халькогенид-ионов в подгруппе увеличивается сверху вниз. Элементы халькогены образуют соединения с водородом одного типа H2хальк. При расстворении халькогена в воде образуются соответствующие кислоты: сероводородная, селеноводородная, теллуроводородная. Для халькогенов известны оксиды с общими формулами: ЭО2 и ЭО3. Кислотным оксидам такого типа соответсвуют кислоты H2ЭО3 и H2ЭО4. В кислотных оксидах и в кислотах проявляется характерная степень окисления +4 и +6.
Сера- элемент главной подгруппы VI группы в 3-ем периоде, порядковый номер 16, заряд ядра атома 16, относительная атомная масса приблизительно равна 32-ум. Строение атома серы см. выше.
Известны 3 аллотропные модификации: ромбическая, моноклинная и пластическая. Наиболее устойчивая модификация- ромбическая. Именно в таком виде сера и встречается в природе в свободном виде. Ромбическая сера состоит из циклических молекулы S8. В которых атомы серы соединены одинарными ковалентными связями. Ромбическая сера твёрдое кристаллическое вещество жёлтого цвета, не растворяется в воде, хорошо растворяется в сероуглероде и некоторых других органических растворителей. Температура плавления ромбической серы +112. При температуре +444 градусов сера кипит.
Сера- типичный активный неметалл, он реагирует с простыми и сложными веществами, в химических реакциях сера может быть, как окислителем так и восстановителем, это зависит от окислительно-восстановительных свойств веществ с которыми она реагирует, сера проявляет свойства окислителя при взаимодействии с простыми веществами- восстановителями. Восстановителем сера является по отношению к более сильным окислителям.
На воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом:
S + O2 = SO2
С помощью спектрального анализа установлено, что на самом деле процесс окисления серы в двуокись представляет собой цепную реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов моноокиси серы SO[5].
Восстановительные свойства серы проявляются в реакциях серы и с другими неметаллами, однако при комнатной температуре сера реагирует только со фтором:
S + 3F2 = SF6
Расплав серы реагирует с хлором, при этом возможно образование двух низших хлоридов[6]:
2S + Cl2 = S2Cl2
S + Cl2 = SCl2
При нагревании сера также реагирует с фосфором, образуя смесь сульфидов фосфора[7], среди которых — высший сульфид P2S5:
5S + 2P = P2S5
Кроме того, при нагревании сера реагирует с водородом, углеродом, кремнием:
S + H2 = H2S (сероводород)
C + 2S = CS2 (сероуглерод)
При нагревании сера взаимодействует со многими металлами, часто — весьма бурно. Иногда смесь металла с серой загорается при поджигании. При этом взаимодействии образуются сульфиды:
2Na + S = Na2S
Ca + S = CaS
2Al + 3S = Al2S3
Fe + S = FeS.
Растворы сульфидов щелочных металлов реагируют с серой с образованием полисульфидов:
Na2S + S = Na2S2
Из сложных веществ следует отметить прежде всего реакцию серы с расплавленной щёлочью, в которой сера диспропорционирует аналогично хлору:
3S + 6KOH = K2SO3 + 2K2S + 3H2O.
Полученный сплав называется серной печенью.
С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании:
S + 6HNO3(конц.) = H2SO4 + 6NO2 ↑ + 2H2O
S + 2H2SO4(конц.) = 3SO2 ↑ + 2H2O
