
- •2. Химическая технология и защита окружающей среды
- •3. Основные направления в развитии химической промышленности.
- •4. Хтп и их классификация
- •5. Уровни анализа, описания и расчета хтп.
- •6. Основные показатели хтп: степень превращения, выход продукта
- •7. Расходные коэф-ты. Избирательность хтп (φ)
- •Скорость хтп. Способы увеличения скорости
- •9. Материальный баланс процесса.
- •10. Тепловой баланс процесса.
- •11. Задачи термодинамического анализа
- •12. Равновесие Принцип Ле-Шателье и его применение в хт. Равновесная степень превращения
- •13.Константа равновесия и способы ее выражения
- •14. Влияние температуры на константу равновесия, ее расчет
- •15.Общая характеристика гомогенных хтп
- •16. Влияние концентраций реагентов на скорость гомогенных процессов и степень превращения
- •Основное кинетическое уравнение:
- •17. Влияние концентрации реагентов на избирательность гомогенных хтп.
- •18. Температура как фактор повышения скорости процесса и управления выходом продукта реакции (необратимые, обратимые, экзо- и эндотермические реакции)
- •19. Влияние температуры на скорость, избирательность процесса и выход продукта при протекании сложных реакций
- •20. Влияние давления на скорость газофазных реакций
- •1 Влияние давления на скорость необратимых процессов
- •2 Влияние давления на скорость обратимых процессов
- •21. Характер изменения основных параметров хтп во времени
- •22. Принципы расчета оптимальных параметров проведения процессов
- •23. Применение катализаторов в гомогенных системах (гомогенный катализ)
- •24. Общая характеристика гетерогенных хтп.
- •25. Процессы протекающие во внешнедиффузионной области.
- •26. Внутредиффузионная область протекания процессов.
- •27. Кинетическая область протекания процессов.
- •28. Основные методы изготовления и требования к катализаторам.
- •29. Особенности протекания каталитических процессов. Гетерогенные каталитические процессы.
- •Области протекания гетерогенных каталитических процессов.
- •Влияние этих торможений на избирательность Кт.
- •Влияние внутридиффузионных торможений на кинетику процесса.
- •30. Переходные области протекания гетерогенного хтп.
- •31. Моделирование хтп. Общие понятия.
- •37. Основные характеристики потоков и их влияние на хтп
- •38. Протекание хтп в потоке идеального вытеснения (ив)
- •39. Температурные режимы протекания хтп.
- •40. Протекание хтп в потоке полного (идеального) смешения.
- •4 0.1. Технологические расчеты.
- •40.2. Закономерность хтп без теплообмена.
- •41. Теплообмен с окружающей средой как фактор интенсификации хтп в потоке.
- •42. Секционирование реакционной зоны потока смешения.
- •42.1. Методы расчета каскада реакционных зон.
- •43. Сопоставление протекания хтп в различных идеальных потоках.
- •43.1. Процессы без тепловых эффектов ( при изотермическом температурном режиме).
- •43.2. Процессы с большими тепловыми эффектами.
- •43.3. Сравнение по избирательности.
- •44. Протекание хтп в неидеальных потоках.
- •45. Химические реакторы
- •45.1. Классификация
- •46. Основные требования к промышленным реакторам:
- •47. Отклонения реальных реакторов от идеализированных моделей
- •48. Реакторы для гомогенных процессов
- •49. Реакторы для проведения гетерогенных процессов в системе г — ж
- •50. Химико-технологические системы (хтс). Основные определение.
- •51. Моделирование химика-технологической системы
- •52. Организация химико-технологического процесса. Выбор схемы процесса
- •53. Основные условные обозначения технолог.Операторов. Основные способы отражения структуры хтс.
- •54. Технологическая схема хтс. Схемы с открытой цепью и циклические
- •55. Элементы анализа и синтеза хтс.
- •56. Основные типы связей.
- •59. Задачи, решаемые при исследовании хтс.
- •60. Сырьё в химической технологии. Комплексное использование сырья.
- •61. Методы очистки воды для производственных процессов. Очистка сточных вод. Замкнутые водооборотные циклы.
- •62. Очистка газообразных промышленных выбросов.
- •63. Обработка твердых отходов
- •64. Виды энергии, применяемые в химической промышленности. Использование тепла отходящих газов: регенераторы, рекуператоры, котлы-утилизаторы.
- •65. Методы обогащения твёрдых, жидких материалов и газов.
11. Задачи термодинамического анализа
Роль термодинамического анализа в ХТ определяется решением 4 задач:
1.
Установление принципиальной возможности
протекания предполагаемого химического
процесса (критерий: изменение изобары
или
![]() ).
).
2. Определение энергетических (тепловых) эффектов ХТП, необходимых для составления энергетических (тепловых) балансов и расчета затрат энергии на проведение того или иного ХТП.
3. Расчет максимально возможных степеней превращения исходного сырья и выходов продуктов при проведении обратимых процессов.
4. Определение диапазона температур и давлений, при котором рационально (оптимально) осуществление ХТП.
1. (изобарно- изотермический потенциал)
Температура, в градусах Цельсия, постоянна; давление, в МПа, постоянное.
![]() 1 способ
1 способ
![]() 2 способ
2 способ
Условие принципиальной осуществимости протекания химической реакции в прямом направлении без затрат является уменьшение свободной энергии системы (Гиббса) .
![]() -
желательно,
-
желательно,
![]() -
желательно.
-
желательно.
3 способ: (уравнение Темкина-Шварцмена) применение двойных интегралов.
4 способ: из изотермы Вант-Гоффа.
![]()
Вычисление
теплового эффекта химической реакции
с помощью
![]() .
.
1.
Тепло образования
![]()
2.
Тепло
сгорания![]()
Тепловой
эффект равен разности суммы исходных
и суммы продуктов, с учетом стехиометрических
коэффициентов. Основано на определении:
сгорание всегда идет с выделением
тепла.![]() .
.
12. Равновесие Принцип Ле-Шателье и его применение в хт. Равновесная степень превращения
К химическому равновесию применяют второе начало термодинамики в его общем виде, т.е. одним из условий одним из условий химического равновесия является его стремление к максимальному значению энтропии. В состоянии равновесия дальнейшее превращение энтропии не происходит, т.е. ΔS =0.
Влияние основных параметров технологического режима (температура, давление, инерты, концентрация) на равновесие в гомогенных и гетерогенных системах определяются принципом Ле-Шателье, в соответствии с этим принципом:
В системе, выведенной внешним воздействием из состояния равновесия, происходят изменения, направленные к ослаблению воздействия выведения системы из состояния равновесия.
![]()
Для
увеличения выхода
![]() :
:
1. температуру уменьшить (тепловой эффект химической реакции).
2. давление повысить (критерием влияния давления на смещение равновесия является число молей; реакция идет с уменьшение давления).
3 концентрация
Влияние
на равновесную степень превращения (![]() )
температуры, давления и избытка одного
из компонентов.
)
температуры, давления и избытка одного
из компонентов.



13.Константа равновесия и способы ее выражения
Любой процесс, обратимо идущий, характеризуется следующими равновесными параметрами:
1)
константа равновесия:![]()
2)
равновесная концентрация:
![]()
3) равновесные степени превращения:
4)
равновесные выходы:
![]()
![]() ;
;

Способы выражения константы равновесия.
Существует 3 основных способа выражения константы равновесия:
1.
Через концентрацию компонентов
![]()
2 .
Через парциальные давления
.
Через парциальные давления
![]()
3.
Через молярные доли компонентов
![]()
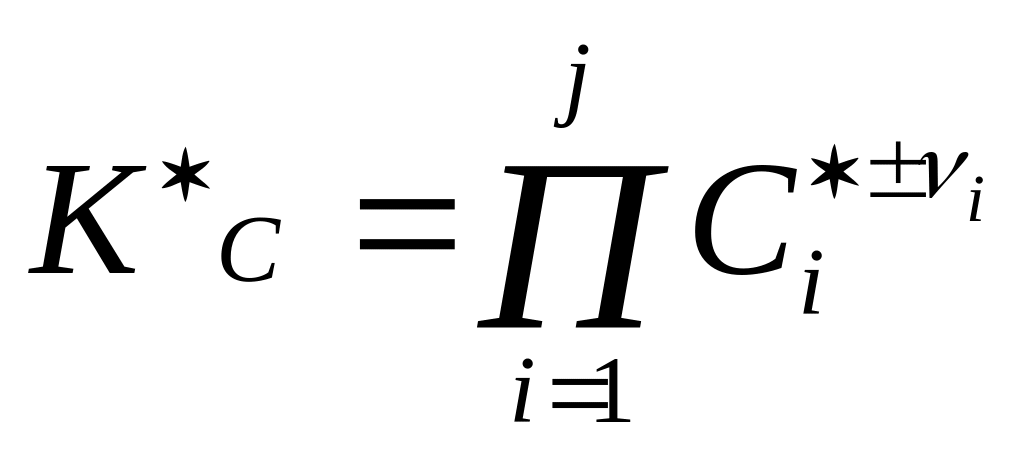
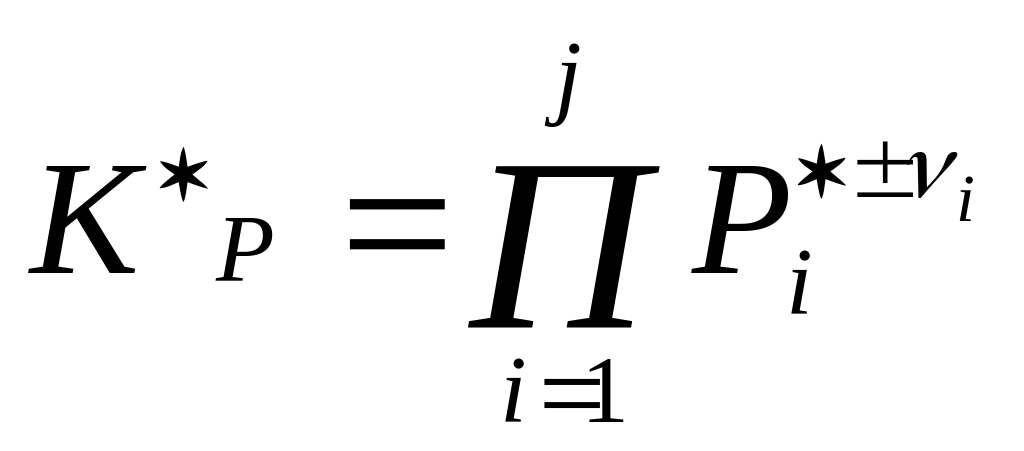
П-произведение, «+»- продукты реакции, «-»- исходные вещества.
Выражение константы равновесия будет зависеть от соотношения стехиометрических коэффициентов. При составлении необходимо обратить внимание на размерность концентраций. Численные значения зависят от формы записи стехиометрического уравнения.
От каких параметров зависит численное значение константы равновесия?
![]() и
и
![]() для идеальных газов зависят только от
температуры , от давления не зависят, а
также от мольного соотношения и от
наличия или отсутствия разбавителей,
и от других параметров. Для реальных
газов (что условно применяется к реальным
газам в ХТ под давлением > 50 атмосфер).Чем
выше давление реального газа, тем ниже
константа.
для идеальных газов зависят только от
температуры , от давления не зависят, а
также от мольного соотношения и от
наличия или отсутствия разбавителей,
и от других параметров. Для реальных
газов (что условно применяется к реальным
газам в ХТ под давлением > 50 атмосфер).Чем
выше давление реального газа, тем ниже
константа.
![]() зависит от всех параметров.
зависит от всех параметров.
Между различными выражениями константы равновесия существует математическая связь. Эта связь выражается через два известных уравнения: уравнения Менделеева-Клапейрона и закона Дальтона.
![]()
![]()
Между и :
![]()
![]() -
приращение числа моль газов, в следствие
прохождения химической реакции. п может
быть > 0 и <0.
-
приращение числа моль газов, в следствие
прохождения химической реакции. п может
быть > 0 и <0.
Между
и
:
![]()
Между
![]() и
:
и
:
![]()
Можно определить константу равновесия, а затем равновесные концентрации продуктов реакции.
