
- •2. Химическая технология и защита окружающей среды
- •3. Основные направления в развитии химической промышленности.
- •4. Хтп и их классификация
- •5. Уровни анализа, описания и расчета хтп.
- •6. Основные показатели хтп: степень превращения, выход продукта
- •7. Расходные коэф-ты. Избирательность хтп (φ)
- •Скорость хтп. Способы увеличения скорости
- •9. Материальный баланс процесса.
- •10. Тепловой баланс процесса.
- •11. Задачи термодинамического анализа
- •12. Равновесие Принцип Ле-Шателье и его применение в хт. Равновесная степень превращения
- •13.Константа равновесия и способы ее выражения
- •14. Влияние температуры на константу равновесия, ее расчет
- •15.Общая характеристика гомогенных хтп
- •16. Влияние концентраций реагентов на скорость гомогенных процессов и степень превращения
- •Основное кинетическое уравнение:
- •17. Влияние концентрации реагентов на избирательность гомогенных хтп.
- •18. Температура как фактор повышения скорости процесса и управления выходом продукта реакции (необратимые, обратимые, экзо- и эндотермические реакции)
- •19. Влияние температуры на скорость, избирательность процесса и выход продукта при протекании сложных реакций
- •20. Влияние давления на скорость газофазных реакций
- •1 Влияние давления на скорость необратимых процессов
- •2 Влияние давления на скорость обратимых процессов
- •21. Характер изменения основных параметров хтп во времени
- •22. Принципы расчета оптимальных параметров проведения процессов
- •23. Применение катализаторов в гомогенных системах (гомогенный катализ)
- •24. Общая характеристика гетерогенных хтп.
- •25. Процессы протекающие во внешнедиффузионной области.
- •26. Внутредиффузионная область протекания процессов.
- •27. Кинетическая область протекания процессов.
- •28. Основные методы изготовления и требования к катализаторам.
- •29. Особенности протекания каталитических процессов. Гетерогенные каталитические процессы.
- •Области протекания гетерогенных каталитических процессов.
- •Влияние этих торможений на избирательность Кт.
- •Влияние внутридиффузионных торможений на кинетику процесса.
- •30. Переходные области протекания гетерогенного хтп.
- •31. Моделирование хтп. Общие понятия.
- •37. Основные характеристики потоков и их влияние на хтп
- •38. Протекание хтп в потоке идеального вытеснения (ив)
- •39. Температурные режимы протекания хтп.
- •40. Протекание хтп в потоке полного (идеального) смешения.
- •4 0.1. Технологические расчеты.
- •40.2. Закономерность хтп без теплообмена.
- •41. Теплообмен с окружающей средой как фактор интенсификации хтп в потоке.
- •42. Секционирование реакционной зоны потока смешения.
- •42.1. Методы расчета каскада реакционных зон.
- •43. Сопоставление протекания хтп в различных идеальных потоках.
- •43.1. Процессы без тепловых эффектов ( при изотермическом температурном режиме).
- •43.2. Процессы с большими тепловыми эффектами.
- •43.3. Сравнение по избирательности.
- •44. Протекание хтп в неидеальных потоках.
- •45. Химические реакторы
- •45.1. Классификация
- •46. Основные требования к промышленным реакторам:
- •47. Отклонения реальных реакторов от идеализированных моделей
- •48. Реакторы для гомогенных процессов
- •49. Реакторы для проведения гетерогенных процессов в системе г — ж
- •50. Химико-технологические системы (хтс). Основные определение.
- •51. Моделирование химика-технологической системы
- •52. Организация химико-технологического процесса. Выбор схемы процесса
- •53. Основные условные обозначения технолог.Операторов. Основные способы отражения структуры хтс.
- •54. Технологическая схема хтс. Схемы с открытой цепью и циклические
- •55. Элементы анализа и синтеза хтс.
- •56. Основные типы связей.
- •59. Задачи, решаемые при исследовании хтс.
- •60. Сырьё в химической технологии. Комплексное использование сырья.
- •61. Методы очистки воды для производственных процессов. Очистка сточных вод. Замкнутые водооборотные циклы.
- •62. Очистка газообразных промышленных выбросов.
- •63. Обработка твердых отходов
- •64. Виды энергии, применяемые в химической промышленности. Использование тепла отходящих газов: регенераторы, рекуператоры, котлы-утилизаторы.
- •65. Методы обогащения твёрдых, жидких материалов и газов.
17. Влияние концентрации реагентов на избирательность гомогенных хтп.
При анализе сложных реакций используют принцип суперпозиции или принцип независимости, согласно которому каждая реакция происходит независимо от других, подчиняясь законам химической кинетики. Каждое изменение системы равно сумме изменений, внесенных каждой реакцией.
а) рассмотрим параллельную реакцию.

 ,
,
Избирательность пропорциональна начальной концентрации. И для других параллельных реакции избирательность прямо пропорциональна начальной концентрации. Связь между выходом и избирательностью процесса следующая:
![]()
б) рассмотрим последовательную реакцию.
Для этих реакций можно прийти к аналогичному выводу.
![]()
В случае последовательной реакции, если целевой продукт В получается по реакции 2 порядка (n1=2), а побочный продукт D по реакции 1 порядка (n2=1), то соотношение получившегося продукта В к D растет прямо пропорционально начальной концентрации , следовательно надо повышать .
Каким же образом в промышленности увеличивают ? Выпаривание, вымораживание, различные способы сорбции и т.д. Зависит от агрегатного состояния: а) жидкость (выпаривание, вымораживание, сорбция с последующей десорбцией), б) газ ( сжатие, различные виды сорбции, с последующей десорбцией).
18. Температура как фактор повышения скорости процесса и управления выходом продукта реакции (необратимые, обратимые, экзо- и эндотермические реакции)
а) необратимые реакции

Чем выше Еа, тем существеннее влияние температуры на процесс. И поэтому отсюда следует , что для необратимых реакций мгновенная скорость с ростом температуры увеличивается.
Уравнение
Аррениуса позволяет рассчитать
![]() при
при
![]() ,
если известно
,
если известно
![]() при
при
![]() .
В дифференциальной форме:
.
В дифференциальной форме:
![]() ,
,
Если это уравнение проинтегрировать от до , причем Еа постоянна, то можно получить следующее уравнение:
![]() ,
,
Средняя
скорость процесса
,
которая определяется выходом в единицу
времени
,
прямо пропорциональна изменению
![]() процесса (реакции), если требуется
поддерживать неизменную степень
превращения Х.
процесса (реакции), если требуется
поддерживать неизменную степень
превращения Х.
Н е
сложно вывести следующую зависимость.
Если
постоянна,
то тогда
е
сложно вывести следующую зависимость.
Если
постоянна,
то тогда

 ,
,
Технологов больше интересует как изменится от температуры при неизменном заданном времени .Для получения такой зависимости, выражение для надо проанализировать, как будет изменяться .
![]() ,
,
Г рафик
для этого случая имеет характер,
изображенный на рисунке 11. Характер
этой кривой обусловлен совместным
влиянием роста
с
повышением температуры и уменьшением
концентрации исходного вещества А с
ростом температуры.
рафик
для этого случая имеет характер,
изображенный на рисунке 11. Характер
этой кривой обусловлен совместным
влиянием роста
с
повышением температуры и уменьшением
концентрации исходного вещества А с
ростом температуры.
Учитывая, что для реакции 1 порядка степень превращения зависит от времени:
![]() ,(n==1)
,(n==1)
Можно сделать вывод, что изменение с ростом температуры прямо пропорционально и тоже описывается такой же кривой.

б) обратимые реакции
В отличие от необратимых реакций влияние температуры на скорость реакции в этом случае имеет гораздо сложный характер, т.к. энергия активации прямой и обратной реакции различна. Чувствительность этих реакций к температуре также будет различна.
![]()
Если процесс экзотермический, то Е2>Е1. Для простых обратимых реакций можно написать следующее выражение для скорости реакции:
![]() ,
,
,
![]() ,
,
![]() ,
,
![]() .
.

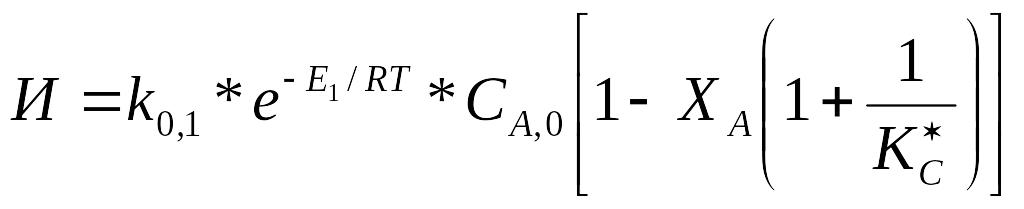 ,
,
![]()
С
ростом температуры
![]() растет, а
растет, а
![]() либо растет, либо уменьшается, в
зависимости от теплового эффекта
химической реакции. Отсюда получаются
различные зависимости скорости от
температуры для экзо- и эндотермических
реакций.
либо растет, либо уменьшается, в
зависимости от теплового эффекта
химической реакции. Отсюда получаются
различные зависимости скорости от
температуры для экзо- и эндотермических
реакций.
в) обратимые экзотермические реакции

Для экзотермических реакций кинетический фактор и термодинамический фактор изменяются в зависимости от температуры противоречиво (см. рис. 13 и 14). Поэтому перемножая кривые а) и б), мы получим зависимость. Для обратимой экзотермической реакции от температуры. И эта величина будет проходить через максимум и будет выглядеть так (рис. 15). Это теоретическая зависимость, которая
п остроена
при условии, что
будет постоянной величиной во всем
диапазоне применения температуры. Этот
вид кривой вытекает из уравнения (5.18).
Поэтому на практике мы получим серию
кривых зависимости скорости от
температуры, причем каждый график будет
построен при
постоянной.
остроена
при условии, что
будет постоянной величиной во всем
диапазоне применения температуры. Этот
вид кривой вытекает из уравнения (5.18).
Поэтому на практике мы получим серию
кривых зависимости скорости от
температуры, причем каждый график будет
построен при
постоянной.
![]()

ЛОТ- линия оптимальных температур
Т опт 4<Т опт 3<Т опт 2<Т опт 1
Х1<X2<X3<X4
Линия, связывающая максимумы,
кривых, называется линией ЛОТ.
О
 птимальными
называются
температуры
при которых обеспечиваются
максимальные
скорости проведения ХТП для достижения
заданных
степеней превращения. Чем ниже температура,
тем согласно Ле-Шателье должна быть
выше
.
Чем выше
,
тем выше оптимальная температура.
птимальными
называются
температуры
при которых обеспечиваются
максимальные
скорости проведения ХТП для достижения
заданных
степеней превращения. Чем ниже температура,
тем согласно Ле-Шателье должна быть
выше
.
Чем выше
,
тем выше оптимальная температура.
Д ля
обратимых экзотермических реакций
изучим графическую закономерность
ля
обратимых экзотермических реакций
изучим графическую закономерность
![]() .
Пусть имеется какой-либо раствор, в нем
идет процесс ХТП, будет изменятся в нем
температура, и при каждой температуре
будет изменятся степень превращения
.
Пусть имеется какой-либо раствор, в нем
идет процесс ХТП, будет изменятся в нем
температура, и при каждой температуре
будет изменятся степень превращения
![]() .
.

Для обратимых экзотермических реакций
![]() <
<
![]() <
<
![]() ,
,
![]() <
<
![]() <
<![]()
Чем меньше температура, тем выше (объясняет принцип Ле-Шателье). За критерий оптимизации принимают либо скорость процесса, либо степень превращения. По мере увеличения степени превращения при проведении обратимой экзотермической реакции, технолог должен уменьшить температуру. Проведение реакций при оптимальных температурах (ЛОТ) гарантирует минимальный реакционный объем аппарата, минимальную загрузку катализатора, минимальные затраты на перемешивание и на гидравлическое сопротивление (его преодоление).
г) обратимые эндотермические реакции
![]()
 ,
,
Рассмотрим имеется ли в данных реакциях «конфликт» между кинетическим фактором и термодинамическим фактором .

Вывод: исходя из рисунков 19 и 20 видно, что никакой конфликтной ситуации нет, поэтому зависимость скорости, как функция от температуры, выглядит следующим образом:
Если меняется, то при построении графика мы получим серию кривых (эндотермический процесс).
<
<
,
![]() <
<
![]() <
<![]()
![]()
![]()
В этом случае отсутствуют оптимальные температуры. За критерий оптимизации принимают экономический фактор.
Построим
график зависимости
.
При малой степени превращения и низкой
температуре предлагается принимать
фактор повышения, а при высоких степени
превращения и температуре сказываются
термодинамические ограничения,
затормаживающие рост степени превращения
для эндотермических реакций. Для
эндотермических реакций работать при
низких температурах не выгодно из-за
малых
![]() .
При высоких температурах (для заданных
)
работать не выгодно из-за низких скоростей
при приближению к состоянию равновесия.
В случае проведения эндотермических
реакций критерием оптимизации является
экономический фактор, а для экзотермических-
скорость и степень превращения.
.
При высоких температурах (для заданных
)
работать не выгодно из-за низких скоростей
при приближению к состоянию равновесия.
В случае проведения эндотермических
реакций критерием оптимизации является
экономический фактор, а для экзотермических-
скорость и степень превращения.



