
- •1. Основные положения статистической термодинамики
- •1.1. Понятия и начала феноменологической термодинамики.
- •1.2. Микроскопическое (механическое) описание классических систем.
- •1.3. Особенности представления квантовых систем
- •1.4. Вероятность нахождения системы в элементе фазового пространства. Метод ансамблей Гиббса.
- •1.5. Макроскопические величины как фазовые средние
- •1.6. Распределение в системах с постоянным числом частиц
- •1.6.2. Распределения Гиббса.
- •1.6.3. Квазиклассическое приближение.
- •1.7. Свойства распределения Гиббса
- •1.8. Большое каноническое распределение Гиббса
- •2. Статистика идеального газа
- •2.1. Идеальный газ как модель статистической системы
- •2.2. Распределение Максвелла
- •2.3. Столкновения молекул со стенкой сосуда. Давление
- •2.4. Характерные величины идеального газа
- •2.5. Столкновение молекул между собой
- •2.6. Длина свободного пробега
- •2.7. Идеальный газ во внешнем поле
- •2.8. Число и функция состояний идеального газа
- •2.9. Классическая теория теплоемкости газа двухатомных молекул
- •2.10. Квантовая теория теплоемкости газа двухатомных молекул
- •2.11. Распределения в квантовых системах
- •3. Законы термодинамики
- •3.1. Статистическое обоснование первого начала термодинамики
- •3.2. Второе начало термодинамики
- •3.3. Вечный двигатель второго рода. Максимальная работа процессов
- •3.4. Полезная работа тепловых машин
- •3.5. Метод термодинамических потенциалов
- •3.6. Термодинамические коэффициенты. Критерии устойчивости равновесия
- •3.7. Статистическое вычисление термодинамических величин
- •3.8. Третье начало термодинамики (теорема Нернста)
- •3.9. Применения термодинамики
- •4. Статистика сложных систем.
- •4.1. Модель кристаллического твердого тела. Уравнение движения атомов
- •4.2. Дисперсионное уравнение нормальных колебаний кристалла
- •4.3. Кристалл как система линейных гармонических осцилляторов
- •4.4. Статистическая сумма и энергия кристалла (в гармоническом приближении)
- •4.5. Теория теплоемкости Дебая
- •4.6. Электронный газ в металлах
- •4.7. Зависимость энергии электрона от волнового вектора. Эффективная масса
- •4.8. Теория парамагнетизма. Природа и характеристики магнетизма.
- •4.9. Равновесное излучение.
- •4.10. Системы с кулоновским взаимодействием частиц.
- •5. Теория малых флуктуаций
- •5.1. Определение и значение флуктуаций
- •5.2. Мера вероятности и масштаб флуктуаций
- •5.3. Флуктуации термодинамических величин в однородной среде
- •5.4. Предельная чувствительность измерительных приборов
- •5.5. Рассеяния света флуктуациями
- •6. Элементы теории физической кинетики
- •6.1. Определения и характеристики необратимых процессов
- •6.2. Теория стационарных процессов в газе свободных электронов
- •6.3. Газокинетическое уравнение Больцмана
- •6.4. Приближение времени релаксации
- •Раздел 2
- •Раздел 2
- •Раздел 3
- •Раздел 4
- •Раздел 5
- •Раздел 6
- •Список Литературы
2.5. Столкновение молекул между собой
Выделим две молекулы
идеального газа с массами
 и
и
 и скоростями
и скоростями
 и
и
 .
Вопрос о столкновении этих молекул
связан с характером их относительного
движения. В механике показывается, что
движение двух частиц можно всегда
разложить на движение в пространстве
общего центра тяжести и их относительное
движение. Из определения скоростей
относительного
.
Вопрос о столкновении этих молекул
связан с характером их относительного
движения. В механике показывается, что
движение двух частиц можно всегда
разложить на движение в пространстве
общего центра тяжести и их относительное
движение. Из определения скоростей
относительного
 и абсолютного (центра тяжести двух
молекул)
и абсолютного (центра тяжести двух
молекул)
 движения, а именно:
движения, а именно:
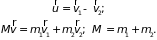
Находим зависимость
 и кинетическую энергию
и кинетическую энергию
 (2.17)
(2.17)

где
 – приведенная масса. Первое слагаемое
определяет энергию движения центра
тяжести, а второе – энергию относительного
движения. Относительное движение
происходит так, как если бы одна из
молекул была неподвижна, а вторая имела
массу, равную приведенной
.
– приведенная масса. Первое слагаемое
определяет энергию движения центра
тяжести, а второе – энергию относительного
движения. Относительное движение
происходит так, как если бы одна из
молекул была неподвижна, а вторая имела
массу, равную приведенной
.
Вероятность того,
что одна молекула имеет скорость
 ,
а вторая –
,
а вторая –
 ,
равна произведению вероятностей простых
событий, т.е.
,
равна произведению вероятностей простых
событий, т.е.
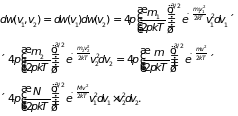
Перейдем в фазовом
пространстве от переменных
 к переменным
к переменным
 :
:
 ,
,
где учтено, что
модуль якобиана преобразования равен
 .
Искомая вероятность
.
Искомая вероятность
 распадается на произведение
распадается на произведение
 и
и
 (2.18)
(2.18)
Для упрощения
считаем, что газ состоит из одинаковых
молекул,
 .
Используя указанное распределение,
найдем среднюю скорость относительного
движения
.
Используя указанное распределение,
найдем среднюю скорость относительного
движения
 , (2.19)
, (2.19)
которая оказывается
в
 раза больше средней скорости теплового
движения молекул газа.
раза больше средней скорости теплового
движения молекул газа.
В дальнейшем
предполагаем, что газ настолько разрежен,
что молекулы сталкиваются попарно, а
числом столкновений, при котором
одновременно приходят в непосредственный
контакт три и более молекул будем
пренебрегать. Соударение двух молекул
– сложный процесс, зависящий от природы
и характера их взаимодействия. Если
молекулы рассматривать как твердые
шарики радиуса
 ,
взаимодействующие только при
непосредственном контакте, то для
соударения центры молекул должны были
бы сблизиться на расстояние
,
взаимодействующие только при
непосредственном контакте, то для
соударения центры молекул должны были
бы сблизиться на расстояние
 .
Иными словами, соударения происходят
в том случае, когда центры сталкивающихся
молекул лежат в круге площадью
.
Иными словами, соударения происходят
в том случае, когда центры сталкивающихся
молекул лежат в круге площадью
 .
Эту площадь называют геометрическим
сечением соударения. В реальных газах
молекулы начинают взаимодействовать
еще до непосредственного контакта, на
расстояниях
.
Эту площадь называют геометрическим
сечением соударения. В реальных газах
молекулы начинают взаимодействовать
еще до непосредственного контакта, на
расстояниях
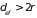 .
Это расстояние называют эффективным
диаметром столкновения, а площадь
круга
.
Это расстояние называют эффективным
диаметром столкновения, а площадь
круга
 – эффективным сечением соударения.
При сильном взаимодействии между
молекулами, эффективное соударение
может, во-первых, существенно превышать
геометрическое, во-вторых, зависеть от
ряда факторов и прежде всего от
относительной скорости сближающихся
частиц. Будем считать, что все молекулы
газа неподвижны, кроме одной, которая
двигается со скоростью
– эффективным сечением соударения.
При сильном взаимодействии между
молекулами, эффективное соударение
может, во-первых, существенно превышать
геометрическое, во-вторых, зависеть от
ряда факторов и прежде всего от
относительной скорости сближающихся
частиц. Будем считать, что все молекулы
газа неподвижны, кроме одной, которая
двигается со скоростью
 .
Она проходит в единицу времени
путь
,
вырезая в пространстве цилиндр объемом
.
Она проходит в единицу времени
путь
,
вырезая в пространстве цилиндр объемом
 (рис. 2.5). При этом она испытывает
столкновения со всеми неподвижными
молекулами, находящимися в этом цилиндре.
Их количество и определяет число
соударений:
(рис. 2.5). При этом она испытывает
столкновения со всеми неподвижными
молекулами, находящимися в этом цилиндре.
Их количество и определяет число
соударений:
|
где – общая плотность молекул газа. Полное число соударений, испытываемых молекулой в единицу времени, вычисляется путем интегрирования этого выражения по всем возможным значениям : |
Рис. 2.5. |
Если сечение не зависит от относительной скорости, то с учетом (2.18) и (2.19) имеем
 , (2.20)
, (2.20)
 . (2.21)
. (2.21)
Это и есть число столкновений, испытываемое молекулой в 1 сек. Оно растет с увеличением температуры, плотности газа, размерами молекул и уменьшением их массы.



 ,
,