
- •Номенклатура
- •Химические свойства [править] Основные оксиды
- •[Править] Кислотные оксиды
- •[Править] Амфотерные оксиды
- •[Править] Получение
- •§5. Электронные облака - орбитали
- •Правило Хунда
- •[Править] Мнемоническое правило
- •Валентность
- •[Править] История возникновения понятия «валентность»
- •[Править] Современные представления о валентности
- •Химическая связь в молекулах и новая теория химической связи. Виды химической связи.
- •Химическая связь в молекулах объясняется только электрическим притяжением и отталкиванием.
- •Виды химической связи
- •При нашем способе расположения электронов отпадает необходимость в теории гибридизации орбиталей (да и вообще в самих орбиталях).
- •Откуда берётся деление химических элементов по периодам?
- •Новая теория химической связи, вытекающая непосредственно из устройства атомов
- •Химическая связь в металлах
- •Атом бора. Гидриды бора.
- •Строение молекулы бензола
- •Комплексные соединения платины
- •Функциональные группы и способ соединения в них атомов
- •Химические связи в группах. Карбоксильная группа и гидроксильная группа.
- •Химическая связь - история (то, что пишут в учебниках)
- •Важнейшие свойства химической связи
- •Тайна крещенской воды
- •3.2.4 Гибридизация атомных орбиталей
- •Силы Ван-дер-Ваальса
- •[Править] Классификация ван-дер-ваальсовых сил
- •Типы кристаллических решеток
- •Металлическая связь
- •[Править] Механизм металлической связи
- •[Править] Характерные кристаллические решётки
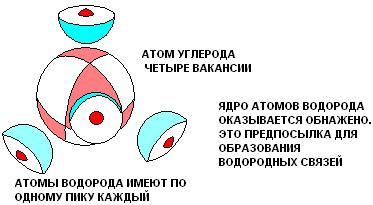
- •Водородная связь
- •[Править] Природа водородной связи
- •[Править] История
- •[Править] Свойства
- •[Править] Водородная связь в воде [править] Механизм Гротгуса
- •[Править] Водные кластеры
- •[Править] Водородная связь в нуклеиновых кислотах и белках
- •[Править] Водородная связь в полимерах
- •Структура воды
- •5) Термодинамическая фаза
- •[Править] Основные понятия
- •[Править] Термодинамические фазы на фазовой диаграмме
- •[Править] Термодинамические фазы и агрегатные состояния вещества
- •[Править] Выделение фаз
- •[Править] См. Также Внутренняя энергия
- •[Править] Идеальные газы
- •Термодинамика
- •[Править] Разделы термодинамики
- •[Править] Физический смысл термодинамики [править] Необходимость термодинамики
- •[Править] Законы — начала термодинамики
- •[Править] Основные формулы термодинамики [править] Условные обозначения
- •[Править] Формулы термодинамики идеального газа
- •[Править] Термодинамика сплошных сред
- •Закон Гесса
- •[Править] Следствия из закона Гесса
- •Термодинамическая энтропия
- •[Править] Термодинамическое определение энтропии
- •[Править] Статистическое определение энтропии: принцип Больцмана
- •[Править] Понимание энтропии как меры беспорядка
- •[Править] Границы применимости понимания энтропии как меры беспорядка
- •[Править] Энтропия в открытых системах
- •[Править] Измерение энтропии
- •[Править] Построение графика изменения энтропии
- •4.5. Энтропия
- •Энергия Гиббса
- •[Править] Определение
- •[Править] Связь с термодинамической устойчивостью системы
- •[Править] Применение в химии [править] Связь с химическим потенциалом
- •[Править] Энергия Гиббса и направление протекания реакции
- •2 Химическая кинетика и химическое равновесие
- •2.1 Кинетика химических реакций
- •Закон действующих масс
- •[Править] Закон действующих масс в химической кинетике
- •[Править] Закон действующих масс в химической термодинамике
- •6.1.3. Зависимость скорости реакции от температуры
- •Энергия активации
- •[Править] Математическое описание
- •[Править] Переходное состояние
- •5.2.Обратимые и необратимые процессы
- •Релаксация (физика)
- •[Править] Свойства и виды
- •[Править] Описание процесса релаксации [править] Для одноатомных газов
- •[Править] Для многоатомных газов
- •[Править] Для смесей газов
- •[Править] Для жидкостей
- •[Править] Для твёрдых тел и квантовых жидкостей
- •Динамические равновесия
- •Принцип Ле Шателье — Брауна
- •[Править] Влияние температуры
- •[Править] Влияние давления
- •Влияние инертных газов
- •5.1. Химическое равновесие в гомогенных системах
- •6. Растворы
- •6.1. Дисперсные системы. Растворы
- •Некоторые характеристики дисперсных систем
- •6.2. Процесс образования растворов. Тепловые эффекты при растворении
- •6.3. Растворимость
- •6.4. Способы выражения состава растворов
- •Способы выражения состава растворов
- •6.5. Разбавленные растворы неэлектролитов
- •6.5.1. Давление пара над растворами
- •6.5.2. Температура кипения и замерзания растворов
- •6.5.3. Осмотическое давление
- •6.6. Растворы электролитов. Основы теории электролитической диссоциации
- •6.6.1. Сильные и слабые электролиты
- •6.7. Равновесие в растворах слабых электролитов. Константа диссоциации
- •6.8. Основания, кислоты и соли в свете теории электролитической диссоциации
- •6.9. Ионное произведение воды
- •Окраска важнейших кислотно-основных индикаторов в различных средах
- •6.10. Произведение растворимости
- •6.11. Реакции обмена в растворах электролитов
- •6.12. Гидролиз солей
- •11. Химические свойства металлов
- •11.1. Общие положения
- •11.2. Физические свойства металлов
- •11.3. Получение металлов
- •11.3.1. Нахождение в природе
- •11.3.2. Общие методы получения металлов
- •11.3.3. Получение металлов высокой чистоты
- •11.4. Химические свойства металлов
- •11.4.1. Отношение металлов к окислителям - простым веществам
- •Щелочные металлы
- •[Править] Общая характеристика щелочных металлов
- •Некоторые свойства щелочных металлов
- •[Править] Химические свойства щелочных металлов
- •Окраска пламени щелочными металлами и их соединениями
- •[Править] Получение щелочных металлов
- •[Править] Соединения щелочных металлов [править] Гидроксиды
- •[Править] Карбонаты
- •[Править] Фотографии
- •[Править] Литература
- •[Править] Примечания
- •[Править] См. Также
- •[Править] Ссылки
- •13.Важнейшие классы неорганических веществ
- •13.1. Определения
- •13.2. Металлы
- •13.3. Неметаллы
- •13.4. Основные оксиды
- •13.5. Кислотные оксиды
- •13.6. Амфотерные оксиды
- •Окислительно-восстановительные реакции
- •[Править] Описание
- •[Править] Окисление
- •[Править] Восстановление
- •[Править] Виды окислительно-восстановительных реакций
- •[Править] Примеры [править] Окислительно-восстановительная реакция между водородом и фтором
- •[Править] Окисление, восстановление
- •[Править] Мнемонические правила
- •8. Электрохимические процессы
- •8.1. Гальванический элемент
- •8.2 Коррозия металлов
- •8.3. Электролиз
- •8.1. Гальванический элемент
- •8.1.1. Понятие об электродном потенциале
- •8.1.2. Гальванический элемент (гэ) даниэля-якоби
- •8.1.3. Напряжение гальванического элемента
- •8.1.4. Водородная шкала потенциалов
- •8.1.5. Потенциалы металлических электродов
- •8.1.6. Потенциалы газовых электродов
- •8.1.7.Поляризация в электрохимических процессах
- •8.2 Коррозия металлов
- •8.2.1.Химическая коррозия
- •8.2.2. Электрохимическая коррозия
- •Основные случаи возникновения коррозионных гальванических пар
- •8.2.3 Защита металлов от коррозии
- •8.3. Электролиз
- •8.3.1. Общие понятия
- •8.3.2. Электролиз расплавов электролитов
- •8.3.3. Электролиз растворов электролитов
- •8.3.4 Электролиз с растворимыми анодами
- •8.3.5. Законы электролиза
- •8.3.6. Применение электролиза
- •Электрохимическая коррозия
- •Газовая коррозия
- •Химическая коррозия в жидкостях-неэлектролитах
- •7.1.Коррозия металлов
- •7.2.Борьба с коррозией парогенераторов во время работы
- •7.3.Борьба со стояночной (кислородной) коррозией парогенераторов, находящихся в резерве или ремонте
- •7.4.Борьба с коррозией конденсатопроводов
- •7.5.Борьба с коррозией тепловых сетей
- •7.6.Защита от коррозии водоподготовительного оборудования
- •7.7.Удаление отложений
- •§ 36. Воздушная известь
- •А. Воздушные вяжущие вещества
- •Б. Гидравлические вяжущие вещества
Химическая связь в металлах
Нарисуем
схематично два атома металлов.
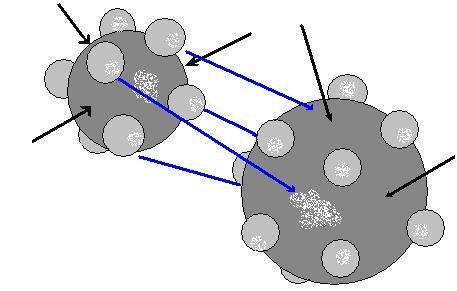
 Чёрными
стрелками обозначены места вакансий,
которых у металлов достаточно много.
Синими – возможное соединение металлов
(для примера взяты два разных металла)
при образовании сплава. То есть электроны
занимают вакантные места в другом
атоме.
Чёрными
стрелками обозначены места вакансий,
которых у металлов достаточно много.
Синими – возможное соединение металлов
(для примера взяты два разных металла)
при образовании сплава. То есть электроны
занимают вакантные места в другом
атоме.
Такова
в общих чертах новая теория химической
связи, не основанная на квантовых
представлениях, но использующая,
например, Льюисовы структуры.
Рисунки сложных
молекул приведены ниже.
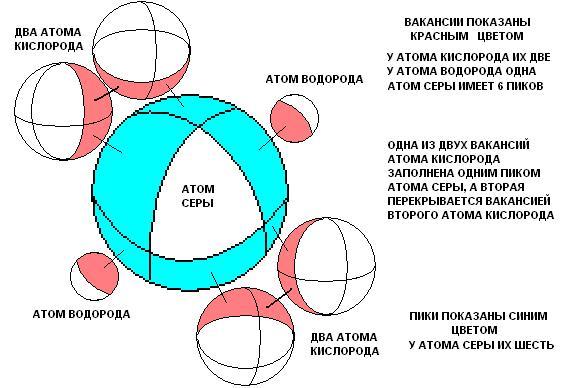 Глядя
на рисунок, становится ясным, почему
серная кислота при замещении атомов
водорода другими ионами, сохраняет в
остальном свою целостность. Здесь особая
роль оказывается у вакантной (В-В) связи
между атомами кислорода. Сила этой
кислоты также может быть объяснена.
Видим, что на атоме серы верхний
электронный слой отдан в вакантные
области других атомов. Вернитесь немного
назад и посмотрите ещё раз график. Так
как масса атома водорода мала, то
потенциальная яма будет не глубокой, и
видимо в этом причина того, что водород
достаточно легко замещается другими
атомами. Думаю, что весь ряд
электрического напряжения можно
объяснить используя этот подход и,
конечно, учитывая влияние электронов
в атомах реагентов (их отталкивание с
электронами молекулы серной кислоты
). Ещё раз приведём этот рисунок, с
той лишь целью, чтобы показать причины
объединения двух и более молекул серной
кислоты в жидкость.
Р
Глядя
на рисунок, становится ясным, почему
серная кислота при замещении атомов
водорода другими ионами, сохраняет в
остальном свою целостность. Здесь особая
роль оказывается у вакантной (В-В) связи
между атомами кислорода. Сила этой
кислоты также может быть объяснена.
Видим, что на атоме серы верхний
электронный слой отдан в вакантные
области других атомов. Вернитесь немного
назад и посмотрите ещё раз график. Так
как масса атома водорода мала, то
потенциальная яма будет не глубокой, и
видимо в этом причина того, что водород
достаточно легко замещается другими
атомами. Думаю, что весь ряд
электрического напряжения можно
объяснить используя этот подход и,
конечно, учитывая влияние электронов
в атомах реагентов (их отталкивание с
электронами молекулы серной кислоты
). Ещё раз приведём этот рисунок, с
той лишь целью, чтобы показать причины
объединения двух и более молекул серной
кислоты в жидкость.
Р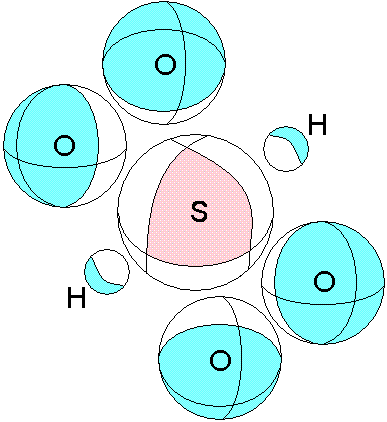 озовым
показана область с частично положительным
зарядом (атом серы без 6 электронов).
Голубым показаны областис частично
отрицательным зарядом. Такие области
двух разных молекул взаимодействуют,
что и приводит к образованию вещества.
Расположение этих областей и распределение
(величина) заряда в них ответственны за
агрегатное состояние образующегося
вещества, в данном случае жидкое. Если
бы сила положительной области была
меньше, то образовывался бы газ. В том
случае когда обе области, и положительная
и отрицательная имеют значительную
величину, и распределены более
неравномерно, образуются твердые
вещества.
озовым
показана область с частично положительным
зарядом (атом серы без 6 электронов).
Голубым показаны областис частично
отрицательным зарядом. Такие области
двух разных молекул взаимодействуют,
что и приводит к образованию вещества.
Расположение этих областей и распределение
(величина) заряда в них ответственны за
агрегатное состояние образующегося
вещества, в данном случае жидкое. Если
бы сила положительной области была
меньше, то образовывался бы газ. В том
случае когда обе области, и положительная
и отрицательная имеют значительную
величину, и распределены более
неравномерно, образуются твердые
вещества.
Такой
углеводород как метан.
 Вернёмся
к одной из самых, как кажется, простых
молекул. Вода, в нашей интерпретации,
будет выглядеть следующим образом.
Вернёмся
к одной из самых, как кажется, простых
молекул. Вода, в нашей интерпретации,
будет выглядеть следующим образом.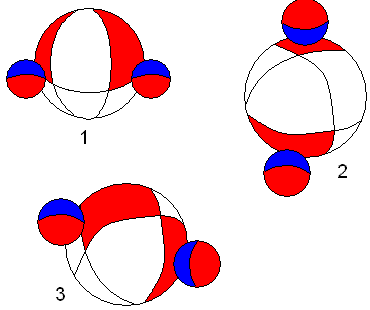
Молекула воды. На рисунке показаны три варианта химических связей атомов водорода с атомом кислорода. Рисунок объясняет разнообразие свойств воды, в том числе энергоинформационные. В первом случае обе связи вакантные. Во втором пиковые. В третьем случае, одна связь вакантная, другая пиковая. С учётом возможного соединения этих трёх видов молекул воды между собой, можно объяснить такие необычные свойства жидкости жизни. Может возникнуть обманчивое впечатление, что притягиваются между собой две вакантные области. Это конечно не так. Имеющиеся в атоме электроны занимают вакантную область второго атома, а его электроны оказываются в вакантной области первого атома. Приведённые нами обозначения используются для простоты изложения, но никогда нельзя забывать об их схематичности.
Легко понять, что вакантная связь будет являться более прочной по сравнению с вакантно-пиковой, так как она, по сути, состоит из двух вакантно- пиковых. Какие надо выдумать гибридизации и многоцентровости связей, чтобы объяснить такое разнообразие свойств воды? В нашем случае, думаю, многое понятно из рассмотрения рисунка.
Чтобы
с помощью формул показать молекулы
веществ, пришлось ввести новые обозначения,
для вакансий. Для пиков мы оставили
старое обозначение, используемое ранее
для электронов. Например, азотная
кислота, с использованием новой
номенклатуры будет выглядеть так.
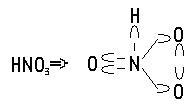 И
здесь, как и в случае с серной кислотой,
легче всего замещается атом водорода.
Остальные связи, то есть в комплексе,
оказываются значительно сильнее.
И
здесь, как и в случае с серной кислотой,
легче всего замещается атом водорода.
Остальные связи, то есть в комплексе,
оказываются значительно сильнее.
Думаю, что ненужность гибридизации орбиталей мы уже показали. Теперь развенчаем миф о многоцентровости связей.
