
- •Номенклатура
- •Химические свойства [править] Основные оксиды
- •[Править] Кислотные оксиды
- •[Править] Амфотерные оксиды
- •[Править] Получение
- •§5. Электронные облака - орбитали
- •Правило Хунда
- •[Править] Мнемоническое правило
- •Валентность
- •[Править] История возникновения понятия «валентность»
- •[Править] Современные представления о валентности
- •Химическая связь в молекулах и новая теория химической связи. Виды химической связи.
- •Химическая связь в молекулах объясняется только электрическим притяжением и отталкиванием.
- •Виды химической связи
- •При нашем способе расположения электронов отпадает необходимость в теории гибридизации орбиталей (да и вообще в самих орбиталях).
- •Откуда берётся деление химических элементов по периодам?
- •Новая теория химической связи, вытекающая непосредственно из устройства атомов
- •Химическая связь в металлах
- •Атом бора. Гидриды бора.
- •Строение молекулы бензола
- •Комплексные соединения платины
- •Функциональные группы и способ соединения в них атомов
- •Химические связи в группах. Карбоксильная группа и гидроксильная группа.
- •Химическая связь - история (то, что пишут в учебниках)
- •Важнейшие свойства химической связи
- •Тайна крещенской воды
- •3.2.4 Гибридизация атомных орбиталей
- •Силы Ван-дер-Ваальса
- •[Править] Классификация ван-дер-ваальсовых сил
- •Типы кристаллических решеток
- •Металлическая связь
- •[Править] Механизм металлической связи
- •[Править] Характерные кристаллические решётки
- •Водородная связь
- •[Править] Природа водородной связи
- •[Править] История
- •[Править] Свойства
- •[Править] Водородная связь в воде [править] Механизм Гротгуса
- •[Править] Водные кластеры
- •[Править] Водородная связь в нуклеиновых кислотах и белках
- •[Править] Водородная связь в полимерах
- •Структура воды
- •5) Термодинамическая фаза
- •[Править] Основные понятия
- •[Править] Термодинамические фазы на фазовой диаграмме
- •[Править] Термодинамические фазы и агрегатные состояния вещества
- •[Править] Выделение фаз
- •[Править] См. Также Внутренняя энергия
- •[Править] Идеальные газы
- •Термодинамика
- •[Править] Разделы термодинамики
- •[Править] Физический смысл термодинамики [править] Необходимость термодинамики
- •[Править] Законы — начала термодинамики
- •[Править] Основные формулы термодинамики [править] Условные обозначения
- •[Править] Формулы термодинамики идеального газа
- •[Править] Термодинамика сплошных сред
- •Закон Гесса
- •[Править] Следствия из закона Гесса
- •Термодинамическая энтропия
- •[Править] Термодинамическое определение энтропии
- •[Править] Статистическое определение энтропии: принцип Больцмана
- •[Править] Понимание энтропии как меры беспорядка
- •[Править] Границы применимости понимания энтропии как меры беспорядка
- •[Править] Энтропия в открытых системах
- •[Править] Измерение энтропии
- •[Править] Построение графика изменения энтропии
- •4.5. Энтропия
- •Энергия Гиббса
- •[Править] Определение
- •[Править] Связь с термодинамической устойчивостью системы
- •[Править] Применение в химии [править] Связь с химическим потенциалом
- •[Править] Энергия Гиббса и направление протекания реакции
- •2 Химическая кинетика и химическое равновесие
- •2.1 Кинетика химических реакций
- •Закон действующих масс
- •[Править] Закон действующих масс в химической кинетике
- •[Править] Закон действующих масс в химической термодинамике
- •6.1.3. Зависимость скорости реакции от температуры
- •Энергия активации
- •[Править] Математическое описание
- •[Править] Переходное состояние
- •5.2.Обратимые и необратимые процессы
- •Релаксация (физика)
- •[Править] Свойства и виды
- •[Править] Описание процесса релаксации [править] Для одноатомных газов
- •[Править] Для многоатомных газов
- •[Править] Для смесей газов
- •[Править] Для жидкостей
- •[Править] Для твёрдых тел и квантовых жидкостей
- •Динамические равновесия
- •Принцип Ле Шателье — Брауна
- •[Править] Влияние температуры
- •[Править] Влияние давления
- •Влияние инертных газов
- •5.1. Химическое равновесие в гомогенных системах
- •6. Растворы
- •6.1. Дисперсные системы. Растворы
- •Некоторые характеристики дисперсных систем
- •6.2. Процесс образования растворов. Тепловые эффекты при растворении
- •6.3. Растворимость
- •6.4. Способы выражения состава растворов
- •Способы выражения состава растворов
- •6.5. Разбавленные растворы неэлектролитов
- •6.5.1. Давление пара над растворами
- •6.5.2. Температура кипения и замерзания растворов
- •6.5.3. Осмотическое давление
- •6.6. Растворы электролитов. Основы теории электролитической диссоциации
- •6.6.1. Сильные и слабые электролиты
- •6.7. Равновесие в растворах слабых электролитов. Константа диссоциации
- •6.8. Основания, кислоты и соли в свете теории электролитической диссоциации
- •6.9. Ионное произведение воды
- •Окраска важнейших кислотно-основных индикаторов в различных средах
- •6.10. Произведение растворимости
- •6.11. Реакции обмена в растворах электролитов
- •6.12. Гидролиз солей
- •11. Химические свойства металлов
- •11.1. Общие положения
- •11.2. Физические свойства металлов
- •11.3. Получение металлов
- •11.3.1. Нахождение в природе
- •11.3.2. Общие методы получения металлов
- •11.3.3. Получение металлов высокой чистоты
- •11.4. Химические свойства металлов
- •11.4.1. Отношение металлов к окислителям - простым веществам
- •Щелочные металлы
- •[Править] Общая характеристика щелочных металлов
- •Некоторые свойства щелочных металлов
- •[Править] Химические свойства щелочных металлов
- •Окраска пламени щелочными металлами и их соединениями
- •[Править] Получение щелочных металлов
- •[Править] Соединения щелочных металлов [править] Гидроксиды
- •[Править] Карбонаты
- •[Править] Фотографии
- •[Править] Литература
- •[Править] Примечания
- •[Править] См. Также
- •[Править] Ссылки
- •13.Важнейшие классы неорганических веществ
- •13.1. Определения
- •13.2. Металлы
- •13.3. Неметаллы
- •13.4. Основные оксиды
- •13.5. Кислотные оксиды
- •13.6. Амфотерные оксиды
- •Окислительно-восстановительные реакции
- •[Править] Описание
- •[Править] Окисление
- •[Править] Восстановление
- •[Править] Виды окислительно-восстановительных реакций
- •[Править] Примеры [править] Окислительно-восстановительная реакция между водородом и фтором
- •[Править] Окисление, восстановление
- •[Править] Мнемонические правила
- •8. Электрохимические процессы
- •8.1. Гальванический элемент
- •8.2 Коррозия металлов
- •8.3. Электролиз
- •8.1. Гальванический элемент
- •8.1.1. Понятие об электродном потенциале
- •8.1.2. Гальванический элемент (гэ) даниэля-якоби
- •8.1.3. Напряжение гальванического элемента
- •8.1.4. Водородная шкала потенциалов
- •8.1.5. Потенциалы металлических электродов
- •8.1.6. Потенциалы газовых электродов
- •8.1.7.Поляризация в электрохимических процессах
- •8.2 Коррозия металлов
- •8.2.1.Химическая коррозия
- •8.2.2. Электрохимическая коррозия
- •Основные случаи возникновения коррозионных гальванических пар
- •8.2.3 Защита металлов от коррозии
- •8.3. Электролиз
- •8.3.1. Общие понятия
- •8.3.2. Электролиз расплавов электролитов
- •8.3.3. Электролиз растворов электролитов
- •8.3.4 Электролиз с растворимыми анодами
- •8.3.5. Законы электролиза
- •8.3.6. Применение электролиза
- •Электрохимическая коррозия
- •Газовая коррозия
- •Химическая коррозия в жидкостях-неэлектролитах
- •7.1.Коррозия металлов
- •7.2.Борьба с коррозией парогенераторов во время работы
- •7.3.Борьба со стояночной (кислородной) коррозией парогенераторов, находящихся в резерве или ремонте
- •7.4.Борьба с коррозией конденсатопроводов
- •7.5.Борьба с коррозией тепловых сетей
- •7.6.Защита от коррозии водоподготовительного оборудования
- •7.7.Удаление отложений
- •§ 36. Воздушная известь
- •А. Воздушные вяжущие вещества
- •Б. Гидравлические вяжущие вещества
11. Химические свойства металлов
11.1. ОБЩИЕ ПОЛОЖЕНИЯ
11.2. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
11.3. ПОЛУЧЕНИЕ МЕТАЛЛОВ
11.4. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
11.1. Общие положения
К металлам относят простые вещества, образованные атомами элементов, имеющих небольшое число (от 1 до 4) электронов на внешнем энергетическом уровне. Атомы металлов обладают тенденцией к отдаче электронов, поэтому для них характерна высокая восстановительная активность, определяющаяся низкими значениями энергии ионизации (Eи) валентных электронов атомов. Известно, что в пределах одного периода величина Eи возрастает с увеличением порядкового номера элемента, а в главных подгруппах - уменьшается. Такая тенденция изменения восстановительной активности атомов и объясняет тот факт, что элементы-металлы находятся в Периодической системе (длиннопериодный вариант) левее диагонали "бор - астат".
К металлам относят s-элементы (за исключением H и He), d- и f-элементы, а также p-элементы, расположенные левее и ниже указанной диагонали (т.е. более 80% элементов, входящих в ПС). При этом следует помнить, что деление элементов на металлы и неметаллы является условным (об этом свидетельствует наличие так называемых амфотерных элементов, которые группируются у отмеченной выше диагонали). Для них характерна малая электроотрицательность (ЭО) (в рамках шкалы ЭО по Полингу считают, что для атомов металлов величина ЭО меньше 2). Этим обусловлена способность атомов металлов образовывать центры только положительных зарядов в молекулах, элементарных и сложных ионах:
![]() .
.
11.2. Физические свойства металлов
В простых веществах, образованных атомами элементов-металлов, доминирующим типом химической связи является металлическая. Металл рассматривают как плотно упакованную структуру из катионов, погруженных в “электронный газ” (газ Ферми) (более подробно см. главу “Химическая связь”). Наличие в металлах свободных электронов (электронного газа) определяет общие для всех металлов физические свойства: высокую электро- и теплопроводность, металлический блеск (как правило в компактном состоянии), преимущественно серый цвет (исключения - Cu, Au); легкую механическую деформируемость (пластичность) и ковкость; способность испускать электроны под действием высокочастотного облучения (фотоэффект) или высоких температур (термоэлектронная эмиссия); компактность кристаллических структур.
Наряду с общими свойствами каждый металл имеет и свои индивидуальные особенности. К ним относят: строение кристаллических решеток; для металлов характерны, в основном, три вида решеток: кубическая объемно-центрированная (координационное число 8, плотность упаковки или часть пространства в данном кубе, занятая шарообразными ионами, составляет 68%); кубическая гранецентрированная (координационное число 12 и плотность упаковки 74%) и гексагональная (координационное число 12 и плотность упаковки также 74%). (См. гл. “Химическая связь”).
Особенности кристаллических решеток металлического типа обусловливают характерные физические свойства металлов. Так, железо имеет четыре полиморфные модификации (рис.11.1).
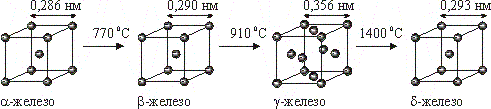
Рис. 11.1. Полиморфные превращения железа.
До 770 C устойчиво a-железо с объемно-центрированной кубической решеткой и ферромагнитными свойствами. При 770 C -Fe переходит в -Fe; кристаллическая структура его существенно не изменяется, железо становится парамагнитным. При 910 C происходит полиморфное превращение, при котором кристалл из объемно-центрированной переходит в гранецентрированную кубическую структуру -Fe: металл остается парамагнитным. При 1400 C происходит новый полиморфный переход: образуется -Fe с объемно-центрированной кубической решеткой, которая существует вплоть до температуры плавления железа (1539 C).
Плотность металлов (). Она определяется типом кристаллической решетки металла и радиусом его атома. Чем больше радиус атома металла, тем меньше его плотность. Наименьшие объемы (следовательно, наибольшую плотность) имеют атомы, расположенные в середине периодов: - Co, Ni, Cu (4 период); Ru, Rh, Pd (5 период); Os, Ir, Pt (6 период). Условно металлы подразделяют на легкие - < 5000 кг/м3 (5 г/см3) и тяжелые > 5000 кг/м3 (5 г/см3). К легким металлам относят щелочные, щелочноземельные металлы, бериллий, магний, алюминий, скандий, иттрий и титан; к тяжелым - все остальные.
Температура плавления. Из всех известных металлов при стандартных условиях в жидком состоянии находится только ртуть (t = -39,2 С). Наиболее легкоплавкими из них являются Cs (28,5 C); Ga (29,78 C); и Rb (39 C).
В малых периодах температуры плавления металлов с увеличением порядкового номера элемента возрастают, что связано с увеличением плотности упаковки кристаллической решетки металла. В больших периодах по этой же причине температура плавления увеличивается до середины периода, а затем уменьшается. Следовательно, самые тугоплавкие металлы, например, вольфрам (t = 3422 °С) находятся в середине больших периодов.
Пластичность. Наличие свободных электронов в структуре металла допускает смещение ионов, расположенных в узлах кристаллической решетки, без разрыва химической связи между ними. Благодаря этому металлы обладают способностью сохранять деформацию, изменять форму под воздействием механических нагрузок, не разрушаясь, прокатываться в листы и проволоку. Наиболее пластичные металлы: Au, Ag, Cu, Sn, Pb, Zn, Fe и др.
Электро- и теплопроводность. Для металлов характерны высокие значения электро- и теплопроводности. Наибольшей электропроводностью обладают Ag, Cu, Au, Al, Fe и др.
Кроме перечисленных общих и индивидуальных физических свойств металлов, можно выделить и другие их характеристики: электромагнитные, оптические и механические.
