
- •Номенклатура
- •Химические свойства [править] Основные оксиды
- •[Править] Кислотные оксиды
- •[Править] Амфотерные оксиды
- •[Править] Получение
- •§5. Электронные облака - орбитали
- •Правило Хунда
- •[Править] Мнемоническое правило
- •Валентность
- •[Править] История возникновения понятия «валентность»
- •[Править] Современные представления о валентности
- •Химическая связь в молекулах и новая теория химической связи. Виды химической связи.
- •Химическая связь в молекулах объясняется только электрическим притяжением и отталкиванием.
- •Виды химической связи
- •При нашем способе расположения электронов отпадает необходимость в теории гибридизации орбиталей (да и вообще в самих орбиталях).
- •Откуда берётся деление химических элементов по периодам?
- •Новая теория химической связи, вытекающая непосредственно из устройства атомов
- •Химическая связь в металлах
- •Атом бора. Гидриды бора.
- •Строение молекулы бензола
- •Комплексные соединения платины
- •Функциональные группы и способ соединения в них атомов
- •Химические связи в группах. Карбоксильная группа и гидроксильная группа.
- •Химическая связь - история (то, что пишут в учебниках)
- •Важнейшие свойства химической связи
- •Тайна крещенской воды
- •3.2.4 Гибридизация атомных орбиталей
- •Силы Ван-дер-Ваальса
- •[Править] Классификация ван-дер-ваальсовых сил
- •Типы кристаллических решеток
- •Металлическая связь
- •[Править] Механизм металлической связи
- •[Править] Характерные кристаллические решётки
- •Водородная связь
- •[Править] Природа водородной связи
- •[Править] История
- •[Править] Свойства
- •[Править] Водородная связь в воде [править] Механизм Гротгуса
- •[Править] Водные кластеры
- •[Править] Водородная связь в нуклеиновых кислотах и белках
- •[Править] Водородная связь в полимерах
- •Структура воды
- •5) Термодинамическая фаза
- •[Править] Основные понятия
- •[Править] Термодинамические фазы на фазовой диаграмме
- •[Править] Термодинамические фазы и агрегатные состояния вещества
- •[Править] Выделение фаз
- •[Править] См. Также Внутренняя энергия
- •[Править] Идеальные газы
- •Термодинамика
- •[Править] Разделы термодинамики
- •[Править] Физический смысл термодинамики [править] Необходимость термодинамики
- •[Править] Законы — начала термодинамики
- •[Править] Основные формулы термодинамики [править] Условные обозначения
- •[Править] Формулы термодинамики идеального газа
- •[Править] Термодинамика сплошных сред
- •Закон Гесса
- •[Править] Следствия из закона Гесса
- •Термодинамическая энтропия
- •[Править] Термодинамическое определение энтропии
- •[Править] Статистическое определение энтропии: принцип Больцмана
- •[Править] Понимание энтропии как меры беспорядка
- •[Править] Границы применимости понимания энтропии как меры беспорядка
- •[Править] Энтропия в открытых системах
- •[Править] Измерение энтропии
- •[Править] Построение графика изменения энтропии
- •4.5. Энтропия
- •Энергия Гиббса
- •[Править] Определение
- •[Править] Связь с термодинамической устойчивостью системы
- •[Править] Применение в химии [править] Связь с химическим потенциалом
- •[Править] Энергия Гиббса и направление протекания реакции
- •2 Химическая кинетика и химическое равновесие
- •2.1 Кинетика химических реакций
- •Закон действующих масс
- •[Править] Закон действующих масс в химической кинетике
- •[Править] Закон действующих масс в химической термодинамике
- •6.1.3. Зависимость скорости реакции от температуры
- •Энергия активации
- •[Править] Математическое описание
- •[Править] Переходное состояние
- •5.2.Обратимые и необратимые процессы
- •Релаксация (физика)
- •[Править] Свойства и виды
- •[Править] Описание процесса релаксации [править] Для одноатомных газов
- •[Править] Для многоатомных газов
- •[Править] Для смесей газов
- •[Править] Для жидкостей
- •[Править] Для твёрдых тел и квантовых жидкостей
- •Динамические равновесия
- •Принцип Ле Шателье — Брауна
- •[Править] Влияние температуры
- •[Править] Влияние давления
- •Влияние инертных газов
- •5.1. Химическое равновесие в гомогенных системах
- •6. Растворы
- •6.1. Дисперсные системы. Растворы
- •Некоторые характеристики дисперсных систем
- •6.2. Процесс образования растворов. Тепловые эффекты при растворении
- •6.3. Растворимость
- •6.4. Способы выражения состава растворов
- •Способы выражения состава растворов
- •6.5. Разбавленные растворы неэлектролитов
- •6.5.1. Давление пара над растворами
- •6.5.2. Температура кипения и замерзания растворов
- •6.5.3. Осмотическое давление
- •6.6. Растворы электролитов. Основы теории электролитической диссоциации
- •6.6.1. Сильные и слабые электролиты
- •6.7. Равновесие в растворах слабых электролитов. Константа диссоциации
- •6.8. Основания, кислоты и соли в свете теории электролитической диссоциации
- •6.9. Ионное произведение воды
- •Окраска важнейших кислотно-основных индикаторов в различных средах
- •6.10. Произведение растворимости
- •6.11. Реакции обмена в растворах электролитов
- •6.12. Гидролиз солей
- •11. Химические свойства металлов
- •11.1. Общие положения
- •11.2. Физические свойства металлов
- •11.3. Получение металлов
- •11.3.1. Нахождение в природе
- •11.3.2. Общие методы получения металлов
- •11.3.3. Получение металлов высокой чистоты
- •11.4. Химические свойства металлов
- •11.4.1. Отношение металлов к окислителям - простым веществам
- •Щелочные металлы
- •[Править] Общая характеристика щелочных металлов
- •Некоторые свойства щелочных металлов
- •[Править] Химические свойства щелочных металлов
- •Окраска пламени щелочными металлами и их соединениями
- •[Править] Получение щелочных металлов
- •[Править] Соединения щелочных металлов [править] Гидроксиды
- •[Править] Карбонаты
- •[Править] Фотографии
- •[Править] Литература
- •[Править] Примечания
- •[Править] См. Также
- •[Править] Ссылки
- •13.Важнейшие классы неорганических веществ
- •13.1. Определения
- •13.2. Металлы
- •13.3. Неметаллы
- •13.4. Основные оксиды
- •13.5. Кислотные оксиды
- •13.6. Амфотерные оксиды
- •Окислительно-восстановительные реакции
- •[Править] Описание
- •[Править] Окисление
- •[Править] Восстановление
- •[Править] Виды окислительно-восстановительных реакций
- •[Править] Примеры [править] Окислительно-восстановительная реакция между водородом и фтором
- •[Править] Окисление, восстановление
- •[Править] Мнемонические правила
- •8. Электрохимические процессы
- •8.1. Гальванический элемент
- •8.2 Коррозия металлов
- •8.3. Электролиз
- •8.1. Гальванический элемент
- •8.1.1. Понятие об электродном потенциале
- •8.1.2. Гальванический элемент (гэ) даниэля-якоби
- •8.1.3. Напряжение гальванического элемента
- •8.1.4. Водородная шкала потенциалов
- •8.1.5. Потенциалы металлических электродов
- •8.1.6. Потенциалы газовых электродов
- •8.1.7.Поляризация в электрохимических процессах
- •8.2 Коррозия металлов
- •8.2.1.Химическая коррозия
- •8.2.2. Электрохимическая коррозия
- •Основные случаи возникновения коррозионных гальванических пар
- •8.2.3 Защита металлов от коррозии
- •8.3. Электролиз
- •8.3.1. Общие понятия
- •8.3.2. Электролиз расплавов электролитов
- •8.3.3. Электролиз растворов электролитов
- •8.3.4 Электролиз с растворимыми анодами
- •8.3.5. Законы электролиза
- •8.3.6. Применение электролиза
- •Электрохимическая коррозия
- •Газовая коррозия
- •Химическая коррозия в жидкостях-неэлектролитах
- •7.1.Коррозия металлов
- •7.2.Борьба с коррозией парогенераторов во время работы
- •7.3.Борьба со стояночной (кислородной) коррозией парогенераторов, находящихся в резерве или ремонте
- •7.4.Борьба с коррозией конденсатопроводов
- •7.5.Борьба с коррозией тепловых сетей
- •7.6.Защита от коррозии водоподготовительного оборудования
- •7.7.Удаление отложений
- •§ 36. Воздушная известь
- •А. Воздушные вяжущие вещества
- •Б. Гидравлические вяжущие вещества
[Править] Примеры [править] Окислительно-восстановительная реакция между водородом и фтором
![]()
Разделяется на две полуреакции:
1) Окисление:
![]()
2) Восстановление:
![]()
[Править] Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
![]()
![]()
![]()
![]()
![]()
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
![]()
![]()
![]()
![]()
![]()
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
[Править] Мнемонические правила
Для запоминания процессов окисления-восстановления, а также свойств окислителей и восстановителей существует несколько мнемонических правил:
-
Отдать — Окислиться, Взять — Восстановиться (слова начинаются с одинаковых букв).
-
При отдавании кем-либо чего-либо полезного — кислое, опущенное выражение лица, при получении — воспрявшее, восстановленное.
-
Окислитель — грабитель (в процессе окислительно-восстановительной реакции окислитель присоединяет электроны).
8. Электрохимические процессы
8.1. Гальванический элемент
8.1.1. ПОНЯТИЕ ОБ ЭЛЕКТРОДНОМ ПОТЕНЦИАЛЕ
8.1.2. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ (ГЭ) ДАНИЭЛЯ-ЯКОБИ
8.1.3. НАПРЯЖЕНИЕ ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
8.1.4. ВОДОРОДНАЯ ШКАЛА ПОТЕНЦИАЛОВ
8.1.5. ПОТЕНЦИАЛЫ МЕТАЛЛИЧЕСКИХ ЭЛЕКТРОДОВ
8.1.6. ПОТЕНЦИАЛЫ ГАЗОВЫХ ЭЛЕКТРОДОВ
8.1.7.ПОЛЯРИЗАЦИЯ В ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССАХ
8.2 Коррозия металлов
8.2.1.ХИМИЧЕСКАЯ КОРРОЗИЯ
8.2.2. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
8.2.3 ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
8.3. Электролиз
8.3.1. ОБЩИЕ ПОНЯТИЯ
8.3.2. ЭЛЕКТРОЛИЗ РАСПЛАВОВ ЭЛЕКТРОЛИТОВ
8.3.3. ЭЛЕКТРОЛИЗ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
8.3.4 ЭЛЕКТРОЛИЗ С РАСТВОРИМЫМИ АНОДАМИ
8.3.5. ЗАКОНЫ ЭЛЕКТРОЛИЗА
8.3.6. ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА
Процессы взаимного превращения химической и электрохимической форм энергии называют электрохимическими.
Электрохимические процессы можно разделить на две основные группы:
-
процессы превращения химической энергии в электрическую (в гальванических элементах, при электрохимической коррозии, в электрохимическом аккумуляторе: цикл - разряд);
-
процессы превращения электрической энергии в химическую (при электролизе, в электрохимическом аккумуляторе: цикл - заряд).
8.1. Гальванический элемент
8.1.1. Понятие об электродном потенциале
Рассмотрим процессы, протекающие при погружении металла в раствор собственных ионов. Металлы имеют кристаллическое строение. В узлах решеток расположены ион-атомы, находящиеся в равновесии со свободными электронами:
![]()
При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора. Наиболее важной реакцией является взаимодействие поверхностных ион-атомов металла, находящихся в узлах решетки, с полярными молекулами растворителя (воды), ориентированными у поверхности электрода. В результате указанного процесса происходит окисление металла, и его сольватированные (гидратированные) ионы переходят в раствор, оставляя в металле электроны, заряд которых не скомпенсирован положительно заряженными ионами в металле:
![]()
Металл с поверхности становится заряженным отрицательно, а раствор - положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла. На границе металл - раствор возникает двойной электрический слой (рис.8.1).
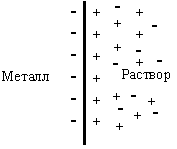
Рис.8. 1. Двойной электрический слой на границе раздела металл - раствор.
Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом (ЭП) или потенциалом электрода и обозначается . По мере перехода ионов в раствор растет отрицательный заряд поверхности металла и положительный заряд раствора, что препятствует дальнейшему окислению металла. Наряду с этой реакцией протекает обратная реакция - восстановление ионов металла до атомов.
![]()
С увеличением скачка потенциала между электродом и раствором скорость прямой реакции падает, а обратной реакции растет. При некотором значении электродного потенциала ( ) скорость прямого процесса будет равна скорости обратного процесса. При этом устанавливается равновесие:
![]()
Для упрощения гидратационную воду обычно в уравнение реакции не включают и его записывают в виде:
![]()
Равновесие имеет динамический характер, т.е. процессы при равновесии идут с одинаковой скоростью в прямом и обратном направлениях. Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом. Абсолютные значения ЭП экспериментально определить невозможно. Однако можно определить их разность. Для характеристики электродных процессов пользуются относительными значениями ЭП. Для этого находят разность потенциалов измеряемого электрода и электрода, который принят за эталон.
