
- •Номенклатура
- •Химические свойства [править] Основные оксиды
- •[Править] Кислотные оксиды
- •[Править] Амфотерные оксиды
- •[Править] Получение
- •§5. Электронные облака - орбитали
- •Правило Хунда
- •[Править] Мнемоническое правило
- •Валентность
- •[Править] История возникновения понятия «валентность»
- •[Править] Современные представления о валентности
- •Химическая связь в молекулах и новая теория химической связи. Виды химической связи.
- •Химическая связь в молекулах объясняется только электрическим притяжением и отталкиванием.
- •Виды химической связи
- •При нашем способе расположения электронов отпадает необходимость в теории гибридизации орбиталей (да и вообще в самих орбиталях).
- •Откуда берётся деление химических элементов по периодам?
- •Новая теория химической связи, вытекающая непосредственно из устройства атомов
- •Химическая связь в металлах
- •Атом бора. Гидриды бора.
- •Строение молекулы бензола
- •Комплексные соединения платины
- •Функциональные группы и способ соединения в них атомов
- •Химические связи в группах. Карбоксильная группа и гидроксильная группа.
- •Химическая связь - история (то, что пишут в учебниках)
- •Важнейшие свойства химической связи
- •Тайна крещенской воды
- •3.2.4 Гибридизация атомных орбиталей
- •Силы Ван-дер-Ваальса
- •[Править] Классификация ван-дер-ваальсовых сил
- •Типы кристаллических решеток
- •Металлическая связь
- •[Править] Механизм металлической связи
- •[Править] Характерные кристаллические решётки
- •Водородная связь
- •[Править] Природа водородной связи
- •[Править] История
- •[Править] Свойства
- •[Править] Водородная связь в воде [править] Механизм Гротгуса
- •[Править] Водные кластеры
- •[Править] Водородная связь в нуклеиновых кислотах и белках
- •[Править] Водородная связь в полимерах
- •Структура воды
- •5) Термодинамическая фаза
- •[Править] Основные понятия
- •[Править] Термодинамические фазы на фазовой диаграмме
- •[Править] Термодинамические фазы и агрегатные состояния вещества
- •[Править] Выделение фаз
- •[Править] См. Также Внутренняя энергия
- •[Править] Идеальные газы
- •Термодинамика
- •[Править] Разделы термодинамики
- •[Править] Физический смысл термодинамики [править] Необходимость термодинамики
- •[Править] Законы — начала термодинамики
- •[Править] Основные формулы термодинамики [править] Условные обозначения
- •[Править] Формулы термодинамики идеального газа
- •[Править] Термодинамика сплошных сред
- •Закон Гесса
- •[Править] Следствия из закона Гесса
- •Термодинамическая энтропия
- •[Править] Термодинамическое определение энтропии
- •[Править] Статистическое определение энтропии: принцип Больцмана
- •[Править] Понимание энтропии как меры беспорядка
- •[Править] Границы применимости понимания энтропии как меры беспорядка
- •[Править] Энтропия в открытых системах
- •[Править] Измерение энтропии
- •[Править] Построение графика изменения энтропии
- •4.5. Энтропия
- •Энергия Гиббса
- •[Править] Определение
- •[Править] Связь с термодинамической устойчивостью системы
- •[Править] Применение в химии [править] Связь с химическим потенциалом
- •[Править] Энергия Гиббса и направление протекания реакции
- •2 Химическая кинетика и химическое равновесие
- •2.1 Кинетика химических реакций
- •Закон действующих масс
- •[Править] Закон действующих масс в химической кинетике
- •[Править] Закон действующих масс в химической термодинамике
- •6.1.3. Зависимость скорости реакции от температуры
- •Энергия активации
- •[Править] Математическое описание
- •[Править] Переходное состояние
- •5.2.Обратимые и необратимые процессы
- •Релаксация (физика)
- •[Править] Свойства и виды
- •[Править] Описание процесса релаксации [править] Для одноатомных газов
- •[Править] Для многоатомных газов
- •[Править] Для смесей газов
- •[Править] Для жидкостей
- •[Править] Для твёрдых тел и квантовых жидкостей
- •Динамические равновесия
- •Принцип Ле Шателье — Брауна
- •[Править] Влияние температуры
- •[Править] Влияние давления
- •Влияние инертных газов
- •5.1. Химическое равновесие в гомогенных системах
- •6. Растворы
- •6.1. Дисперсные системы. Растворы
- •Некоторые характеристики дисперсных систем
- •6.2. Процесс образования растворов. Тепловые эффекты при растворении
- •6.3. Растворимость
- •6.4. Способы выражения состава растворов
- •Способы выражения состава растворов
- •6.5. Разбавленные растворы неэлектролитов
- •6.5.1. Давление пара над растворами
- •6.5.2. Температура кипения и замерзания растворов
- •6.5.3. Осмотическое давление
- •6.6. Растворы электролитов. Основы теории электролитической диссоциации
- •6.6.1. Сильные и слабые электролиты
- •6.7. Равновесие в растворах слабых электролитов. Константа диссоциации
- •6.8. Основания, кислоты и соли в свете теории электролитической диссоциации
- •6.9. Ионное произведение воды
- •Окраска важнейших кислотно-основных индикаторов в различных средах
- •6.10. Произведение растворимости
- •6.11. Реакции обмена в растворах электролитов
- •6.12. Гидролиз солей
- •11. Химические свойства металлов
- •11.1. Общие положения
- •11.2. Физические свойства металлов
- •11.3. Получение металлов
- •11.3.1. Нахождение в природе
- •11.3.2. Общие методы получения металлов
- •11.3.3. Получение металлов высокой чистоты
- •11.4. Химические свойства металлов
- •11.4.1. Отношение металлов к окислителям - простым веществам
- •Щелочные металлы
- •[Править] Общая характеристика щелочных металлов
- •Некоторые свойства щелочных металлов
- •[Править] Химические свойства щелочных металлов
- •Окраска пламени щелочными металлами и их соединениями
- •[Править] Получение щелочных металлов
- •[Править] Соединения щелочных металлов [править] Гидроксиды
- •[Править] Карбонаты
- •[Править] Фотографии
- •[Править] Литература
- •[Править] Примечания
- •[Править] См. Также
- •[Править] Ссылки
- •13.Важнейшие классы неорганических веществ
- •13.1. Определения
- •13.2. Металлы
- •13.3. Неметаллы
- •13.4. Основные оксиды
- •13.5. Кислотные оксиды
- •13.6. Амфотерные оксиды
- •Окислительно-восстановительные реакции
- •[Править] Описание
- •[Править] Окисление
- •[Править] Восстановление
- •[Править] Виды окислительно-восстановительных реакций
- •[Править] Примеры [править] Окислительно-восстановительная реакция между водородом и фтором
- •[Править] Окисление, восстановление
- •[Править] Мнемонические правила
- •8. Электрохимические процессы
- •8.1. Гальванический элемент
- •8.2 Коррозия металлов
- •8.3. Электролиз
- •8.1. Гальванический элемент
- •8.1.1. Понятие об электродном потенциале
- •8.1.2. Гальванический элемент (гэ) даниэля-якоби
- •8.1.3. Напряжение гальванического элемента
- •8.1.4. Водородная шкала потенциалов
- •8.1.5. Потенциалы металлических электродов
- •8.1.6. Потенциалы газовых электродов
- •8.1.7.Поляризация в электрохимических процессах
- •8.2 Коррозия металлов
- •8.2.1.Химическая коррозия
- •8.2.2. Электрохимическая коррозия
- •Основные случаи возникновения коррозионных гальванических пар
- •8.2.3 Защита металлов от коррозии
- •8.3. Электролиз
- •8.3.1. Общие понятия
- •8.3.2. Электролиз расплавов электролитов
- •8.3.3. Электролиз растворов электролитов
- •8.3.4 Электролиз с растворимыми анодами
- •8.3.5. Законы электролиза
- •8.3.6. Применение электролиза
- •Электрохимическая коррозия
- •Газовая коррозия
- •Химическая коррозия в жидкостях-неэлектролитах
- •7.1.Коррозия металлов
- •7.2.Борьба с коррозией парогенераторов во время работы
- •7.3.Борьба со стояночной (кислородной) коррозией парогенераторов, находящихся в резерве или ремонте
- •7.4.Борьба с коррозией конденсатопроводов
- •7.5.Борьба с коррозией тепловых сетей
- •7.6.Защита от коррозии водоподготовительного оборудования
- •7.7.Удаление отложений
- •§ 36. Воздушная известь
- •А. Воздушные вяжущие вещества
- •Б. Гидравлические вяжущие вещества
[Править] Энтропия в открытых системах
В
силу второго
начала термодинамики, энтропия
Si замкнутой системы не
может уменьшаться" (закон неубывания
энтропии). Математически это можно
записать так:
![]() ,
индекс i обозначает так называемую
внутреннюю энтропию, соответствующую
замкнутой системе. В открытой системе
возможны потоки тепла как из системы,
так и внутрь неё. В случае наличия потока
тепла в систему приходит количество
тепла δQ1 при температуре T1
и уходит количество тепла δQ2
при температуре T2. Приращение
энтропии, связанное с данными тепловыми
потоками, равно:
,
индекс i обозначает так называемую
внутреннюю энтропию, соответствующую
замкнутой системе. В открытой системе
возможны потоки тепла как из системы,
так и внутрь неё. В случае наличия потока
тепла в систему приходит количество
тепла δQ1 при температуре T1
и уходит количество тепла δQ2
при температуре T2. Приращение
энтропии, связанное с данными тепловыми
потоками, равно:
![]()
В стационарных системах обычно δQ1 = δQ2, T1 > T2, так что dSo < 0. Поскольку здесь изменение энтропии отрицательно, то часто употребляют выражение «приток негэнтропии», вместо оттока энтропии из системы. Негэнтропия определяется таким образом как обратная величина энтропии.
Суммарное изменение энтропии открытой системы будет равно:
dS = dSi + dSo.
Если всё время dS > 0, то рост внутренней энтропии не компенсируется притоком внешней негэнтропии, система движется к ближайшему состоянию равновесия. Если dS = 0, то мы имеем стационарный процесс с неизменной общей энтропией. В этом случае в системе осуществляется некоторая внутренняя работа с генерацией внутренней энтропии, которая преобразует, например, температуру T1 внешнего потока тепла в температуру T2 уходящего из системы потока тепла.
[Править] Измерение энтропии
В реальных экспериментах очень трудно измерить энтропию системы. Техники измерения базируются на термодинамическом определении энтропии и требуют экстремально аккуратной калориметрии.
Для упрощения мы будем исследовать механическую систему, термодинамические состояния которой будут определены через её объем V и давление P. Для измерения энтропии определенного состояния мы должны сперва измерить теплоёмкость при постоянных объёме и давлении (обозначенную CV и CP соответственно), для успешного набора состояний между первоначальным состоянием и требуемым. Тепловые ёмкости связаны с энтропией S и с температурой T согласно формуле:
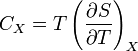
где нижний индекс X относится к постоянным объёму и давлению. Мы можем проинтегрировать для получения изменения энтропии:
![]()
Таким образом, мы можем получить значение энтропии любого состояния (P,V) по отношению к первоначальному состоянию (P0,V0). Точная формула зависит от нашего выбора промежуточных состояний. Для примера, если первоначальное состояние имеет такое же давление, как и конечное состояние, то
![]()
В добавление, если путь между первым и последним состояниями лежит сквозь любой фазовый переход первого рода, скрытая теплота, ассоциированная с переходом, должна также учитываться.
Энтропия первоначального состояния должна быть определена независимо. В идеальном варианте выбирается первоначальное состояние как состояние при экстремально высокой температуре, при которой система существует в виде газа. Энтропия в этом состоянии подобна энтропии классического идеального газа плюс взнос от молекулярных вращений и колебаний, которые могут быть определены спектроскопически.
