
- •Введение.
- •Часть 1. Типовые задачи.
- •1.1.Основные понятия химии.
- •1.1.1. Количество вещества (n), масса (m), молярная масса (м), число Авогадро (nа)
- •1.1.2. Массовая доля элемента () в химическом соединении или в смеси.
- •1.1.2. Определение формулы вещества
- •1.1.3 Расчеты по уравнениям химических реакций. Выход () продукта в реакции или в процессе.
- •1.2. Задачи с участием газов.
- •Молярный объем газа – это объем, который занимает 1 моль газа
- •1.2.2.Абсолютная () и относительная (d) плотность газа
- •1.2.4.Расчеты по уравнениям реакций с участием газов
- •1.3. Растворы
- •1.3.2. Растворимость (s) и коэффициент растворимости (s)
- •1.3.3. Электролитическая диссоциация, степень диссоциации ()
- •1.4. Тепловые эффекты химических реакций (q)
- •Суммарный тепловой эффект многостадийного процесса равен алгебраической сумме тепловых эффектов отдельных стадий, например:
- •1.6. Химическое равновесие
- •1.7. Электрохимический ряд активности металлов
- •Закон Фарадея:
- •Часть 2. Подходы к решению сложных комбинированных задач
- •2.1. Общие рекомендации
- •2.1.1. Осмысление задачи
- •Решение:
- •56,4 Г осадка
- •2.1.2. Химизм процессов
- •2.1.3. Обработка цифровых данных.
- •2.1.4. Проверка правильности решения
- •2.2. Избыток и недостаток
- •2.2.3. Конечный результат и последовательность протекания химических реакций зависят от порядка смешивания реагентов.
- •2.3. Постадийное определение состава смеси
- •2.4. Введение неизвестных величин
- •2.4.1. Введение одного неизвестного
- •2.4.2.1. Примеры задач с системами из двух неизвестных:
- •2.4.2.2. Примеры задач с системами из трех неизвестных:
- •Примеры задач с квадратными уравнениями
- •2.5. Введение произвольного параметра
- •2.6. Метод подбора
- •2.7. Многовариантные задачи
- •2.8. Составление материального баланса
- •Часть 3. Конкурсные задачи
- •3.1. Газы
- •3.2. Растворы и смеси
- •3.2.1. Растворение простых веществ
- •3.2.2. Растворение сложных веществ
- •Растворение сплавов и смесей
- •3.2.4. Смешивание растворов
- •3.2.5. Растворимость
- •3.2.6. Последовательно соединенные промывные сосуды
- •Смешивание растворов в различных соотношениях
- •Равные массовые доли ионов в растворе
- •Изменение порядка смешивания реагентов
- •Три разных вещества реагируют с равными количествами одинаковых растворов
- •Термическое разложение солей
- •3.4. Определение формулы вещества
- •3.4.1. Определение элемента
- •3.4.2. Определение формулы неорганического вещества
- •3.4.3. Определение формулы органического вещества
- •3.4.4. Определение числа фрагментов в высокомолекулярном соединении
- •3.5. Тепловые эффекты химических реакций
- •3.6. Скорость химических реакций
- •3.7. Химическое равновесие.
- •3.8. Вытеснение одного металла другим
- •3.9. Электролиз
- •3.10. Некоторые новые задачи 2002 — 2005 г.Г.
- •Решения некоторых конкурсных задач
- •Номера задач по веществам и классам химических соединений
- •Приложения Условные обозначения, используемые в пособии
- •Расчетные формулы, используемые при решении задач
- •Содержание
1.4. Тепловые эффекты химических реакций (q)
П
Теплотой
образования вещества называют количество
теплоты, выделяющейся или поглощающейся
при образовании 1 моля вещества из
простых веществ, например: 2С(графит)
+ 3Н2 (газ)
+ 0,5О2 (газ)
С2Н5ОН(жидкость)
+ 278 кДж
Q(образования
С2Н5ОН)
= 278 кДж/моль.
Теплота образования
простого вещества равна нулю.
Теплотой сгорания
вещества называют количество теплоты,
выделяющейся при сгорании 1 моля
вещества, например: С3Н6(газ)
+ 4,5О2(газ)
3СО2(газ)
+ 3Н2О(газ)
+ 2063 кДж
Q(сгорания
С3Н6)
= 2063 кДж/моль
Закон
Гесса:
Тепловой
эффект процесса не зависит от пути его
протекания.
Следствия из
закона Гесса:
С(тв.)
+ 0,5О2(газ)
СО(газ)
+ Q1;
СО(газ)
+ 0,5О2(газ)
СО2
+ Q2;
С(тв.)
+ О2(газ)
СО2(газ)
+ Q3
Q3
= Q1
+ Q2
Тепловой
эффект реакции равен разности между
суммой теплот образования продуктов
реакции, умноженных на соответствующие
коэффициенты в уравнении реакции, и
суммой
теплот
образования исходных веществ, умноженных
на соответствующие коэффициенты,
например:
3CuO(тв.)
+ 2NH3(газ)
3Cu(тв.)
+ 3 H2O(жидк)
+ Q
Q
= Q(образования
Н2О)
∙ 3 – [Q(образования
CuO)
∙ 3 + Q(образования
NH3)
∙ 2
Тепловой
эффект реакции равен разности между
суммой теплот сгорания исходных
веществ, умноженных на соответствующие
коэффициенты в уравнении реакции, и
суммой теплот сгорания продуктов
реакции, умноженных на соответствующие
коэффициенты, например:
2С2Н5ОН(жидк)
С2Н5ОС2Н5(жидк)
+ Н2О(жидк)
+ Q
Q
= Q(сгорания
С2Н5ОН)
∙ 2 – Q(сгорания
С2Н5ОС2Н5)
Суммарный тепловой эффект многостадийного процесса равен алгебраической сумме тепловых эффектов отдельных стадий, например:
Решение:
-
Записываем термохимическое уравнение реакции, рассчитываем количество вещества сгоревшего фосфора и количество вещества образовавшегося оксида фосфора(V):
2Р(тв) + 2,5О2(газ) Р2О5(тв) + Q(образования Р2О5)
n(Р) = 7,75 / 31 = 0,25 моль; n(Р2О5) = n(Р) / 2 = 0,25 / 2 = 0,125 моль.
-
Определяем теплоту сгорания фосфора и теплоту образования оксида фосфора(V):
Q(сгорания Р) = Q / n(Р) = 188 / 0,25 = 752 кДж/моль.
Q(образования Р2О5) = Q / n(Р2О5) = 188 / 0,125 = 1504 кДж/моль.
Ответ: Q(сгорания Р) = 752 кДж/моль; Q(образования Р2О5) = 1504 кДж/моль.
Пример 46. При сгорании некоторого количества газообразного углеводорода образовалось 4,48 л оксида углерода(IV) (н.у.) и 3,6 г воды и выделилось 137,5 кДж теплоты. Определите теплоту сгорания углеводорода, если известно, что его плотность по воздуху равна 1,448.
Решение:
-
Определяем простейшую формулу сгоревшего углеводорода:
СхНу + О2 хСО2 + 0,5у Н2О
n(СО2) = 4,48 / 22,4 = 0,2 моль; n(Н2О) = 3,6/ 18 = 0,2 моль.
n(С) = 0,2 моль; n(Н) = 0,2 ∙ 2 = 0,4 моль.
х : у = 0,2 : 0,4 = 1 : 2. Простейшая формула углеводорода СН2.
-
Рассчитываем молярную массу и определяем молекулярную формулу углеводорода:
М(СхНу) = Dвоздух ∙ 29 = 1,448 ∙ 29 = 42 г/моль.
М(фрагмента СН2) = 14 г/моль
Молекулярная формула углеводорода (СН2)n.
n = М(СхНу) / М(фрагмента СН2) = 42 / 14 = 3.
Углеводород (СН2)3 или С3Н6.
-
Записываем термохимическое уравнение реакции горения углеводорода и определяем теплоту сгорания:
С3Н6(газ) + 4,5О2(газ) 3СО2(газ) + 3Н2О(ж) + Q(сгорания С3Н6)
n(С3Н6) = n(СО2) / 3 = 0,2 / 3 = 0,0667 моль.
Q(сгорания С3Н6) = Q / n(С2Н6) = 137,5 / 0,0667 = 2061 кДж/моль.
Ответ: Q(сгорания С3Н6) = 2061 кДж/моль.
Пример 47. При сжигании 9 г органического вещества образовалось 13,2 г оксида углерода(IV) и 5,4 г воды и выделилось 140 кДж теплоты. Определите молекулярную формулу вещества, если его теплота сгорания равна 2800 кДж/моль.
Решение:
-
Судя по продуктам сгорания исходное вещество содержало углерод, водород и, возможно, кислород. Рассчитываем количества образовавшихся веществ, и записываем схему горения:
n(СО2) = 13,2 / 44 = 0,3 моль. n(Н2О) = 5,4 / 18 = 0,3 моль.
СхНуОz + О2 СО2 + Н2О
-
Рассчитываем количества веществ элементов, входящих в состав исходного вещества и определяем его простейшую формулу:
n(С) = n(СО2) = 0,3 моль. n(Н) = 2 ∙ n(Н2О) = 0,3 ∙ 2 = 0,6 моль.
m(O) = m(вещества) – m(С) – m(Н) = 9 – 0,3 ∙ 12 – 0,6 ∙ 1 = 4,8 г.
n(О) = 4,8 / 16 = 0,3 моль.
х : у : z = 0,3 : 0,6 : 0,3 = 1 : 2 : 1. Простейшая формула вещества СН2О.
-
Определяем молярную массу вещества и его молекулярную формулу:
n(исходного вещества) = Q(выделившееся при сгорании взятого количества) / Q(сгорания) = 140 / 2800 = 0,05 моль.
М(исходного вещества) = 9 / 0,05 = 180 г/моль.
Молекулярная формула (СН2О)n; n = 180 / 30 = 6. С6Н12О6.
Ответ: С6Н12О6.
Пример 48. При взаимодействии 31 г фосфора с хлором выделилось 400 кДж теплоты, и образовалась смесь хлоридов фосфора(III) и (V). Определите объем прореагировавшего хлора (н.у.), если теплоты образования хлорида фосфора(III) и хлорида фосфора(V) равны 318 и 455 кДж/моль соответственно.
Решение:
-
Записываем термохимические уравнения реакций и рассчитываем количество вещества фосфора, вступившего в реакции:
P(тв) + 1,5Cl2(газ) PCl3(ж) + 318 кДж
P(тв) + 2,5Cl2(газ) PCl5(тв) + 455 кДж
n(Р) = 31 / 31 = 1 моль.
-
Обозначим количество вещества фосфора, вступившего в первую реакцию за х и количество вещества фосфора, вступившего во вторую реакцию за у. Составим систему уравнений и решим ее:
х

 + у
= 1 ∙ 455 455х
+ 455у
= 455 137х
= 55 у
= 1 – 0,401
+ у
= 1 ∙ 455 455х
+ 455у
= 455 137х
= 55 у
= 1 – 0,401
318х + 455у = 400 318х + 455у = 400 х = 0,401 у = 0,599
-
Рассчитываем количество вещества хлора, вступившего в обе реакции и определяем его объем:
n(Cl2) = 1,5х + 2,5у = 0,401 ∙ 1,5 + 0,599 ∙ 2,5 = 2,1 моль.
V(Cl2) = 2,1 ∙ 22,4 = 47 л.
Ответ: V(Cl2) = 47 л.
Пример 49. 22 г предельного одноатомного спирта нагрели в присутствии серной кислоты. При этом образовалось 18,4 г смеси простого эфира и трех изомерных алкенов. Определите структурную формулу исходного спирта и массу образовавшегося простого эфира, если известно, что при сжигании 10 г исходного спирта выделяется 370,5 кДж тепла, а теплота сгорания его равна 3260 кДж/моль.
Решение:
-
Определяем молярную массу и формулу исходного спирта:
n(в 10 г спирта) = Q / Q(сгорания) = 370,5 / 3260 = 0,1137 моль.
М(спирта) = 10 / 0,1137 = 88 г/моль.
Общая формула гомологического ряда предельных одноатомных спиртов — СnН2n + 1ОН;
12n + 2n + 1 + 17 = 88; 14n = 70; n = 70 / 14 = 5. Формула спирта С5Н11ОН.
-
Записываем уравнения химических реакций, обозначив количество спирта, превратившегося в алкены за х, и количество спирта, превратившегося в простой эфир за у.
x у
С5Н11ОН С5Н10 + Н2О; 2С5Н11ОН С5Н11ОС5Н11 + Н2О
x х 0,5у 0,5у
-
Рассчитываем количества веществ спирта и образовавшейся воды, составляем систему уравнений и находим массу простого эфира:
n(спирта) = 22 / 88 = 0,25 моль. m(выделившейся воды) = 22 – 18,4 = 3,6 г.
n (Н2О)
= 3,6 / 18 = 0,2 моль.
(Н2О)
= 3,6 / 18 = 0,2 моль.
х + у = 0,25 0,5у = 0,05
х + 0,5у = 0,2
m(С5Н11О С5Н11) = 0,05 ∙ 158 = 7,9 г.
-
Определяем структурную формулу исходного спирта:
Из восьми изомерных спиртов формулы С5Н11ОН только пентанол–2 может образовать смесь трех изомерных алкенов:
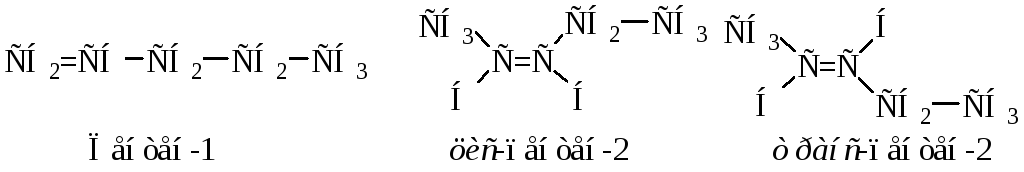
Ответ: m(С5Н11О С5Н11) = 7,9 г; пентанол–2.
Пример 50. Определите тепловой эффект реакции C2H5OH(ж) + 3О2(г) 2СО2(г) + 3Н2O(ж). Теплоты образования C2H5OH(ж), СО2(г) и Н2О(ж) равны 277,6; 393,5 и 285,8 кДж/моль соответственно.
Решение:
Q(реакции) = Q(образования СО2(г) ∙ 2 + Q(образования Н2О(Ж)) ∙ 3 – Q(образования С2Н5ОН(ж))
Теплота образования кислорода равна нулю, так как это простое вещество.
Q(реакции) = 393,5 ∙ 2 + 285,8 ∙ 3 – 277,6 = 787 + 857,4 – 277,6 = 1366,8 кДж.
Ответ: Q(реакции) = 1366,8 кДж.
Пример 51. Определите тепловой эффект реакции С2Н2(г) + 2 Н2(г) С2Н6(г). Теплоты сгорания С2Н2(г), Н2(г) и С2Н6(г) равны 1303, 287 и 1563 кДж/моль соответственно.
Решение:
Q(реакции) = Q(сгорания С2Н2(г)) + Q(сгорания Н2(г)) ∙ 2 – Q(сгорания С2Н6(г))
Q(реакции) = 1303 + 287 ∙ 2 – 1563 = 1303 + 574 – 1563 = 314 кДж.
Ответ: Q(реакции) = 314 кДж.
Пример 52. Тепловые эффекты растворения MgSO4 и MgSO47H2O в воде соответственно равны 84,8 и –15,9 кДж/моль. Какова теплота гидратации при переходе MgSO4 в MgSO4 7 H2O.
Решение:
Процесс растворения безводного сульфата магния в воде можно представить как последовательность процесса гидратации соли с превращением ее в кристаллогидрат и процесса растворения кристаллогидрата, поэтому:
Q(растворения MgSO4) = Q(гидратации MgSO4 в MgSO47H2O) + Q(растворения MgSO47H2O).
Q(гидратации MgSO4 в MgSO47H2O) = Q(растворения MgSO4) – Q(растворения MgSO47H2O) = 84,8 – (–15,9) = 100,7 кДж/моль.
Ответ: Q(гидратации MgSO4 в MgSO47H2O) = 100,7 кДж/моль.
Задачи для самостоятельного решения
-
Определите, сколько выделится теплоты при образовании 3,4 г аммиака, если его теплота образования равна 46,2 кДж/моль.
-
Теплоты образования FeO, Fe3O4 и Fe2O3 равны 266,5; 1117 и 822,2 кДж/моль соответственно. Определите, сколько теплоты выделится при сгорании 2,8 г железа в чистом кислороде.
-
12 г моносахарида сожгли в избытке кислорода, при этом выделилось 184 кДж теплоты. После приведения продуктов сгорания к н.у. выделилось 7,2 г воды и осталось 16,8 л газовой смеси (н.у.) с плотностью по водороду 19,2. Определите формулу моносахарида, если известно, что его теплота сгорания равна 2300 кДж/моль.
-
В результате сжигания некоторого количества органического вещества, содержащего азот, в 17,92 л кислорода выделилось 180 кДж теплоты, образовалось 10,8 г воды и 14,56 л газовой смеси с плотностью 1,635 г/л, объем которой после пропускания через избыток раствора щелочи уменьшился на 6,72 л. Определите структурную формулу сожженного вещества, если его теплота сгорания равна 1200 кДж/моль. Все объемы и плотность измерены при нормальных условиях.
-
29 г насыщенного одноатомного спирта нагрели в присутствии серной кислоты и получили смесь пяти изомерных алкенов и простого эфира массой 24,95 г . Определите выход простого эфира в расчете на взятый спирт и предложите структурные формулы исходного спирта и полученных алкенов, если известно, что при сжигании 10 г спирта выделяется 301,7 кДж теплоты, а теплота сгорания его равна 3500 кДж/моль.
-
При сжигании некоторого количества смеси серы с фосфором выделилось 315 кДж теплоты, а на полную нейтрализацию раствора продуктов сгорания в воде потребовалось 246 мл раствора гидроксида натрия с массовой долей щелочи 20 % и плотностью 1,22 г/мл. Определите массовые доли веществ в исходной смеси, если известно, что теплоты образования оксида фосфора(V) и оксида серы(IV) равны 1507 и 297 кДж/моль соответственно.
-
15,68 л (н.у.) смеси сероводорода и кислорода подожгли. В результате образовалось некоторое количество серы, оксид серы(IV) и вода и выделилось 129,8 кДж теплоты. Определите состав исходной газовой смеси в массовых долях, если известно, что исходные вещества прореагировали полностью, а теплоты сгорания сероводорода до серы и до оксида серы(IV) равны 246 и 560 кДж/моль соответственно.
-
Определите тепловой эффект реакции C2H5OH(ж) + CH3COOH(ж) CH3COOC2H5(ж) + H2O(ж). Теплоты сгорания CH3COOH, C2H5OH и CH3COOC2H5 равны: 1366,9; 871,5 и 2254,2 кДж/моль соответственно.
-
Определите тепловой эффект реакции: C2H5OH(ж) C2H4(г) + H2O(ж), если известно, что теплоты образования C2H5OH, C2H4 и H2O равны 277,6; –52,3 и 285,8 кДж/моль соответственно.
-
Тепловой эффект растворения BaCl2 в воде равен 8,66 кДж/моль. А теплота гидратации этой соли при переходе в BaCl22H2O 290,2 кДж/моль. Какова теплота растворения BaCl22H2O?
1
(гомогенной
реакции) =
(гомогенной
реакции) — средняя скорость реакции,
протекающей в однородной среде в
интервале времени t;
c
и n
— изменения концентрации и количества
исходного вещества или продукта
реакции (взятые по абсолютной величине);
V
— объем, в котором протекает реакция.
(Объем считается неизменным) (гетерогенной
реакции) — средняя скорость реакции,
протекающей на границе двух
несмешивающихся веществ в интервале
времени t;
S
— площадь поверхности соприкосновения
реагирующих веществ.
Для
реакции аА + bВ
+ . . .
продукты
= k
cA
cB
.
. . —
истинная
скорость реакции в данный момент
времени; k
— коэффициент пропорциональности
(константа
скорости реакции);
cА,
cВ,
…. — концентрации реагирующих веществ;
,
,
…. — показатели степени, зависящие от
механизма и условий проведения реакции
(порядки
реакции по
веществам
А,В,
….). t2o
— скорость реакции при температуре
t2o; t1o
— скорость реакции при температуре
t1o; — температурный
коэффициент скорости реакции
![]() ;
(гетерогенной
реакции) =
;
(гетерогенной
реакции) =
![]()
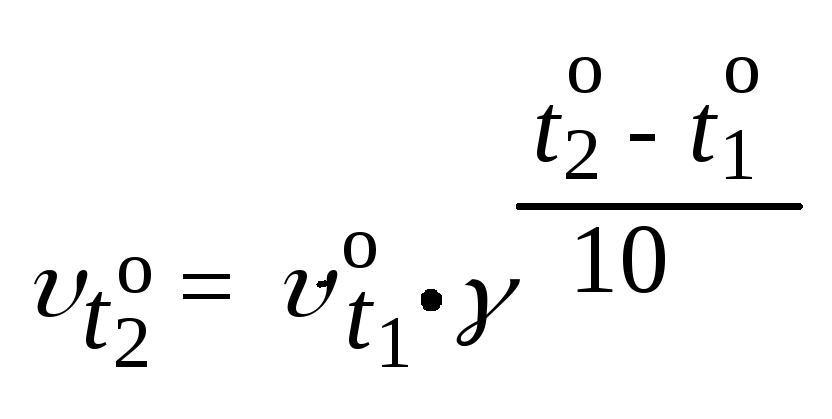 ,
где
,
где
Пример 53. В сосуде емкостью 5 л смешали 1,4 г этилена и 5,475 г хлороводорода. Через 25 секунд в сосуде образовалось 1,29 г хлорэтана. Определите молярные концентрации веществ в этот момент и среднюю скорость реакции в этом интервале времени.
Решение:
-
Определяем количества исходных веществ и количество образовавшегося продукта:
n(С2Н4) = 1,4 / 28 = 0,05 моль;
n(НСl) = 5,475 / 36,5 = 0,15 моль;
n(С2Н5Сl) = 1,29 / 64,5 = 0,02 моль.
-
Записываем уравнение реакции, указывая количества реагирующих и образующихся веществ:
Было: 0,05 0,15
СН2=СН2 + НСl СН3–СН2Сl + (СН2=СН2) + (НСl)
Прореагировало: 0,02 0,02 стало: 0,02 0,03 0,13
-
Определяем молярные концентрации веществ через 25 секунд после начала реакции:
c(СН2=СН2) = 0,03 / 5 = 0,006 моль/л. c(НСl) = 0,13 / 5 = 0,026 моль/л.
c(СН3 – СН2Сl) = 0,02 / 5 = 0,004 моль/л.
-
Согласно уравнению реакции:
n(С2Н4) = n(НСl) = n(образовавшегося С2Н5Сl) = 0,02 моль.
-
Эта реакция гомогенная, так как оба реагирующие вещества газы:
= n / (V ∙ t) = 0,02 / (5 ּ 25) = 0,00016 = 1,6∙10–4 моль/л.сек.
Ответ: = 1,6∙10–4 моль/л.сек; c(СН2=СН2) = 0,006 моль/л, c(НСl) = 0,026 моль/л, c(СН3 – СН2Сl) = 0,004 моль/л.
Пример 54. В некоторый момент времени скорость реакции синтеза аммиака, измеренная по водороду, составила 0,045 моль/л.мин. Какие значения будет иметь скорость этой же реакции в тот же момент времени и в тех же условиях, если ее измерять по азоту или по аммиаку?
Решение:
3Н2 + N2 2NН3
(измеренная по Н2) = n(Н2) / (V ∙ t); (измеренная по N2) = n(N2) / (V ∙ t);
Согласно уравнению реакции изменение количества вещества азота в три раза меньше изменения количества вещества водорода — n(N2) = n(Н2) / 3, поэтому скорость реакции, измеренная по азоту, в три раза меньше скорости реакции, измеренной по водороду:
(измеренная по N2) = (измеренная по Н2) / 3 = 0,045 / 3 = 0,015 моль/л.мин.
Аналогично, изменение количества аммиака в этой реакции в два раза больше изменения количества азота, поэтому скорость, измеренная по аммиаку, будет в два раза больше скорости, измеренной по азоту.
(измеренная по NН3) = 2 ∙ (измеренная по N2) = 0,015 ∙ 2 = 0,03 моль/л.мин.
Ответ: (измеренная по N2) = 0,015 моль/л.мин; (измеренная по NН3) = 0,03 моль/л.мин.
Пример 55. В сосуд кубической формы емкостью 1 литр поместили 500 мл раствора серной кислоты и сверху налили толстый слой жидкого жира, содержащего остатки только олеиновой кислоты. Через четыре часа концентрация глицерина в водном слое достигла 0,004 моль/л. Определите среднюю скорость реакции гидролиза жира и среднюю скорость образования олеиновой кислоты в этом интервале времени. (Изменением объема водного слоя пренебречь).
Решение:
-
Записываем уравнение реакции:
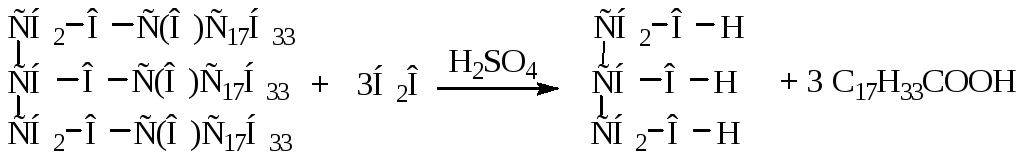
-
Эта реакция гетерогенная, так как жир не растворим в воде, и реакция происходит на границе раздела между слоем жира и раствора серной кислоты. Определяем изменение количества вещества жира и площадь соприкосновения слоев:
n(жира) = n(образовавшегося глицерина) = c ∙ V = 0,004 ∙ 0,5 = 0,002 моль.
Длина ребра куба объемом 1 л = 10 см = 0,1 м. Площадь поперечного сечения куба равна квадрату его ребра:
S = 0,1 ∙ 0,1 = 0,01 м2.
-
Определяем скорость реакции гидролиза жира:
= n / (S ∙ t) = 0,002 / (0,01 ∙ 4) = 0,05 моль/м2.час.
Скорость образования олеиновой кислоты будет в три раза больше: 0,05 ∙ 3 = 0,15 моль/м2.час
Ответ: (гидролиза глицерина) = 0,05 моль/м2.час; (образования олеиновой кислоты) = 0,15 моль/м2.час.
Пример 56. Во сколько раз увеличится скорость реакции образования оксида азота(IV) из оксида азота(II) и кислорода при увеличении концентраций реагирующих веществ в 4 раза, если известно, что для этой реакции скорость прямопропорциональна концентрации оксида азота(II) в первой степени и концентрации кислорода в степени 1/2?
Решение:
Записываем уравнение реакции и уравнение для скорости этой реакции:
2NO + O2 2NO2
=
k
∙ c(NO)
∙
![]()
2
= k
∙ c2(NO)
∙
![]() .
= k
∙ 4 ∙ c(NO)
∙
.
= k
∙ 4 ∙ c(NO)
∙
![]() = 8 ∙ k
∙ c(NO)
∙
= 8 ∙ k
∙ c(NO)
∙
![]() = 8
= 8
Ответ: Скорость увеличится в 8 раз.
Пример 57. Во сколько раз увеличится скорость реакции при повышении температуры с 30оС до 80оС, если температурный коэффициент скорости для данной реакции равен двум?
Решение:
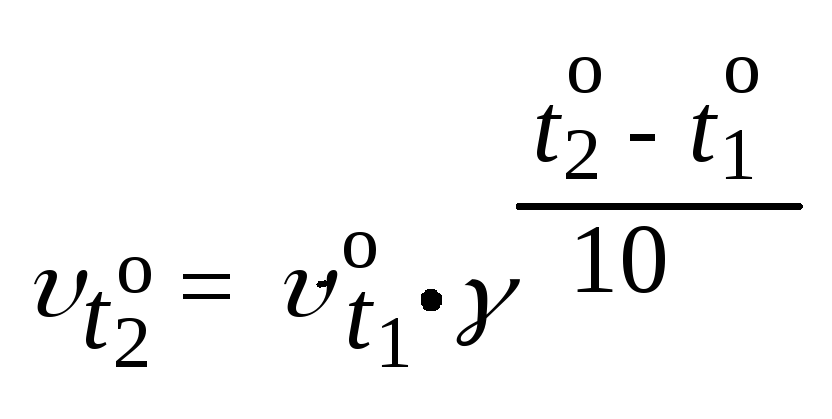
(t2 – t1) / 10 = (80 – 30) / 10 = 5; t2 / t1 = 5 = 2 5 = 32
Ответ: Скорость увеличится в 32 раза.
Задачи для самостоятельного решения
-
1 л водного раствора ацетальдегида с массовой долей растворенного вещества 8,8 % и плотностью 1г/мл смешали с 1 л аммиачного раствора оксида серебра. Через 20 минут из раствора выпало 21,6 г осадка. Определите молярные концентрации органических веществ в этом растворе и среднюю скорость реакции, измеренную по ацетальдегиду в этом интервале времени.
-
Скорость реакции омыления метилацетата прямопропорциональна произведению молярных концентраций реагирующих веществ. Определите концентрацию гидроксида натрия в реакционной смеси, если известно, что массовая доля метилацетата в ней составляет 3,7 %, скорость реакции в данный момент времени равна 2.10–3 моль/л.мин, а коэффициент пропорциональности в уравнении для скорости реакции при данной температуре равен 5.10–3 л/моль.мин. Плотность раствора принять равной 1 г/мл.
-
В результате реакции брожения глюкозы при 25оС за 2 часа выделилось 17,92 л оксида углерода(IV) (н.у.). Определите массу спирта, образующегося при брожении глюкозы в таком же объеме за 1 час при 35оС, если известно, что скорость этой реакции не зависит от концентрации глюкозы, а температурный коэффициент скорости равен восьми.
-
Скорость реакции этерификации прямопропорциональна произведению молярных концентраций кислоты и спирта, причем коэффициент пропорциональности при 40оС равен 0,004 л/моль.мин. Определите величину скорости реакции этерификации при 70оС в растворе в толуоле, в котором массовые доли уксусной кислоты и метанола составляют 13,33% и 7,11% соответственно, а плотность раствора равна 0,9 г/мл. Температурный коэффициент скорости реакции равен трем.
-
В стакан диаметром 5 см поместили раствор серной кислоты с массовой долей кислоты 4,75% (плотность 1,032 г/мл) и сверху налили толстый слой жидкого жира, содержащего остатки только олеиновой кислоты. Через 24 часа в водном слое появилось 0,46 г глицерина. Определите массу олеиновой кислоты, образующейся при выдерживании слоя такого же жира при той же температуре в сосуде диаметром 20 см в контакте с раствором серной кислоты с массовой долей кислоты 20,9% (плотность 1,172 г/мл) в течение 40 часов, учитывая, что скорость данной гетерогенной реакции прямопропорциональна концентрации ионов водорода в водном слое. Изменениями объема водного слоя пренебречь.
