
- •Закрытое акционерное общество «Исследовательский институт химического разнообразия» Конфиденциальность гарантируется
- •Опытно-промышленный регламент № 12
- •Летрозол Субстанция
- •Содержание
- •Раздел 1. Характеристика готовой продукции производства
- •1.6. Нормативные требования к упаковке, маркировке, транспортированию, условиям хранения и срокам годности препарата.
- •Раздел 2. Химическая схема производства
- •Раздел 3. Технологическая схема производства
- •Раздел 4. Аппаратурная схема производства и спецификация оборудования.
- •Раздел 6. Изложение технологического процесса
- •6.2. Тп.1. Получение 4-фторбензоилхлорида
- •6.3. Тп.2. Получение амида 4-фторбензойной кислоты
- •6.4. Стадия тп.3. Получение 4-фторбензонитрила
- •6.5. Тп.4.Получение 4-(бромметил)бензонитрила
- •6.6. Тп.5.Получение 4-(1н-1,2,4-триазол-1-ил)метилбензонитрила.
- •6.7. Тп.6. Получение 4-[(4-цианофенил)(1н-1,2,4-триазол-1-ил)метил] бензо-нитрила
- •6.8. Вр. 7. Санитарная обработка производства
- •6.9. Тп.8. Очистка 4-[(4-цианофенил)(1н-1,2,4-триазол-1-ил)метил]бензонит- рила. Получение Летрозола
- •Раздел 7. Материальный баланс.
- •Раздел 8. Переработка и обезвреживание отходов производства
- •Раздел 9. Контроль производства и управление технологическим процессом
- •Раздел 10. Безопасная эксплуатация производства
- •Раздел 11. Охрана окружающей среды
- •Раздел 12. Перечень производственных инструкций
- •Раздел 13. Технико-экономические нормативы
- •Раздел 14. Информационные материалы
- •Аммиака раствор
- •Перечень литературы
Закрытое акционерное общество «Исследовательский институт химического разнообразия» Конфиденциальность гарантируется
получателем информации
Для служебного пользования
Экз. № ____
|
|
УТВЕРЖДАЮ Генеральный директор ЗАО «ИИХР»
________________ «____» ______________ 200-- г. |
Опытно-промышленный регламент № 12
производства лекарственного средства
Летрозол Субстанция
№
Срок действия регламента «___» _____________ 200 ___ .
|
|
СОГЛАСОВАНО:
_________________ «____» ______________ 200-- г. |
|
|
|
|
|
РЕКОМЕНДОВАНО К УТВЕРЖДЕНИЮ:
_________________ «____» ______________ 200-- г. |
200-- г
Содержание
|
|
Стр. |
|
Введение. Общая характеристика производства |
3 |
|
1. Характеристика готовой продукции производства |
4 |
|
2. Химическая схема производства |
7 |
|
3. Технологическая схема производства |
10 |
|
4. Аппаратурная схема производства и спецификация оборудования |
19 |
|
5. Характеристика сырья, материалов и полупродуктов |
28 |
|
6. Изложение технологического процесса |
31 |
|
7. Материальный баланс |
72 |
|
8. Переработка и обезвреживание отходов производства |
79 |
|
9. Контроль производства |
83 |
|
10. Безопасная эксплуатация производства |
85 |
|
11. Охрана окружающей среды |
99 |
|
12. Перечень производственных инструкций |
102 |
|
13. Технико-экономические нормативы |
103 |
|
14. Информационные материалы |
107 |
ВВЕДЕНИЕ. ОБЩАЯ ХАРАКТЕРИСТИКА ПРОИЗВОДСТВА
Наименование производства: Производство Летрозола субстанции.
Год ввода в эксплуатацию: 201-- г.
Проектная мощность участка: 5 кг/месяц.
Структура технологической части участка:
- участок подготовки сырья;
- участок химических процессов;
- участок сушки;
- участок фасовки и упаковки;
- участок регенерации растворителя;
- участок водоподготовки;
- участок приготовления дезинфицирующих растворов;
- участок мойки и стерилизации инвентаря;
- система очистки воздуха;
- химическая лаборатория;
- аналитическая лаборатория;
- лаборатория ПМР спектроскопии;
- лаборатория жидкостной хроматографии.
Метод производства: 6-ти стадийный химический синтез и стадия очистки методом перекристаллизации.
Разработчик технологического процесса: ЗАО «ИИХР».
Раздел 1. Характеристика готовой продукции производства
1.1. Наименование продукции
Летрозол – активная фармацевтическая субстанция
Химическое название: 4-[(4-цианофенил)(1Н-1,2,4-триазол-1-ил)метил]бензонитрил
1.2. Категория и номер действующего нормативного документа, и регистрационный номер
Летрозол выпускают по СТП 0010-2009-12 в соответствии с требованиями ГФ XI вып.1,2.
1.3. Основное назначение продукции
Летрозол – субстанция-порошок для приготовления нестерильных лекарственных средств.
1.4. Фармакологические свойства
Противоопухолевое средство, ингибитор ароматазы нестероидной структуры
Брутто и структурная формулы: С17H11N5
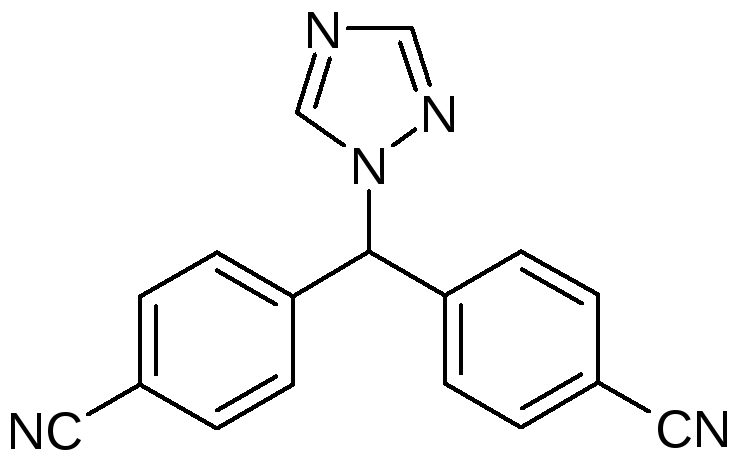
Химическое название: 4-[(4-цианофенил)(1Н-1,2,4-триазол-1-ил)метил]бензонитрил
Относительная молекулярная масса – 285,31
Массовая доля Летрозола не менее 99,0% в пересчете на сухое вещество.
1.5. Краткое описание внешнего вида и основных свойств продукции
Внешний вид. Белый или белый с желтоватым оттенком порошок.
Растворимость. растворим в диметилсульфоксиде, мало растворим в спирте этиловом 96 %, спирте изопропиловом, легко растворим в ацетонитриле, в хлороформе, практически не растворим в воде.
Подлинность. 1H ЯМР спектр вещества, снятый в растворе DMSO-d6 (10 мг препарата в 0,35 мл DMSO-d6, частота прибора 400 МГц) должен иметь полное совпадение по положению и относительной интенсивности пиков протонов с прилагаемым спектром.

Потеря в массе при высушивании.Около 0,5 г (точная навеска) препарата сушат под вакуумом (остаточное давление 100 мм рт. ст.) при температуре 60 0С в течение 4 час (ГФ XI, вып. 1, с. 176).
Массовая доля основного вещества. 0,2 г (точная навеска) препарата растворяют в 1 мл муравьиной кислоты, добавляют 30 мл уксусного ангидрида и титруют 0,1 М раствором хлорной кислоты. Точку эквивалентности определяют потенциоментрически.
Содержание С17H11N5 (ЛЕТРОЗОЛА) должно быть не менее 98,5 % в пересчёте на безводное вещество. (ГФ XI, вып. 1, с. 120).
Проводят контрольный опыт.
1 мл 0,1 М раствора хлорной кислоты соответствует 0,0285 г С17H11N5.
Посторонние примеси. Определение проводят методом ВЭЖХ. Около 0,03 г препарата (точная навеска) растворяют в 30 мл ацетонитрила в мерной колбе на 50 мл и доводят объём раствора 0,1 Н раствором соляной кислоты до метки. 5 мкл полученного раствора хроматографируют на жидкостном хроматографе высокого давления, включающем двойной насос высокого давления, УФ-детектор. Режим анализа градиентный с начальным содержанием ацетонитрила в элюенте 5% с добавлением 0,0206% трифторуксусной кислоты, скорость изменения концентрации ацетонитрила в интервале от 0 до 15 мин 6,0 % в минуту.
Условия анализа:
- колонка Phenomenex Luna 3μ C18 (4.6x150 mm);
-подвижная фаза: ацетонитрил – вода, режим анализа градиентный с изменением концентрации ацетонитрила от 5 % (0 мин) до 95 % (15 мин);-скорость подвижной фазы 0,5 мл/мин;
-детектирование при длине волны 254 нм;
-температура колонки 30,0±0,1 оС;
-масштаб регистрации 0,1 AUFS;
-время интегрирования сигнала 1с.
Время регистрации хроматограммы, обеспечивающее детектирование всех потенциальных примесей в указанных условиях анализа, составляет около 20 мин.
Содержание любой единичной примеси (Хi) в процентах вычисляют по формуле:
Si
Xi= –––––– * 100,
S0
где: Si – площадь пика посторонней примеси;
S0 –площадь основного пика;
100 – пересчёт в проценты.
Время удерживания пика основного вещества около 11.80-12,7 минут.
Сульфатная зола. Сульфатная зола из 1 г (точная навеска) препарата не должна превышать 0,1 % (ГФ ХI, вып. 2, с.25).
Тяжелые металлы. Не более 0,001 %. Определение проводят из сульфатной золы, полученной из точной навески препарата около 1 г (ГФ XI, вып.1, с.165).
