
- •Предисловие
- •Методические рекомендации по выполнению лабораторных работ Подготовка к выполнению лабораторной работы
- •Выполнение лабораторной работы на занятии
- •Оформление работы
- •Защита лабораторной работы
- •Техника безопасности в химической лаборатории
- •Общие правила поведения в лаборатории
- •Правила работы с химическими реактивами
- •Работа со стеклянной посудой и приборами
- •Работа с ртутными термометрами
- •Техника безопасности при работе с электроприборами
- •Основные правила противопожарной безопасности
- •Химическая посуда
- •Лабораторные работы Работа 1 приготовление растворов. Титриметрический анализ
- •1. Общие понятия
- •2. Способы выражения концентрации растворов
- •3. Титриметрический анализ
- •3.1. Сущность титриметрического метода анализа
- •3.2. Классификация титриметрических методов
- •3.3. Вычисления в титриметрии
- •3.4. Растворы, применяемые в титриметрии. Приготовление стандартных растворов
- •3.5. Аппаратура и техника выполнения титриметрического анализа
- •Выполнение работы. Опыт №1. Приготовление раствора заданной процентной концентрации.
- •Требуется приготовить 100 г раствора заданной процентной концентрации определенного вещества и воды (концентрацию и вещество указывает преподаватель).
- •Рассчитывают, какая масса вещества требуется для приготовления 250 мл раствора указанной концентрации. При расчетах учитывают, что щелочи, как правило, содержат 96–98% основного вещества.
- •3.2. Определение концентрации раствора щелочи
- •Определение теплоты реакции нейтрализации
- •Проведение калориметрических измерений
- •Выполнение работы.
- •Обработка результатов.
- •Термометр Бекмана и работа с ним
- •Химия биогенных s- и p- элементов. Их биологическая роль и применение в медицине
- •Химия биогенных d- элементов. Их биологическая роль и применение в медицине
- •Работа 5 осмос
- •Измерение рН растворов потенциометрическим методом. Потенциометрическое титрование
- •Измерение рН
- •Подготовка прибора эв-74 к работе (Иономер эв-74)
- •Результаты потенциометрического титрования
- •Работа 7 определение константы скорости химической реакции
- •Кинетические уравнения реакций первого, второго и нулевого порядка
- •Работа 8 адсорбция уксусной кислоты на поверхности активированного угля
- •Работа 9 получение золя гидроксида железа (III). Коагуляция
- •Работа 10 электрические свойства коллоидных систем
- •Определение знака заряда коллоидных частиц методом капиллярного анализа
- •Выполнение опыта.
- •Электрофорез золя гидроксида железа. Определение знака заряда и величины дзета-потенциала
- •Выполнение работы.
- •Обработка результатов.
- •Задачи для подготовки к семинарским занятиям и контрольным работам
- •Тестовые задания для самоконтроля
Измерение рН растворов потенциометрическим методом. Потенциометрическое титрование
Водородным показателем (рН) называется число, определяемое следующим образом
![]() (6.1),
(6.1),
где а (Н+) – активность ионов водорода, моль/л. В разбавленных растворах активность можно считать равной концентрации, и тогда водородный показатель определяется как
![]() (6.2),
(6.2),
где [Н+] – концентрация ионов водорода в растворе, моль/л.
Например, если концентрация ионов водорода [Н+]= 0,0001 моль/л, то рН = –lg0,0001 = –lg10–4 = 4. Наоборот, если рН = 6,4, тогда [Н+]= 10–6,4= 3,98∙10–7 моль/л.
Вода является слабым электролитом, т.е. незначительно диссоциирует на ионы по уравнению
2Н2О ОН– + Н3О+ или упрощенно Н2О ОН– + Н+
Диссоциация воды называется автопротолизом. Константа равновесия, характеризующая равновесие, называется константой автопротолиза:
![]() (6.3).
(6.3).
Экспериментально установлено, что при температуре 25ºС (298К) константа автопротолиза воды равна 1,8∙10–16 моль/л. При такой малой величине Ка(Н2О) активности ионов водорода и гидроксид-ионов можно считать равными концентрациям, а концентрацию недиссоциированной воды постоянной и равной 55,56 моль/л ([Н2О]= n(Н2О)/V(Н2О) моль/л или 1000 г/18 г/моль = 55, 56 моль/л).
Отсюда [Н+]∙[OH–] = Kа(Н2О) ∙ [Н2О] = 1,8∙10–16∙ 55,56 =10–14.
Произведение Кw = [Н+]∙[OH–] называется ионным произведением воды. При 25ºС (298К)
![]() (6.4).
(6.4).
В нейтральном растворе концентрации ионов водорода и гидроксид-ионов равны и [Н+] = [OH–] = 10–7 моль/л. В таком растворе рН = – lg [Н+] = – lg10–7 = 7.
В растворе, где концентрация ионов водорода выше, чем концентрация гидроксид-ионов [Н+] > [OH–], и [Н+] > 10–7 моль/л, т.е. в кислой среде pH < 7.
Соответственно в щелочной среде pH > 7 .
Измерение рН
Одним из наиболее часто применяемых методов определения рН растворов является потенциометрический метод. Он основан на измерении электродвижущей силы (ЭДС) гальванического элемента. В таком гальваническом элементе имеются два электрода, погруженные в анализируемый раствор. Потенциал одного из электродов зависит от концентрации, а точнее от активности ионов водорода в растворе. Этот электрод называется измерительным или индикаторным. Потенциал второго электрода постоянен и не зависит от концентрации ионов водорода, он называется электродом сравнения. ЭДС гальванического элемента равна разности потенциалов двух электродов и соответственно она связана с концентрацией определяемых ионов, и эту ЭДС можно измерить. В качестве измерительного электрода для определения рН наиболее широкое применение нашел стеклянный электрод. В качестве электрода сравнения чаще всего используется хлорсеребряный электрод. Потенциометр измеряет значение ЭДС этого гальванического элемента.
Потенциометрический метод широко используется в биологии и медицине для измерения рН биологических жидкостей (желудочного сока, мочи, крови, кровезаменителей и др.). Кроме того, можно измерять рН при проведении реакции нейтрализации по мере добавления кислоты к щелочи или наоборот. Этот метод называется потенциометрическим титрованием.
При нейтрализации кислоты щелочью при добавлении первых порций раствора титранта рН изменяется мало, но вблизи точки эквивалентности рН повышается резко от незначительного прибавления раствора щелочи. После точки эквивалентности рН меняется опять незначительно. Результаты титрования представляют графически в виде кривой потенциометрического титрования (рис. 6.1). На оси абсцисс откладывают число миллилитров раствора щелочи в последовательные моменты титрования, а на оси ординат – соответствующую величину рН (или ЭДС). Для нахождения точки эквивалентности продолжают линейные участки кривой титрования, как показано на рис.6.1. Затем проводят прямую через участок резкого увеличения рН. Полученный отрезок АВ делят пополам, опускают перпендикуляр на ось абцисс (см. рис.). Находят объем титранта в точке эквивалентности.
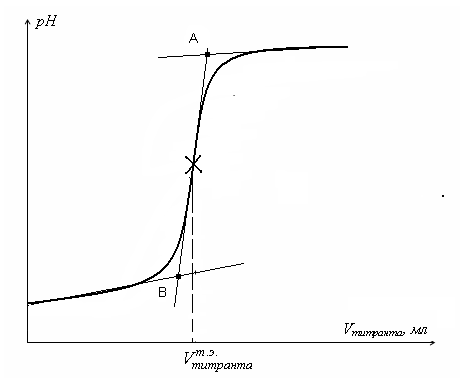
Рис. 6.1. Кривая потенциометрического титрования
Расчет концентрации кислоты по результатам титрования производят по закону эквивалентов (см. работу 1):
![]() .
.
Преимущества потенциометрического метода определения рН и потенциометрического титрования заключаются в следующем. Во-первых, рН определяется более точно, чем с помощью индикаторов. Во-вторых, можно определять рН и проводить титрование в окрашенных и мутных средах. В-третьих, точка эквивалентности при потенциометрическом титровании определяется по кривой титрования более точно, чем по изменению окраски индикатора, в этом случае исключен субъективный фактор оценки цвета раствора.
Цель работы.
-
Определить рН раствора кислоты (щелочи) потенциометрическим методом.
-
Методом потенциометрического титрования определить концентрацию кислоты (щелочи).
Реактивы.
-
Стандартные буферные растворы.
-
Вода дистиллированная.
-
Раствор кислоты.
-
Раствор щелочи.
Один из последних растворов – стандартный, т.е. точно известной концентрации. Концентрацию другого необходимо установить.
Оборудование и посуда.
-
Иономер (рН-метр).
-
Стаканы на 100 мл на 250 мл.
-
Бюретка на 25 мл.
-
Пипетка.
-
Бумага фильтровальная.
