
- •Предисловие
- •Методические рекомендации по выполнению лабораторных работ Подготовка к выполнению лабораторной работы
- •Выполнение лабораторной работы на занятии
- •Оформление работы
- •Защита лабораторной работы
- •Техника безопасности в химической лаборатории
- •Общие правила поведения в лаборатории
- •Правила работы с химическими реактивами
- •Работа со стеклянной посудой и приборами
- •Работа с ртутными термометрами
- •Техника безопасности при работе с электроприборами
- •Основные правила противопожарной безопасности
- •Химическая посуда
- •Лабораторные работы Работа 1 приготовление растворов. Титриметрический анализ
- •1. Общие понятия
- •2. Способы выражения концентрации растворов
- •3. Титриметрический анализ
- •3.1. Сущность титриметрического метода анализа
- •3.2. Классификация титриметрических методов
- •3.3. Вычисления в титриметрии
- •3.4. Растворы, применяемые в титриметрии. Приготовление стандартных растворов
- •3.5. Аппаратура и техника выполнения титриметрического анализа
- •Выполнение работы. Опыт №1. Приготовление раствора заданной процентной концентрации.
- •Требуется приготовить 100 г раствора заданной процентной концентрации определенного вещества и воды (концентрацию и вещество указывает преподаватель).
- •Рассчитывают, какая масса вещества требуется для приготовления 250 мл раствора указанной концентрации. При расчетах учитывают, что щелочи, как правило, содержат 96–98% основного вещества.
- •3.2. Определение концентрации раствора щелочи
- •Определение теплоты реакции нейтрализации
- •Проведение калориметрических измерений
- •Выполнение работы.
- •Обработка результатов.
- •Термометр Бекмана и работа с ним
- •Химия биогенных s- и p- элементов. Их биологическая роль и применение в медицине
- •Химия биогенных d- элементов. Их биологическая роль и применение в медицине
- •Работа 5 осмос
- •Измерение рН растворов потенциометрическим методом. Потенциометрическое титрование
- •Измерение рН
- •Подготовка прибора эв-74 к работе (Иономер эв-74)
- •Результаты потенциометрического титрования
- •Работа 7 определение константы скорости химической реакции
- •Кинетические уравнения реакций первого, второго и нулевого порядка
- •Работа 8 адсорбция уксусной кислоты на поверхности активированного угля
- •Работа 9 получение золя гидроксида железа (III). Коагуляция
- •Работа 10 электрические свойства коллоидных систем
- •Определение знака заряда коллоидных частиц методом капиллярного анализа
- •Выполнение опыта.
- •Электрофорез золя гидроксида железа. Определение знака заряда и величины дзета-потенциала
- •Выполнение работы.
- •Обработка результатов.
- •Задачи для подготовки к семинарским занятиям и контрольным работам
- •Тестовые задания для самоконтроля
Химия биогенных d- элементов. Их биологическая роль и применение в медицине
Элементы d-семейства (d-элементы) – это элементы, у которых последний электрон заполняет d-орбиталь предвнешнего электронного слоя (2-го снаружи слоя). К ним относятся элементы, находящиеся в середине больших периодов (между s- и р-элементами). Их называют также переходными элементами. Так как d-орбиталей пять, и на каждой может быть по два электрона, то всего на d-подуровне может быть 10 электронов. Им соответствуют 10 d-элементов. Например, в IV периоде к d-элементам относятся элемента от Sc (№21) до Zn (№30) включительно.
d-Элементы находятся в побочных подгруппах периодической системы, все они металлы. На внешнем электронном слое у большинства из них находятся по 2 электрона. Если наблюдается «провал» («проскок») электрона с s-орбитали внешнего слоя на d-орбиталь предвнешнего слоя, то на внешнем слое остается 1 электрон, как например, у Cr и Сu (элементов IV периода). Таким образом, на внешнем электронном слое у них мало электронов, они их легко отдают и являются металлами. Валентными электронами у них могут быть не только электроны внешнего слоя (ns-электроны), но и предвнешнего слоя ((n–1)d-электроны). Поэтому подавляющее большинство из них проявляет переменную валентность.
По содержанию в организме человека d-элементы относятся к микроэлементам (10–3 масс. % и ниже). Среди них есть жизненно необходимые (незаменимые) элементы – это Mn, Cu, Co, Fe, Zn, Mo, V (по классификации В.В. Ковальского). Другие, такие как, Cd, Cr, Ni, Ag, Hg и другие, относятся к примесным элементам, биологическая роль которых мало выяснена или неизвестна. Шесть d-элементов (Fe, Zn, Cu, Mn, Mo, Co) наряду с четырьмя s-элементами (Ca, K, Na, Mg) относятся к металлам жизни.
У d-элементов сильно выражена способность к комплексообразованию (слово «комплексные» означает сложные, составные). Комплексные соединения были известны химикам еще в XVIII веке. Одними из первых были открыты комплексные соли железа и кобальта. Многие биокатализаторы – ферменты также являются комплексными соединениями. Изучением их занимается бионеорганическая химия.
Рассмотрим образование комплексной соли на конкретном примере. Если к голубому водному раствору CuSO4 прибавить раствор аммиака NH3, то при этом раствор приобретает красивый ярко-синий цвет. Происходит реакция образования комплексной соли [Cu(NH3)4]SO4:
CuSO4 + 4NH3 → CuSO44NH3
Строение комплексных соединений объясняет теория А. Вернера. В молекулах комплексных соединений выделяют центральный атом или ион (М) и непосредственно связанные с ним молекулы (или ионы), называемые лигандами (L), в количестве n.
Центральный ион и окружающие его лиганды образуют внутреннюю сферу комплекса [MLn]. Внутренняя сфера связана электростатическими силами притяжения с внешней сферой, которая состоит из m частиц Х (молекулы или ионы). Общая запись формулы комплексного соединения имеет вид [MLn]Xm.
Центральный атом координирует лиганды, геометрически правильно располагая их в пространстве. Поэтому комплексные соединения называют также координационными. Число лигандов n называется координационным числом, а внутренняя сфера – координационной.
В соответствии с этим формулу комплексного соединения меди с аммиаком можно записать в виде [Cu(NH3)4]SO4, где ион меди Cu2+ – центральный ион; молекулы NH3 – лиганды; 4 – координационное число; сульфат анион SO42- – внешняя сфера. Называется данная соль сульфат тетраамминмеди (II).
Комплексные соли диссоциируют на внутреннюю и внешнюю сферу по типу сильных электролитов:
[Cu(NH3)4]SO4 [Cu(NH3)4]2+ + SO42-.
Образующийся комплексный ион [Cu(NH3)4]2+ диссоциирует как очень слабый электролит:
[Cu(NH3)4]2+ Cu2+ + 4NH3.
Концентрация образующихся ионов Cu2+ очень мала.
Константа равновесия этого процесса называется константой нестойкости комплексного иона (комплекса):
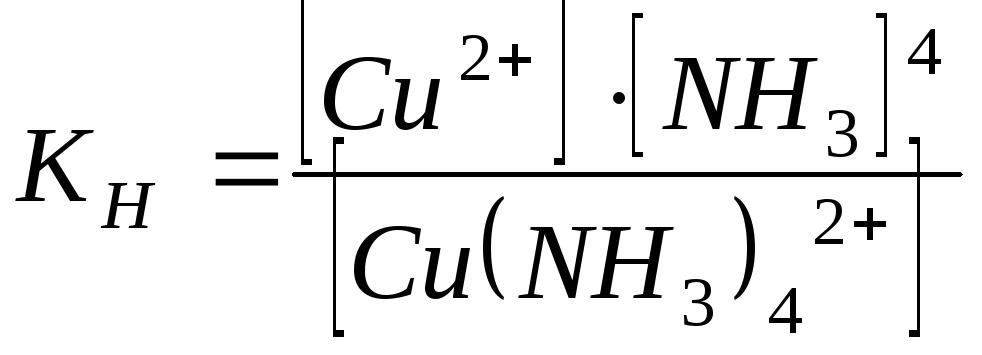 .
.
Обратная ей величина называется константой устойчивости комплекса:
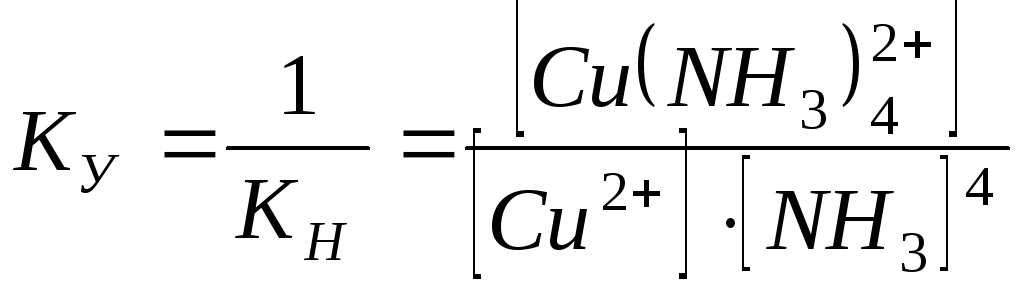 ;
КУ
= 11012.
;
КУ
= 11012.
Чем больше константа устойчивости комплекса, тем более прочным он является, в меньшей степени диссоциирует на комплексообразователь и лиганды.
Многие жизненно необходимые d-элементы содержатся в организме в виде комплексов с лигандами – аминокислотами, белками, нуклеиновыми кислотами, гормонами, витаминами и т.д. Так ион Fe2+ в качестве комплексообразователя входит в состав гемоглобина, Со2+ – в витамин В12.
Токсичность соединений тяжелых металлов (Hg, Pb, Cd, Cr, Ni) объясняется взаимодействием катионов тяжелых металлов (МТ) с бионеорганическими комплексами. Реакция, описывающая это взаимодействие, может быть записана в виде уравнения:
МБL + МТ = МБ + МТL,
где МБL – комплекс иона биогенного металла МБ (Fe, Zn, Cu, Co) с биоорганическими лигандами L (например, с порфирином); МТ – ион тяжелого металла.
Если устойчивость комплекса МТL больше, чем устойчивость МБL, происходит смещение равновесия указанной обратимой реакции вправо, и в организме накапливаются токсичные соединения МТL.
Свойства ионов металлов образовывать прочные связи с серосодержащими лигандами используются и при подборе лекарств, применяемых для лечения при отравлениях. Такие лекарства имеют общее название – антидоты. Например, в нашей стране применяется отечественные препараты унитиол, сукцимер, которые образуют с ртутью прочные комплексы.
В качестве антидотов при отравлении Zn, Cd, Hg применяют также комплексон этилендиаминтетрауксусную кислоту (ЭДТА) и ее натриевую соль (трилон Б). Применение комплексонов основано на том, что они, выступая в качестве лигандов, образуют более прочные комплексы с ионами металлов, чем эти ионы с серосодержащими группами белков, ферментов, аминокислот.
Цель работы.
-
Изучить химические свойства d–биогенных элементов и их соединений.
-
Ознакомиться с биологической ролью этих элементов и применением их соединений в медицине.
Реактивы.
-
Сульфат меди CuSO4, раствор 0,1 моль/л.
-
Аммиака NH3, раствор концентрированный.
-
Раствор соли цинка (ZnCl2 или ZnSO4) 5%.
-
Гидрокид натрия NaОH, раствор 0,05 моль/л.
-
Соляная кислота HCl, раствор 1 моль/л.
-
Пероксид водорода Н2О2, раствор 3% -ный.
-
Перманганат калия KMnO4, раствор 0,1 моль/л.
-
Серная кислота H2SO4, раствор 1 моль/л.
-
Сульфат железа (II) FeSO4, раствор 0,05 моль/л.
-
Гексацианоферрат (II) калия K4[Fe(CN)6], раствор 0,125 моль/л.
-
Роданид калия KSCN, раствор 0,5 моль/л.
-
Хлорид железа (III) FeCl3, раствор 0,2 моль/л.
-
Раствор соли Мора.
-
Гексацианоферрат (III) калия K3[Fe(CN)6], раствор 0,2 моль/л.
Оборудование и посуда.
-
Пробирки.
-
Бюретки.
-
Пипетки на 10, 20, 25 мл.
-
Колбы конические для титрования на 100 или 250 мл.
Группа IБ
Опыт 1. Получение и свойства комплексной соли меди (II)
IБ группу элементов составляют Cu, Ag, Au.
На внешнем электронном слое атомов этих элементов содержится по одному s-электрону (ns1). В образовании химических связей могут принимать участие не только ns-электроны, но и d-электроны предвнешнего слоя: (n–1)d-электроны. Конфигурация валентных уровней: Cu – 4s13d10, Ag – 5s14d10, Au – 6s15d10. Все три металла могут образовывать соединения со степенью окисления +1. Медь в соединениях проявляет также степень окисления +2, а золото образует устойчивые соединения со степенью окисления +3 и неустойчивые соединения со степенью окисления +1 и +2.
Из трех металлов группы IБ медь выполняет наиболее важную биологическую роль. Она является необходимым микроэлементом, относится к металлам жизни. Серебро – примесный микроэлемент. Золото – микроэлемент, не играющий роли для живых организмов.
В организме человека медь в основном концентрируется в печени, головном мозге и крови. Известно около двадцати пяти медьсодержащих белков и ферментов. В медьсодержащих ферментах медь находится в степени окисления +1. В окислительных процессах медь окисляется до +2. Большую группу медьсодержащих белков составляют оксидазы, к которым относится важнейший дыхательный фермент цитохромоксидаза. Очень важным медьсодержащим белком является церулоплазмин, который участвует в окислении железа (Fe2+ в Fe3+), при этом медь, входящая в состав белка, восстанавливается (Cu2+ в Cu+). Церулоплазмин, образуя комплекс с ионами меди, транспортирует их в органы, регулирует баланс меди в организме и обеспечивает выведение избытка меди из организма.
Медь вместе с железом участвует в кроветворении. При дефиците меди в организме нарушается обмен железом между плазмой крови и эритроцитами, что может привести к разрушению эритроцитов и развитию медьдефицитной анемии. Потребность человека в меди составляет 2–3 мг в сутки. Она полностью обеспечивается потребляемой пищей. Известна болезнь Коновалова-Вильсона, которая связана с избыточным количеством меди в организме.
В больших концентрациях растворимые соли меди токсичны. Так, например, медный купорос CuSO45H2O массой до 2 г вызывает сильное отравление с возможным смертельным исходом. Токсическое действие меди объясняется тем, что медь образует с белками нерастворимые бионеорганические хелаты, т.е. свертывает белки. Ионы меди, имея высокое сродство к сере, образуют прочную связь с группой –SH белков, что приводит к инактивации ферментов.
Медь (I) и медь (II) образуют также неорганические комплексные соединения. Координационное число меди (I) равно 2, а меди (II) равно 4 и 6. Например, гидроксид меди (II) растворяется в аммиаке, образуя комплекс, окрашивающий раствор в синий цвет (координационное число меди в этом комплексе равно 6):
Cu(OH)2 + 4NH3 + 2H2O = [Cu(NH3)4(H2O)2](OH)2.
Эта реакция используется для открытия (обнаружения) ионов двухвалентной меди.
Выполнение опыта
Налейте в пробирку 1 мл раствора CuSO4 и добавляйте к нему по каплям концентрированный раствор аммиака до полного растворения выпадающего вначале осадка основной соли (CuOH)2SO4. Отметьте цвет осадка и цвет образовавшегося потом раствора. Напишите уравнения реакций в молекулярной и ионной форме, считая, что медь проявляет в полученной комплексной соли координационное число 4. Составьте уравнение электролитической диссоциации образовавшейся комплексной соли и напишите выражение константы нестойкости комплексного иона. Докажите опытным путём, что в растворе этой соли имеются сульфат-ионы.
Ответьте на вопросы. В состав какого иона входят атомы меди? Каков цвет раствора, содержащего образовавшийся ион?
Группа II Б
Zn, Cd и Hg составляют группу элементов IIБ.
На внешнем электронном слое их атомов содержится по два s-электрона (ns2). Для них характерна постоянная валентность II и положительная степень окисления +2. Однако ртуть образует соединения, в которых она двухвалентна, а степень окисления равна +1, например, в соединении Hg2CI2 (каломель): Cl–Hg–Hg–Cl.
Из трёх металлов IIБ-группы цинк выполняет наиболее важную биологическую роль и по степени своей необходимости для человека относится к металлам жизни. Считают, что кадмий и ртуть какой-либо заметной биологической функции не выполняют. Если цинк является активатором многих биохимических процессов, то кадмий и ртуть попадают в организм извне, оказывают ингибирующее (тормозящее) действие на ряд ферментов, разрушая их. Кадмий и ртуть – примесные токсичные элементы, они концентрируются в основном в почках.
Цинк в организме концентрируется главным образом в мышцах, печени, поджелудочной железе, содержится также в гипофизе, половых железах, щитовидной железе. Цинк входит в состав более 40 металлоферментов, которые катализируют гидролиз пептидов, белков, некоторых эфиров и альдегидов. Одним из наиболее изученных ферментов является карбоангидраза. Этот фермент крови представляет собой бионеорганический комплекс, в котором координационное число цинка равно 4. Он влияет на процесс дыхания, газообмен в организме.
Цинк входит в состав гормона инсулина, который влияет на содержание сахара в крови. Другими словами, цинк участвует в углеводном обмене.
Растворимые соединения цинка, кадмия и ртути оказывают раздражающее воздействие на кожу, а при попадании внутрь организма в больших концентрациях вызывают отравление. Токсичность их увеличивается от цинка к ртути, что обусловлено усилением способности ионов этих металлов взаимодействовать с SH-группами, а это приводит к подавлению активности ферментов и свертыванию белков.
Некоторые соединения цинка в небольших концентрациях нашли применение в медицинской практике. Использование их основано на вяжущем, прижигающем и небольшом антисептическом действии. Так, сульфат цинка используют для приготовления глазных капель (0,25%-ный раствор). Оксид, хлорид и сульфат цинка используют также в стоматологической практике.
Цинк, как и все d-элементы, способен образовывать соединения с неорганическими лигандами. Для него координационное число 4.
К числу важнейших соединений цинка относятся оксид, гидроксид, некоторые простые и комплексные соли. Оксид ZnO и гидроксид Zn(ОН)2 проявляют амфотерные свойства, растворяются не только в кислотах, но и в щелочах:
ZnO + H2O + 2OН– = [Zn(OH)4]2–
Zn(OH)2 + 2OН– = [Zn(OH)4]2–
Гидроксид цинка получают с помощью обменной реакции при взаимодействии растворимых солей цинка со щелочами:
Zn2+ + 2OН– = Zn(OH)2
Гидроксид цинка растворяется в избытке аммиака с образованием растворимых комплексных солей – аммиакатов:
Zn(OH)2+ 4NH3 = [Zn(NH3)4](OH)2
Опыт 2. Амфотерность гидроксида цинка
В пробирку налейте примерно 1мл раствора соли цинка (сульфат или хлорид). Добавьте медленно, по каплям, раствор щелочи (NaOH). Отметьте цвет и характер образовавшегося осадка. Разделите его на две пробирки, в одну добавьте раствор кислоты (НС1), а в другую – раствор щелочи (NaOH). Что наблюдаете? Объясните наблюдения. Напишите уравнения в молекулярной и ионной форме.
Опыт 3. Комплексные соединения цинка
В пробирку налейте 1 мл раствора соли цинка. Медленно, по каплям, добавьте раствор гидроксида аммония (NH4OH) до образования осадка, а затем до полного его растворения.
Напишите уравнения происходящих реакций в молекулярной и ионной форме, учитывая, что координационное число цинка в полученном комплексном соединении равно четырем.
Напишите уравнение электролитической диссоциации образовавшегося комплексного соединения цинка и выражение константы нестойкости комплексного иона.
Группа VIIБ
Опыт 4. Окислительные свойства перманганата калия
Мn, Тc, Re – элементы, образующие группу VIIБ. Конфигурация валентных электронов этих элементов ns2(n-1)d5: Mn 4s23d5, Tc 5s24d5, Re 6s25d5.
Из элементов этой группы наиболее распространен в природе марганец. Он относится к жизненно необходимым элементам – металлам жизни. Рений и технеций не являются биогенными элементами. Рений содержится в земной коре в незначительных количествах, технеций – радиоактивный элемент, в природе практически не встречается, получен искусственным путем.
Марганец в своих соединениях проявляет степени окисления: +2, +3, +4, +6, +7.
В природе наиболее распространены соединения марганца со степенью окисления +2. Из них наиболее важны оксид, гидроксид и соли.
В медицинской практике из соединений марганца наиболее широко используют перманганат калия KMnO4. Перманганатами называются соли марганцевой кислоты HMnO4. В них Mn имеет высшую положительную степень окисления +7, поэтому перманганаты являются сильными окислителями. В зависимости от реакции среды они образуют различные продукты восстановления:
|
Среда |
Полуреакция восстановления |
Степень окисления марганца в продукте |
|
кислая |
MnO4– + 8H+ + 5e Mn2+ + 4H2O |
+2 |
|
нейтральная или слабощелочная |
Mn O4– + 2H2O + 3e MnO2 + 4OH– |
+4 |
|
сильнощелочная |
Mn O4– + e MnO42– |
+6 |
Как видно из уравнений, окислителями являются анионы MnO4–. Однако в таких формах марганец в биологических системах не существует. Очевидно, это связано с тем, что сильные окислители неприемлемы для организма как постоянные компоненты.
Для организма перманганаты являются ядами. Обезвреживание их как ядов может идти за счет окислительно-восстановительной реакции. Например:
2KMnO4 + 5H2O2 + 6CH3COOH = 2Mn(CH3COO)2 + 2CH3COOK + 8H2O + 5O2.
В уксуснокислой среде 3%-ный раствор Н2О2 действует как восстановитель. Эта реакция используется для лечения острых отравлений перманганатом.
Перманганат калия взаимодействует с органическими компонентами клеток тканей и органическими веществами протоплазмы микробов. При этом KMnO4 восстанавливается до MnO2, который также может взаимодействовать с белками, образуя комплекс бурого цвета.
Бактерицидные и прижигающие свойства перманганата обусловлены его окислительными и коагулирующим действием на белки. Вследствие того, что белки коагулируют, перманганат калия является препаратом наружного действия. Его противомикробное действие проявляется только на поверхности кожи и слизистых оболочек. Раствор KMnO4 применяют также для окисления токсичных органических веществ, переводя их в менее токсичные формы. Например, морфин окисляется в малотоксичный оксиморфин.
KMnO4 используют в клиническом и биохимическом анализе для определения некоторых ферментов. В санитарно-гигиенической практике используют метод перманганатометрии для определения окисляемости природных вод, а также промышленных сточных вод. Метод основан на высоких окислительных свойствах перманганата, которые проявляются во взаимодействии его с примесными органическими компонентами воды.
Перманганатометрия относится к методам окислительно-восстановительного титрования. Сущность метода заключается во взаимодействии раствора восстановителя (титруемый раствор) с раствором окислителя (рабочий раствор).
В окислительно-восстановительных реакциях молярная масса эквивалента вещества равна молярной массе, деленной на число отданных или присоединенных в данной реакции электронов. Например, в реакции окисления сульфата железа (II) перманганатом калия:
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
|
MnO4– + 8H+ + 5e Mn2+ + 4H2O |
×1 |
окислитель, процесс восстановления |
|
Fe2+ – e Fe3+ |
×5 |
восстановитель, процесс окисления |
Каждый ион Fe2+ отдает один электрон, а каждый ион MnO4– принимает пять электронов. Поэтому:
МЭ
(FeSO4)
=
![]()
МЭ
(KMnO4)
=
![]()
Выполнение опыта
4.1. В три пробирки налейте по 1-2 мл раствора KMnO4. В первую пробирку добавьте немного разбавленной серной кислоты, во вторую – столько же дистиллированной воды, в третью – раствор щелочи. Во все три пробирки добавьте по 1-2 мл раствора сульфита натрия. Что наблюдается? Отметьте, как изменился цвет раствора. Напишите уравнения окислительно-восстановительных реакций, определите окислитель и восстановитель, расставьте коэффициенты методом электронного баланса.
4.2. В две пробирки налейте по 1-2 мл раствора KMnO4. В первую добавьте немного разбавленной серной кислоты, во вторую – немного раствора уксусной кислоты CH3COOH. В обе пробирки добавьте по 1-2 мл 3%-ного раствора Н2О2. Что наблюдается? Напишите уравнения окислительно-восстановительных реакций и расставьте коэффициенты методом электронного баланса. Чем можно объяснить различие, наблюдаемое в двух случаях?
4.3. Возьмите две пробирки. В одну налейте 20 мл водопроводной воды, в другую – 20 мл воды из природного водоема, предположительно загрязненного органическими примесями. В каждую из этих пробирок прибавьте 1 мл 2н H2SO4 и содержимое пробирок взболтайте. Затем в воду по каплям из бюретки прибавляйте 0,1 н раствор KMnO4 до появления слабо-розовой окраски. Если проба окрашивается тремя и менее каплями раствора, то воду можно считать чистой. Если на это требуется более 3-х капель, то вода сильно загрязнена органическими веществами. Сделайте вывод о загрязнении исследуемой воды.
Опыт 5. Окислительно-восстановительно титрование (перманганатометрия). Определение железа в растворе сульфата железа (II) или в растворе соли Мора (NH4)2S04FeS046H20
Определение железа в растворе сульфата железа (II) или в растворе соли Мора (NH4)2SО4FeSО46H2О основано на реакции:
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
Для проведения этой реакции индикатор не нужен. Точку эквивалентности при титровании раствора сульфата железа (II) раствором перманганата калия определяют по изменению окраски титруемого раствора. Избыточная капля раствора перманганата калия вызывает заметное окрашивание титруемого раствора.
Содержание железа в граммах в анализируемом растворе вычисляют по формуле:
![]()
где Сн (КМnO4) – нормальность раствора КМnO4, V(KMnO4) – объем (в миллилитрах) раствора КМnO4, пошедшего на титрование, Мэ — молярная масса эквивалента железа (56 г/моль), Vмерной колбы – объем мерной колбы с раствором соли железа (в миллилитрах), Vпипетки — объем раствора соли Мора (в миллилитрах), взятый для титрования (он равен объему пипетки).
Выполнение опыта
-
Для выполнения работы используют раствор FeSO4 или раствор соли Мора, приготовленный лаборантом в колбе на 250 мл. Пипетку перед отбором пробы предварительно ополаскивают раствором FeSO4.Отбирают пипеткой 20 мл раствора FeSO4 или соли Мора, переносят его в коническую колбу, добавляют 5-10 мл 2н H2SO4.
-
Бюретку ополаскивают рабочим раствором КМnO4 (0,1н), используя для этого 5–6 мл его. После этого бюретку заполняют 0,1н КМnO4 до нулевого деления.
-
Производят титрование, добавляя из бюретки раствор КМnO4 до появления заметного на глаз бледно-розового окрашивания. Полученный результат записывают в тетрадь и повторяют титрование еще несколько раз до тех пор, пока разница в объеме раствора КМnO4, идущего на титрование, будет около 0,1 мл.
Внимание! Скорость титрования должна быть всегда одинакова, только тогда можно добиться точных результатов. Нужно учитывать, что иногда окислительно-восстановительные реакции протекают медленнее, чем реакции нейтрализации. Поэтому при добавлении первой капли раствора КМnO4 обесцвечивание может наступить не сразу. Следующую порцию раствора КМnO4 нужно добавлять только после того, как исчезнет окраска. Если титровать быстро, раствор может окраситься в бурый цвет (окраска МпО2). В таком случае титрование прекращают и берут новую порцию анализируемого раствора.
Группа VIIIБ
Опыт 6. Качественные реакции на ионы двухвалентного и трёхвалентного железа
Группу VIIIБ составляют девять d-элементов: Fe, Co, Ni, Ru, Rh, Pd, Os, Ir, Pt. He у всех элементов этой группы число валентных электронов совпадает с номером группы. Железо, кобальт, никель объединены в семейство железа. Остальные 6 элементов образуют семейство платины.
Железо и кобальт – жизненно необходимые элементы, никель – примесный токсичный элемент. Элементы семейства платины не являются биогенными.
Конфигурация валентных электронов железа 4s23d6. В соединениях железо проявляет степени окисления +2 и +3 (реже +6). Более устойчивы соединения со степенью окисления +3. Железо, как и другие d-элементы, проявляет способность к комплексообразованию. Известно большое число комплексных соединений, в которых железо имеет координационное число 6. В биологических системах железо связано в комплексы, в которых степень окисления железа +2 и реже +3. В таком жизненно важном биокомплексе, как гемоглобин, железо находится в степени окисления +2. В процессе обратимого присоединения кислорода железо в гемоглобине не меняет свою степень окисления.
В комплексных соединениях Fe(II) и Fe(III) имеют координациониое число 6, причем анионные комплексы Fe(III) более устойчивы, чем Fe(II). Уже алхимикам были известны цианидные комплексы железа: красная кровяная соль – гексацианоферрат (III) калия К3[Fе(CN)6] и желтая кровяная соль – гексацианоферрат (II) калия К4|Fe(CN)6]. Эти соли применяются в аналитической практике для определения ионов Fe2+ и Fe3+.
Железо является важным биогенным элементом и относится к «металлам жизни». В организме человека содержится около 5 г железа. Большая часть его сосредоточена в гемоглобине крови (около 70%). Гемоглобин – сложный по составу белок, содержащий и небелковую группу – гем (от греч. «гемо» — кровь). Физиологическая функция гемоглобина заключается в способности обратимо связывать кислород и переносить его от легких к тканям. Если гемоглобин условно обозначить [HbFe2+], то реакцию обратимого присоединения кислорода можно записать так:
[HbFe2+] + O2 [HbFe2+∙O2]
дезоксигемоглобин оксигемоглобин
Гемоглобин взаимодействует также с угарным газом, при этом образуется карбонилгемоглобин, который более устойчив, чем оксигемоглобин:
[HbFe2+] + CO = [HbFe2+∙CO].
Это нарушает перенос кислорода от легких к тканям и вызывает отравление организма.
Железо входит также в состав ферментов, например, цитохромов, каталазы, пероксидазы и др. Недостаток железа и кобальта в организме приводит к нарушению синтеза гемоглобина. Это, в свою очередь, вызывает заболевание крови, связанное с дефицитом железа, которое называется анемией. Для лечения анемии используются соли двухвалентного железа: хлорид и сульфат. Эффективным средством для лечения анемии являются ферамид и коамид, которые представляют собой бионеорганические комплексы соответственно железа и кобальта с никотинамидом.
Раствор FeCl3 в силу его окислительных свойств используется в медицинской практике как дезинфицирующее и кровоостанавливающее средство.
Выполнение опыта
6.1. Обнаружение ионов Fe2+.
Реактивом на ион Fе2+ служит гексацианоферрат (III) калия К3|Fe(CN)6] (красная кровяная соль).
Налейте в пробирку 1 мл раствора FeSO4 или раствор соли Мора, добавьте примерно такой же объем раствора К3|Fe(CN)6]. Выпадает осадок турнбулевой сини KFe[Fe(CN)6]. Отметьте его цвет. Напишите уравнение реакции в молекулярной и ионной форме.
6.2. Обнаружение ионов Fe3+.
Реактивом на ион Fе3+ служит гексацианоферрат (II) калия К4|Fe(CN)6] (желтая кровяная соль) и роданид калия KSCN.
-
К 1 мл раствора FeCl3 прилейте немного раствора KSCN. Напишите уравнение реакции в молекулярной и ионной формах, отметьте цвет раствора роданида железа (III).
-
К 1 мл раствора FeCl3 прилейте такой же объем К4|Fe(CN)6]. Отметьте цвет. Напишите уравнения реакции в молекулярной и ионной форме.
6.3. Различие между простыми и комплексными ионами железа (III).
Установите, обнаруживается ли ион Fe3+ в растворе комплексной соли К3[Fе(СN)6]. Для этого проведите реакцию, как в предыдущем опыте, только вместо раствора FeCl3 возьмите раствор К3[Fе(СN)6] и прилейте к нему раствор KSCN. Объясните отсутствие изменений.
Контрольные вопросы и задания.
-
Напишите электронную формулу атома меди.
-
Какова биологическая роль меди в организме человека?
-
Напишите уравнение реакции образования комплексной соли [Cu(NH3)4]SO4 и выражение для константы нестойкости комплексного иона.
-
Докажите амфотерность гидроксида цинка. Напишите уравнения соответствующих реакций.
-
Приведите примеры применения соединений цинка в медицине.
-
Напишите уравнение реакций окисления нитрита натрия перманганатом калия в кислой среде. Расставьте коэффициенты методом электронного баланса и электронно-ионным методом (методом полуреакций).
-
Как определяется молярная масса эквивалента вещества в окислительно-восстановительной реакции?
-
Что такое перманганатометрия?
-
Как обнаружить ионы Fe2+ и Fe3+.в растворах?
-
Приведите примеры, показывающие биологическую роль железа.
