
- •Клиническая Анестезиология книга первая
- •Дж. Эдвард Морган-мл. Мэгид с. Михаил
- •103473, Москва, Краснопролетарская, 16.
- •Международный центр @ International Centre for научной и технической Scientific and Technical информации Information
- •Оглавление
- •От научного редактора перевода
- •Предисловие
- •Введение
- •Глава 1 Предмет анестезиологии
- •Раздел I Анестезиологическое оборудование и мониторы Глава 2 Операционная: системы медицинского газоснабжения, микроклимат и электробезопасность
- •Глава 3 Дыхательные контуры
- •Глава 4 Наркозный аппарат
- •Глава 5 Обеспечение проходимости дыхательных путей
- •Глава 6 Интраоперационный мониторинг
- •1. Неинвазивный мониторинг артериального давления
- •2. Инвазивный мониторинг артериального давления
- •Раздел II Глава 7 Клиническая фармакология Ингаляционные анестетики
- •24 Мл пара___________
- •Глава 8 Неингаляционные анестетики
- •Глава 9 Миорелаксанты
- •Глава 10 Ингибиторы ацетилхолинэстеразы
- •Глава 11 м-холиноблокаторы
- •Глава 12 Адреномиметики и адреноблокаторы
- •Глава 13 Гипотензивные средства
- •Глава 14 Местные анестетики
- •Глава 15 Вспомогательные лекарственные средства
- •2. Блокаторы н2-рецепторов
- •Раздел III Регионарная анестезия и лечение боли Глава 16 Спинномозговая, эпидуральная и каудальная анестезия Джон e. Тецлаф, md1
- •Глава 17 Блокада периферических нервов Джон e. Тецлаф, md1
- •1. Правильная установка иглы Анатомические ориентиры
- •2. "Неподвижная игла"
- •Глава 18 Лечение боли
- •1.Ноцицепторы
- •2. Химические медиаторы боли
- •3. Модуляция боли
- •4. Упреждающая аналгезия
- •1. Анальгетики для приема внутрь
- •2. Инфильтрационная анестезия
- •1. Опиоиды
- •2. Блокада периферических нервов
- •3. Спинномозговая и эпидуральная аналгезия и применение опиоидов
- •1. Анатомия
- •2. Повреждения мышц и связок пояснично-крестцовой области
- •3. Дегенеративные изменения межпозвонковых дисков
- •4. Синдром дугоотростчатых суставов
- •5. Врожденные аномалии позвоночника
- •6. Опухоли позвоночника
- •7. Инфекции
- •8. Артриты
Глава 10 Ингибиторы ацетилхолинэстеразы
Ингибиторы ацетилхолинэстеразы — (синоним антихолинэстеразные средства) применяют главным образом для устранения действия недепо-ляризующих миорелаксантов. Вместе с тем ингибиторы ацетилхолинэстеразы оказывают влияние и на те холинорецепторы, которые располагаются вне концевых пластинок скелетных мышц. В настоящей главе кратко описана фармакология лекарственных средств, влияющих на холинергичес-кие синапсы, рассмотрены механизмы подавления активности ацетилхолинэстеразы и клиническая фармакология наиболее распространенных ингибиторов ацетилхолинэстеразы (неостигмина, эд-рофония, пиридостигмина и физостигмина).
Фармакология лекарственных средств, влияющих на холинергические синапсы
Эффекты, обусловленные действием нейротранс-миттера ацетилхолина, называются холинергичес-кими, в то время как вызванные норадреналином (синоним "норэпинефрин") — адренергическими. Ацетилхолин образуется в окончаниях холинерги-ческих нейронов из ацетилкоэнзима А и холина при участии холинацетилтрансферазы (рис. 10-1). После высвобождения в синаптическую щель ацетилхолин быстро гидролизуется ферментом ацетилхолинэстеразой на холин и ацетат.
Ацетилхолин является нейротрансмиттером всей парасимпатической нервной системы (он высвобождается в окончаниях как пре-, так и пост-ганглионарных волокон), части симпатической нервной системы (симпатические ганглии, мозговое вещество надпочечников и потовые железы), некоторых нейронов ЦНС и, наконец, соматических нервов, иннервирующих скелетные мышцы (рис. 10-2).
Холинергические рецепторы (холинорецепторы) разделяют на две группы в зависимости от их чувствительности к алкалоидам мускарину и никотину (рис. 10-2). Никотин стимулирует холинорецепторы вегетативных ганглиев и скелетных мышц, которые поэтому называются никотиночув-ствительными холинорецепторами (н-холиноре-цепторы). Мускарин стимулирует холинорецепторы эффекторных клеток, например гладких мышц бронхов, слюнных желез, синоатриального узла; это мускариночувствительные холинорецепторы (м-холинорецепторы). Н-холинорецепторы блокируются недеполяризующими миорелаксантами (см. гл. 9), тогда как м-холинорецепторы — атропи-ноподобными м-холиноблокаторами (см. гл. 11). Хотя н- и м-холинорецепторы различаются в зависимости от чувствительности к некоторым агонис-там (например, никотину и мускарину) и антагонистам (панкуронию и атропину), они реагируют на ацетилхолин (табл. 10-1). Главная задача при устранении миорелаксации ингибиторами ацетилхолинэстеразы — это максимальное усиление н-холи-нергической передачи без развития побочных м -холинергических эффектов.

Рис. 10-1. Синтез и и гидролиз ацетилхолина
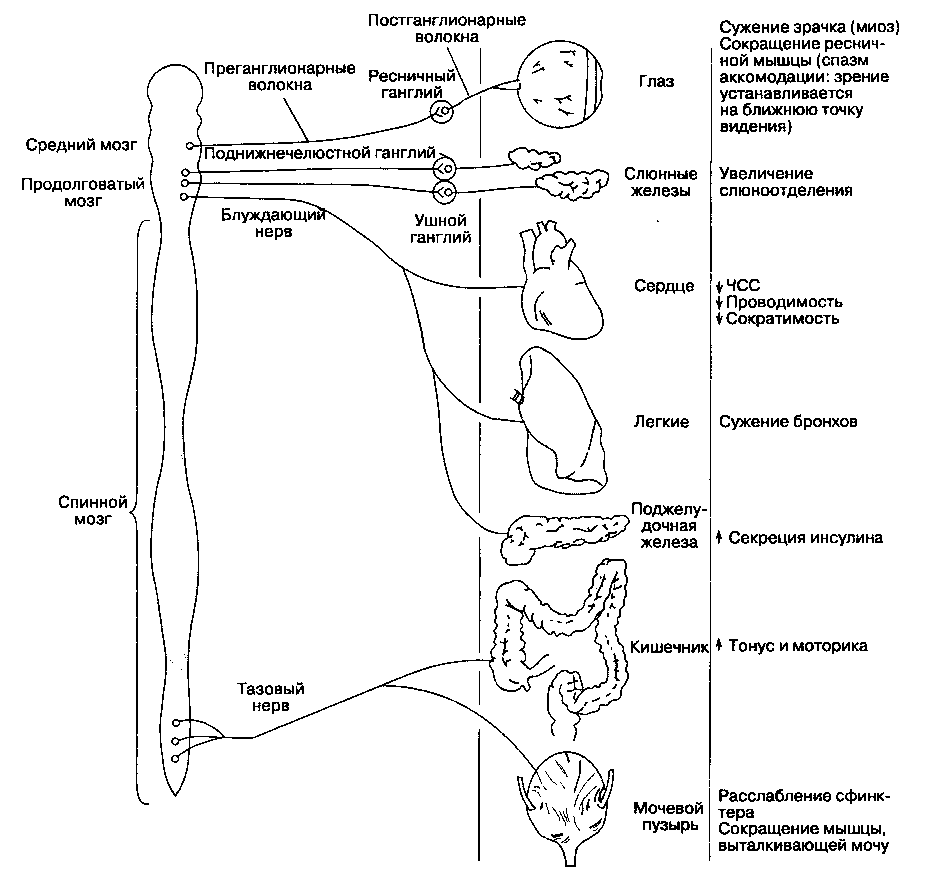
Рис. 10-2. Парасимпатическая нервная система: ацетилхолин — нейротрансмиттер как в пре-, так и в постганглионарных нейронах
Механизм действия
Нервно-мышечная передача зависит от взаимодействия ацетилхолина с н-холинорецепторами концевых пластинок скелетных мышц. Недеполяризующие миорелаксанты конкурируют с ацетилхолином за эти рецепторы, что вызывает нервно-мышечный блок. Восстановление нервно-мышечной проводимости происходит вследствие постепенной диффузии, перераспределения, метаболизма и экскреции недеполяризующего миорелаксанта или же благодаря воздействию ингибиторов ацетилхолинэстера-зы. Ингибиторы ацетилхолинэстеразы опосредованно увеличивают количество ацетилхолина, способного конкурировать с недеполяризующим muq-релаксантом, что приводит к восстановлению нервно-мышечной проводимости.
Ингибиторы ацетилхолинэстеразы, используемые в анестезиологии, являются препаратами обратимого действия: их связь с ферментом носит временный характер. Стабильность связи влияет на продолжительность действия: электростатическое притяжение и водородные связи с эдрофонием устраняют действие холинэстеразы на короткое время, ковалентные связи с неостигмином и пири-достигмином — на более длительный срок. В то же время длительность действия зависит главным образом от темпа снижения концентрации ингибиторов ацетилхолинэстеразы в плазме. Изменение дозы нивелирует различия между препаратами в отношении длительности действия. Ингибиторы ацетилхолинэстеразы обратимого действия используют также для диагностики и лечения миастении (my asthenia gravis).
Фосфорорганические соединения представляют собой класс ингибиторов ацетилхолинэстеразы необратимого действия — они образуют стабильные, длительно действующие связи с ферментом. Препараты этого класса, например эхотиофат, используют для лечения глаукомы; они также ингибируют псевдохолинэстеразу (холинэстеразу плазмы, см. гл. 38), что пролонгирует действие сукцинилхолина.
Восстановление нервно-мышечной проводимости может быть обусловлено не только инактивацией ацетилхолинэстеразы. Например, неостигмин является слабым агонистом н-холинорецепторов. Кроме того, воздействуя на пресинаптическом уровне, ингибиторы ацетилхолинэстеразы усиливают мобилизацию и высвобождение ацетилхолина.
При передозировке ингибиторы ацетилхолинэстеразы парадоксально потенцируют действие недеполяризующих миорелаксантов. Помимо того, эти препараты пролонгируют действие сукцинилхолина. Последний феномен можно объяснить двумя причинами: 1) усилением деполяризации концевой пластинки в результате увеличения количества ацетилхолина; 2) подавлением активности псевдохолинэстеразы. Неостигмин ингибирует псевдохолинэстеразу сильнее, чем эдрофоний, но активность ацетилхолинэстеразы подавляет еще более выраженно. Таким образом, хотя неостигмин незначительно замедляет метаболизм мивакурия, в конечном счете он ускоряет восстановление нервно-мышечной проводимости, блокированной этим миорелаксантом. В больших дозах неостигмин сам вызывает слабый деполяризующий нервно-мышечный блок.
ТАБЛИЦА 10-1. Характеристика холинорецепторов
|
|
Н-холинорецепторы |
М-холинорецепторы |
|
Локализация |
Вегетативные ганглии Симпатические ганглии Парасимпатические ганглии Скелетные мышцы |
Железы Слезные Слюнные Желудочные Гладкие мышцы Бронхи ЖКТ Мочевой пузырь Кровеносные сосуды Сердце Синоатриальный узел Атриовентрикулярный узел |
|
Агонисты |
Ацетилхолин Никотин |
Ацетилхолин Мускарин |
|
Антагонисты |
Недеполяризующие миорелаксанты |
М-холиноблокаторы Атропин Скополамин Гликопирролат |

Рис. 10-3. Молекулярная структура мускарина и никотина. Сравните эти алкалоиды с ацетилхолином (рис. 10-1)
Клиническая фармакология
Общие принципы
Увеличение количества ацетилхолина под действием ингибиторов ацетилхолинэстеразы влияет не только на н-холинорецепторы скелетных мышц, но и на м-холинорецепторы многих органов (табл. 10-2).
М-холинорецепторы в сердце. Стимуляция рецепторов синоатриального узла вызывает выраженную брадикардию, которая иногда приводит к остановке сердца. Этот эффект может возникать даже в денервированном сердце после трансплантации.
М-холинорецепторы бронхов. Стимуляция рецепторов вызывает бронхоспазм (сокращение гладких мышц бронхов) и усиливает секрецию бронхиальных желез.
Холинорецепторы ЦНС. Физостигмин проникает через гематоэнцефалический барьер и, стимулируя н- и м-холинорецепторы ЦНС, вызывает диффузную активацию ЭЭГ.
М-холинорецепторы в ЖКТ. Стимуляция рецепторов усиливает перистальтическую активность (пищевода, желудка, кишечника) и секрецию желез ЖКТ (например, слюнных, париетальных). Усиление моторной активности повышает риск развития несостоятельности кишечного анастомоза, тошноты, рвоты и недержания кала.
Предварительное или одновременное введение м-холиноблокаторов (атропина, гликопирролата) сводит к минимуму неблагоприятные побочные эффекты, обусловленные стимуляцией м-холино-рецепторов (см. гл. 11).
Длительность действия ингибиторов ацетилхолинэстеразы приблизительно одинакова. Элиминация обусловлена как метаболизмом в печени
ТАБЛИЦА 10-2. Побочные эффекты ингибиторов ацетилхолинэстеразы, обусловленные стимуляцией м-холинорецепторов
|
Системы органов |
Побочные эффекты |
|
Система кровообращения |
Брадикардия, аритмии |
|
Система дыхания |
Бронхоспазм, усиление секреции бронхиальных желез |
|
Головной мозг |
Диффузное возбуждение1 |
|
ЖКТ |
Спазм кишечника, усиленное слюноотделение |
|
Система мочевыделения |
Повышенный тонус мочевого пузыря |
|
Глаз |
Сужение зрачка |
|
1 Только при использовании физостигмина. |
|
(25-50 %), так и почечной экскрецией (50-75 %). Таким образом, если наличие печеночной или почечной недостаточности пролонгирует действие недеполяризующего миорелаксанта, то аналогично увеличивается продолжительность действия ингибитора ацетилхолинэстеразы.
Необходимая доза ингибитора ацетилхолинэстеразы зависит от глубины нервно-мышечного блока, который подлежит устранению. Глубину блока определяют в зависимости от мышечной реакции на стимуляцию периферического нерва. Как правило, ингибитор ацетилхолинэстеразы вне зависимости от дозы не позволяет быстро восстановить нервно-мышечную проводимость, если мио-релаксация настолько глубока, что тетаническая стимуляция не вызывает мышечной реакции. При передозировке ингибиторы ацетилхолинэстеразы парадоксальным образом замедляют восстановление нервно-мышечной проводимости (см. выше).
Чтобы предсказать время, необходимое для полного устранения недеполяризующего блока, нужно знать следующее:
• какой из ингибиторов ацетилхолинэстеразы применяли и в какой дозе;
• эффект какого из недеполяризующих миорелаксантов предстоит устранить;
• глубину нервно-мышечного блока.
Например, эдрофоний действует быстрее, чем нео-стигмин; высокие дозы неостигмина восстанавливают нервно-мышечную передачу быстрее, чем низкие; эффект от действия миорелаксантов средней продолжительности действия устраняется быстрее эффекта миорелаксантов длительного действия; поверхностный блок устранить легче, чем глубокий (глубоким называют такой нервно-мышечный блок, когда при одиночном стимуле мышечный ответ составляет менее 10 % от нормы). Эффекты миорелаксантов короткого действия и средней продолжительности действия устраняются меньшими дозами ингибиторов ацетилхолинэстеразы и быстрее, чем при использовании миорелаксантов длительного действия (при одинаковой глубине блока). Эти преимущества могут быть утрачены при тяжелой дисфункции печени или почек (например, использование векурония при печеночной недостаточности), а также при дефиците ферментов (например, применение мивакурия при гомозиготном дефекте гена псевдохолинэстеразы). После введения миорелаксанта длительного действия спонтанное восстановление нервно-мышечной проводимости до уровня, позволяющего применить ингибитор ацетилхолинэстеразы, может продолжаться в зависимости от дозы более 1 ч (эти препараты не подвергаются значительному метаболизму и экскретируются медленно). Чем больше факторов, способствующих быстрому устранению нервно-мышечного блока, тем ниже риск сохранения остаточной миорелаксации в палате пробуждения.
Хотя скорость восстановления нервно-мышечной проводимости отнюдь не в первую очередь зависит от момента введения ингибитора ацетилхо-линэстеразы, тем не менее большинство специалистов рекомендуют вначале дождаться появления первых признаков спонтанного восстановления нервно-мышечной проводимости (например, при одиночном стимуле мышечный ответ должен составлять более 10 % от нормы). Ингибиторы аце-тилхолинэстеразы обязательно назначают больным, которым вводили недеполяризующие миорелаксанты, в двух случаях: в отсутствие полного восстановления нервно-мышечной проводимости или если планируется продленная ИВЛ в послеоперационном периоде. В последнем случае необходимо также вводить седативные препараты.
Мониторинг нервно-мышечной передачи путем стимуляции периферического нерва и регистрации вызванного мышечного ответа обсуждается в гл. 6 и 9. В общем, чем выше частота стимуляции, тем выше чувствительность методики: тетаничес-кая стимуляция с частотой 100 Гц > тетаническая стимуляция с частотой 50 Гц и TOF-режим > одиночный стимул. Так как стимуляция периферического нерва вызывает чувство дискомфорта, то у бодрствующего больного применяют альтернативные тесты нервно-мышечной проводимости. Чувствительность этих клинических тестов тоже варьируется: удержание поднятой головы > сила вдоха > жизненная емкость легких > дыхательный объем. Следовательно, восстановление нервно-мышечной проводимости можно считать полноценным при устойчивом тетаническом сокращении
в течение 5 с после стимуляции с частотой 100 Гц у больного без сознания или же при уверенном удержании поднятой головы бодрствующим больным. Если ни одного из этих двух феноменов не наблюдается, то интубационную трубку оставляют на месте и продолжают проводить ИВЛ.
Отдельные ингибиторы ацетилхолинэстеразы
Неостигмин Структура
Неостигмин состоит из карбаматной части и четвертичной аммониевой группы (рис. 10-4). Карба-матная часть обеспечивает связь с ацетилхолинэс-теразой, а четвертичная аммониевая группа делает молекулу нерастворимой в жирах, поэтому нео-стигмин не проникает через гематоэнцефаличес-кий барьер.
Дозировка и форма выпуска
Максимальная рекомендованная доза составляет 0,08 мг/кг (не более 5 мг у взрослых), но и меньшие дозы часто позволяют добиться желательного эффекта (табл. 10-3). Форма выпуска — раствор (во флаконах по 10 мл), 1 мл которого может содержать 1 мг (наиболее распространенная концентрация), 0,5 мг и 0,25 мг препарата.
Применение
Неостигмин в дозе 0,04 мг/кг начинает действовать через 5-10 мин (у детей и пожилых быстрее), продолжительность действия составляет более 1 ч (у пожилых дольше). У детей и пожилых пациентов чувствительность к неостигмину повышена, что позволяет применять меньшие дозы препарата по сравнению со стандартными (в пересчете на массу тела). Возникновение побочных эффектов, обусловленных стимуляцией м-холинорецепто-ров, предотвращают предварительным или одновременным введением м-холиноблокатора. Используют Гликопирролат (0,2 мг на 1 мг неостигмина) или атропин (0,4 мг на 1 мг неостиг-мина). Гликопирролат начинает действовать одновременно с неостигмином и не вызывает столь выраженной тахикардии, как атропин. Неостигмин, кроме того, применяют для лечения миастении (mуаsthenia gravis), атонии мочевого пузыря и паралитического илеуса.

Рис. 10-4. Молекулярная структура неостигмина, пиридостигмина, эдрофония и физостигмина
ТАБЛИЦА 10-3. Выбор и доза ингибитора ацетилхолинэстеразы определяет выбор и дозу м-холиноблокатора
|
Ингибитор ацетилхолинэстеразы |
Стандартная доза ингибитора ацетилхолинэстеразы |
Рекомендованный м-холиноблокатор |
Доза м-холиноблокатора (на 1 мг ингибитора ацетилхолинэстеразы) |
Стоимость устранения нервно-мышечного блока |
|
Неостигмин Пиридостигмин Эдрофоний Физостигмин |
0,04-0,08 мг/кг 0,1-0,4 мг/кг 0,5-1 мг/кг 0,01-0,03 мг/кг |
Гликопирролат Гликопирролат Атропин Необходимость возникает редко |
0,2мг 0,05 мг 0,014мг НП |
H H С НП |
Примечание. Стоимость рассчитывается на основе средних оптовых цен: H — низкая, С — средняя, НП — не применяется.
Пиридостигмин
Структура
У пиридостигмина отсутствует четвертичная аммониевая группа, в остальном его структура полностью аналогична таковой неостигмина. Подобно нео-стигмину Пиридостигмин ковалентно связывается с ацетилхолинэстеразой и не растворяется в жирах.
Дозировка и форма выпуска
Пиридостигмин в 5 раз слабее неостигмина, его максимальная доза составляет 0,4 мг/кг (20 мг у взрослых). Форма выпуска — раствор, 1 мл которого содержит 5 мг препарата,
Применение
Пиридостигмин действует медленнее (начало действия развивается через 10-15 мин) и дольше (> 2 ч), чем неостигмин. Для предупреждения тахикардии вводят м-холиноблокаторы. Предпочтительно использовать Гликопирролат (0,05 мг на 1 мг пиридостигмина), потому что он начинает действовать медленнее, чем атропин (0,1 мг на 1 мг пиридостигмина).
Эдрофоний
Структура
У эдрофония нет карбаматной группы, поэтому он связывается с ацетилхолинэстеразой нековалент-но. Четвертичная аммониевая группа препятствует растворению в жирах.
Дозировка и форма выпуска
Эдрофоний более чем в 10 раз слабее неостигмина. Рекомендованная доза — 0,5-1 мг/кг. Форма выпуска — раствор, 1 мл которого содержит 10 мг препарата. Существует также комбинированный препарат "Энлон-плюс", в 1 мл которого находится 10 мг эдрофония и 0,14 мг атропина.
Применение
Эдрофоний — препарат наиболее быстрого (эффект развивается через 1-2 мин) и короткого действия из всех ингибиторов ацетилхолинэстеразы. Не следует использовать данный препарат в низких дозах, потому что в этом случае миорелаксанты длительного действия могут оказывать свое влияние уже после завершения эффектов эдрофония. Возраст не влияет на чувствительность к эдрофонию, что отличает его от неостигмина. Эдрофоний менее эффективен, чем неостигмин, в устранении глубокого нервно-мышечного блока. В равноэффективных дозах эдро-фоний слабее стимулирует м-холинорецепторы, чем неостигмин и Пиридостигмин, что позволяет вводить половинную дозу м-холиноблокатора. Эдрофоний начинает действовать одновременно с атропином (при одномоментном введении). На 1 мг эдрофония вводят 0,014 мг атропина. Можно использовать и Гликопирролат (0,007 мг на 1 мг эдрофония), но его следует вводить за несколько минут до эдрофония во избежание бра-дикардии.
Физостигмин
Структура
Физостигмин — это третичный амин. В его состав входит карбаматная группа, а четвертичная аммониевая группа отсутствует. Следовательно, физостигмин жирорастворим и (единственный из применяемых в клинике ингибиторов ацетилхолинэстеразы) может проникать через гематоэнцефалический барьер.
Дозировка и форма выпуска
Доза физостигмина составляет 0,01-0,03 мг/кг. Форма выпуска — раствор, 1 мл которого содержит 1 мг препарата.
Применение
Жирорастворимость и способность физостигмина проникать в ЦНС ограничивают применение препарата для устранения эффекта недеполяризующих миорелаксантов. По той же причине физостигмин эффективно устраняет центральный антихоли-нергический синдром при передозировке атропина и скополамина (гл. 11). Помимо этого, физостигмин в ряде случаев устраняет депрессию ЦНС или, наоборот, делирий, обусловленные применением бен-зодиазепинов и ингаляционных анестетиков. Сообщалось, что физостигмин способен ликвидировать вызванную морфином депрессию дыхания, вероятно, вследствие того, что морфин угнетает высвобождение ацетилхолина в головном мозге. Эти эффекты физостигмина носят кратковременный характер и могут потребовать повторного введения препарата. При использовании физостигмина в рекомендованных дозах брадикардия возникает редко, но тем не менее следует держать наготове атропин или глико-пирролат. Гликопирролат не проникает через гематоэнцефалический барьер и, следовательно, не способен устранить центральные эффекты физостигмина (гл. 11). К прочим побочным эффектам, обусловленным стимуляцией м-холинорецепторов, относятся избыточное слюноотделение, рвота и судороги. В отличие от остальных ингибиторов ацетилхолинэстеразы физостигмин почти полностью расщепляется эстеразами плазмы, в то время как почечная экскреция не играет заметной роли в элиминации.
Случай из практики: дыхательная недостаточность в палате пробуждения
Женщина, 66 лет, с массой тела 85 кг поступила в палату пробуждения после холецистэктомии.
Во время анестезии применяли изофлюран и пан-куроний. По завершении операции анестезиолог ввел 6 мг морфина сульфата для предотвращения послеоперационной боли, а также 3 мг неостигми-на с 0,6 мг гликопирролата для устранения остаточной миорелаксации. Доза ингибитора ацетилхолинэстеразы была выбрана эмпирически, на основе клинических наблюдений. Хотя в момент поступления в палату пробуждения дыхание у больной было адекватным, постепенно дыхательный объем стал прогрессивно снижаться. При анализе газов артериальной крови (FiO2 40 %) получены следующие данные: PaCO2 62 мм рт. ст., PaO2 110 мм рт. ст., рН 7,26.
Какие из примененных лекарственных средств могли вызвать гиповентиляцию?
Изофлюран, морфина сульфат и панкуроний — все эти препараты угнетают реакцию вентиляции на гиперкапнию.
Почему дыхательная недостаточность возникла только в палате пробуждения?
Это могло произойти из-за отсроченного действия морфина сульфата, отсутствия сенсорной стимуляции в палате пробуждения, усталости дыхательной мускулатуры, а также при невозможности глубокого вдоха вследствие боли в области операционной раны.
Могла ли у больной сохраняться остаточная миорелаксация?
Если перед назначением неостигмина не проводили стимуляцию периферического нерва или недостаточно внимательно оценивали восстановление нервно-мышечной проводимости уже после введения препарата, то риск остаточной миорелаксации достаточно высок. Предположим, что при тетани-ческой стимуляции с частотой 100 Гц не получено мышечного ответа или же он чрезвычайно слаб. В этом случае даже максимальная доза неостигмина (5 мг) не приведет к восстановлению нервно-мышечной проводимости. Чувствительность к миорелаксантам средней продолжительности действия и длительного действия чрезвычайно варьируется, поэтому при их использовании обязательно проводят мониторинг нервно-мышечной проводимости с помощью стимуляции периферического нерва. Даже если нервно-мышечная проводимость частично восстановилась, гиповентиля-ция может потенцировать миорелаксацию. К прочим факторам (помимо респираторного ацидоза), которые препятствуют устранению эффекта недеполяризующих миорелаксантов, относят: глубокий нервно-мышечный блок, электролитные расстройства (гипомагниемия, гипокалиемия и гипо-кальциемия), гипотермию (температура < 32 0C), некоторые лекарственные средства (см. табл. 9-4), метаболический алкалоз (вследствие сопутствующей гипокалиемии и гипокальциемии) и ряд сопутствующих заболеваний (см. табл. 9-7).
Как проверить степень устранения нервно-мышечного блока?
Тетаническая стимуляция — чувствительный метод оценки нервно-мышечной проводимости, но он вызывает дискомфорт у бодрствующего больного. Такой больной легче перенесет стимуляцию в режиме двойной вспышки благодаря ее кратковременности. Многие клинические тесты нервно-мышечной проводимости, такие как определение жизненной емкости легких и дыхательного объема, имеют низкую чувствительность: они могут быть успешно выполнены, даже если блокировано 70-80 % н-холинорецепторов скелетных мышц. Кроме того, 70 % рецепторов могут оставаться блокированными при нормальном мышечном ответе на стимуляцию в TOF-режиме. Однако если больной способен удерживать приподнятую голову в течение 5 с, то блокировано менее 33 % рецепторов.
Какое лечение следует назначить?
Во избежание респираторного ацидоза проводят вспомогательную вентиляцию. Даже если экскурсии диафрагмы кажутся адекватными, остаточная миорелаксация может вызвать нарушение проходимости дыхательных путей. Необходимо ввести дополнительную дозу неостигмина (вместе с м-хо-линоблокатором). Общая доза при этом должна составить 5 мг. Если эти меры не приведут к успеху, то следует перевести больную на ИВЛ через эндотрахеальную трубку. ИВЛ выполняют до тех пор, пока полностью не восстановится нервно-мышечная проводимость.
Избранная литература
Bevan D. R., Donati F., Kofman A. F. Reversal of neuromuscular blockade. Anesthesiology, 1992; 77: 785. В этой статье представлены современные методы оценки нервно-мышечной проводимости, фармакология ингибиторов ацетилхолинэстеразы, а также клинические состояния, которые влияют на устранение нервно-мышечного блока.
Connely R. Muscle relaxant antagonists. Chapter 13. In: Muscle Relaxants: Basic and Clinical Aspects. Katz R. L. (ed.). Grune & Stratton, 1985. Глава содержит ответы на многие вопросы, касающиеся устранения действия недеполяризующих миорелаксантов.
Pappano A. J., Watanabe A. M. Cholinoreceptor-activating & cholinesterase-inhibiting drugs. Chapter 7. In: Basic & Clinical Pharmacology, 5th ed. Katzung B. G. (ed.) Appleton & Lange, 1994.
Stocking R. K. Pharmacology and Physiology in Anesthetic Practice, 2nd ed. Lippincott, 1991. Современный взгляд на ингибиторы ацетилхолинэстеразы.
Taylor P. Anticholinesterase agents. Chapter 7., In: The Pharmacological Basis of Therapeutics, 8th ed. Gilman A. G. et al. (eds). Pergamon, 1990. Хороший источник информации, позволяющий разобраться во взаимоотношении между структурой и активностью ингибиторов ацетилхолинэстеразы, а также в их клиническом применении.
