электронного удара при интерпретации полевых экспериментов нужно учитывать ряд дополнительных факторов. Среди них одним из главных факторов, как это видно из изложенного выше, является ориентация молекулярного иона относительно вектора электрического поля. Еще одно косвенное экспериментальное доказательство этого утверждения можно найти
вработе [75], в которой исследовались полевые масс-спектры стереоизомеров дигалогеноциклобутанов, 1,2-добромэтиленов и некоторых алкенов. В частности показано, что интенсивности линий одних и тех же осколочных ионов сильно различаются для стереоизомеров одного и того же соединения. Это связано с тем, что исходные молекулы и дочерние молекулярные ионы различных стереоизомеров по-разному ориентируются по отношению к вектору поля. В случае пропаналя и других молекул с простыми связями С–С их различные ротамеры ведут себя в поле как стереоизомеры в результате увеличения барьера свободного вращения вокруг одинарных связей. Такое увеличение барьера, как уже отмечалось выше, связано с переориентацией
молекулы или иона при повороте какой-либо группы.
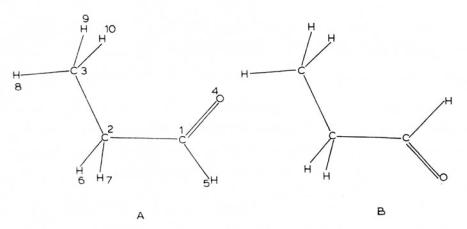
Перейдем к бутаналю (Б) и его положительному иону (Б+) [63]. Наиболее стабильными оказались две из четырех исследованных плоских конформаций
(рис. 11).
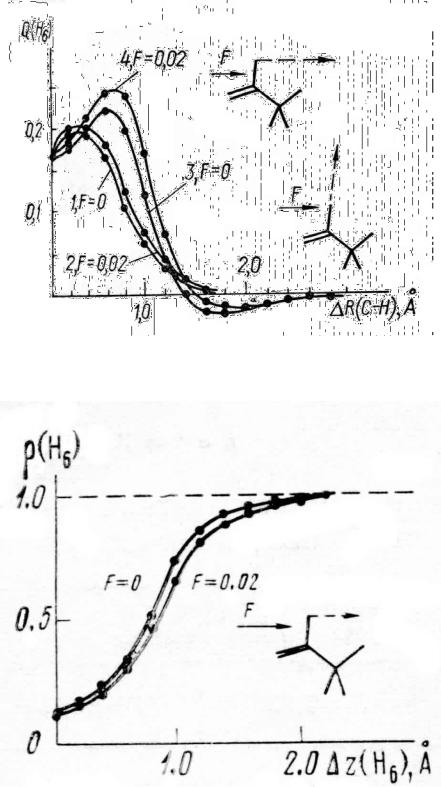
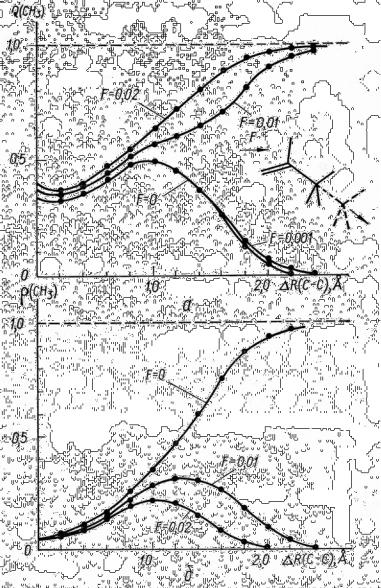
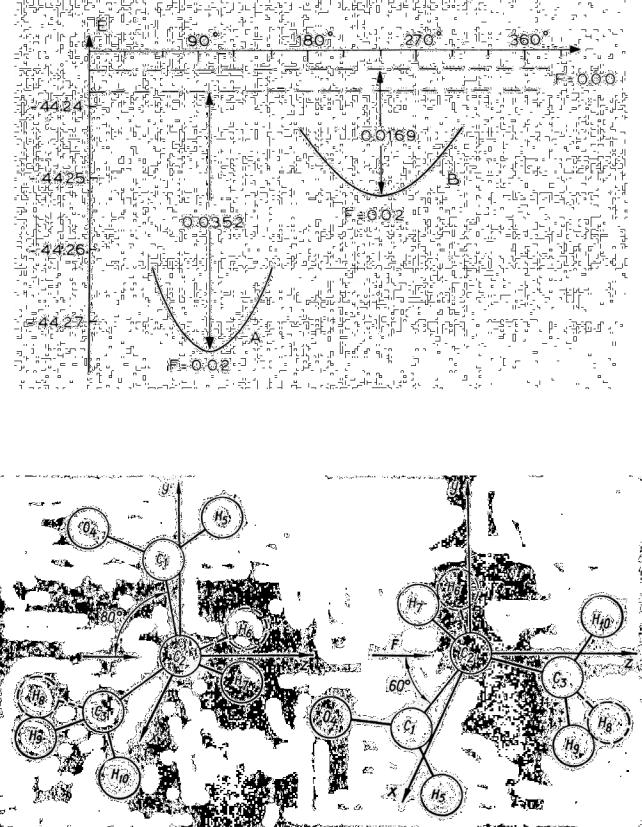
Вэкспериментальном масс-спектре бутаналя наиболее интенсивной среди линий осколочных ионов при высоких полях является линия иона СН3+. Из табл. 9 видно, что знак и величина изменения двухцентрового вклада,
соответствующего связи С3–С4, указывают на существенное ослабление ее при ионизации молекулы, особенно в случае ротамера II. На характер диссоциации по этой связи сильно влияет величина внешнего электрического поля (рис. 12).
Вотсутствии поля разрыв по связи С 3–С4 происходит преимущественно с образованием нейтрального метильного радикала. Увеличение поля уже до 0.01 ат. ед. приводит к изменению продуктов диссоциации – образуется ион СН3+. Отметим, что при поле 0.005 ат. ед. не удалось прийти к однозначному выводу о характере диссоциации связи С3–С4, так как при RС3–С4 = 1.8 Å не удалось получить самосогласованного решения.
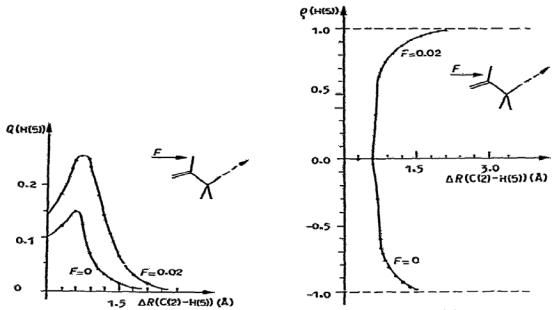
Наличие в полевом масс-спектре линии иона с М = 57 а. е. м., соответствующей иону (СН2СН2СНО)+, можно объяснить разрывом связи С3–С4
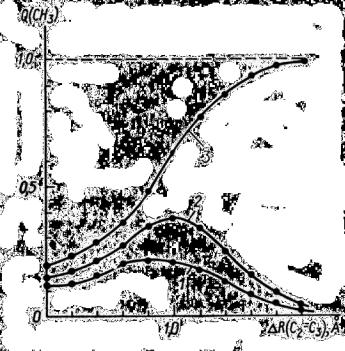
вротамере I. Ориентация этой связи по отношению к вектору поля в этом ротамере менее всего способствует ее разрыву с образованием иона СН3+ по сравнению с ротамером II. Поскольку именно наличие поля является причиной образования иона СН3+ при диссоциации по связи С3–С4, то можно ожидать, что к ротамеру I следует приложить более высокое поле для получения метильного иона. Такое предположение подтверждается расчетами (рис. 13).