
Vnutrennie_bolezni_6-e_izd_Makolkin
.pdfсимптомы непатогномоничны для ИМ и могут встречаться при ряде заболеваний (ревматизм, миокардит, перикардит и т.д.).
Физическое исследование помогает выявить симптомы возможных осложнений.
Для кардиогенного шока характерны: холодная кожа серо-бледного цвета, покрытая липким потом (нарушение периферической циркуляции); олигоанурия (уменьшение мочеобразования); нитевидный пульс; уменьшение пульсового давления (менее 20-30 мм рт.ст.); снижение систолического АД (ниже 80 мм рт.ст.).
Могут наблюдаться симптомы острой левожелудочковой недостаточности: одышка, ортопноэ, влажные незвонкие мелкопузырчатые хрипы в легких.
Увеличенная печень, периферические отеки - симптомы недостаточности кровообращения в большом круге.
При физическом обследовании представляется возможным обнаружить брадитахикардию, экстрасистолию, МА, ПТ.
Диагностическое значение всех указанных осложнений невелико, так как они встречаются и при других заболеваниях. Лишь в сочетании с анамнезом и данными третьего этапа диагностического поиска они значимы при постановке диагноза ИМ.
Большое диагностическое значение приобретает выявление острой аневризмы (патологическая пульсация в прекардиальной области в четвертом межреберье слева от грудины), разрыва межжелудочковой перегородки (интенсивный систолический шум в нижней трети грудины с симптомами быстро нарастающей недостаточности кровообращения в малом и большом круге), разрыва или отрыва сосочковой мышцы (дующий систолический шум на верхушке сердца, иногда определяемый пальпаторно, в сочетании с нарастающим застоем в малом круге кровообращения).
Третий этап диагностического поиска позволяет:
•поставить окончательный диагноз ИМ;
•уточнить его локализацию и распространенность (степень поражения миокарда);
•подтвердить или выявить нарушения ритма и проводимости;
•выявить новые осложнения (аневризма сердца, очаговое поражение почек при тромбоэмболии).
Поставить окончательный диагноз ИМ можно на основании сочетания признаков резорбционно-некротического синдрома и данных ЭКГ.
• Резорбционно-некротический синдром выявляют по результатам общеклинического и биохимического исследований крови: лейкоцитоз со сдвигом лейкоцитарной формулы влево и анэозинофилия (не всегда) с первых часов заболевания; увеличение СОЭ с 3-5-го дня.
- В настоящее время самым информативными методом диагностики ИМ служит определение в плазме крови сердечных тропонинов Т или I. При возникновении некроза
391
миокарда уровень сердечных тропонинов повышается до диагностически значимого уровня не ранее, чем через 6 ч, поэтому для диагностики ИМ рекомендуется 2-кратное определение сердечных тропонинов: при поступлении больного в стационар и повторно через 6-9 ч. Диагностически значимым повышением уровня сердечных тропонинов в плазме крови считают уровень, превышающий 99-й перцентиль значений этого показателя у здоровых лиц, определенный лабораторным методом, у которого коэффициент вариации определений не превышает 10%. Величины 99-го перцентиля нормальных значений для различных лабораторных методов могут быть найдены на веб-сайте Международной федерации клинической химии. Повышенный уровень сердечных тропонинов сохраняется
вплазме крови до 7-14 дней после возникновения ИМ.
-Если использование сердечных тропонинов в качестве маркеров некроза миокарда невозможно, допустимо использование с этой целью MB-КФК, хотя чувствительность ее несколько ниже, чем чувствительность сердечных тропонинов. Так же как и в случае с сердечными тропонинами, диагностически значимого уровня в плазме крови MB-КФК достигает через 6-9 ч после возникновения некроза миокарда, однако сохраняет повышенное значение только около 2-3 суток. Аналогично сердечным тропонинам, диагностически значимыми считают уровни MB-КФК в плазме крови, превышающие 99-й перцентиль значений этого показателя у здоровых лиц.
-Еще одним биохимическим маркером некроза миокарда, используемым для диагностики инфаркта, служит миоглобин. Его преимущество - быстрое повышение концентрации в плазме крови, которая достигает диагностического значения уже через 2 ч после возникновения ангинозного приступа. Однако миоглобин имеет существенный недостаток - при высокой чувствительности он обладает низкой специфичностью.
-Использовавшееся ранее в диагностике ИМ определение в плазме крови уровня аминотрансфераз (АСТ, АЛТ), лактатдегидрогеназы (ЛДГ) и ее изоферментов (ЛДГ-1 и ЛДГ-2) в настоящее время потеряли свое значение и практически не применяются.
• ЭКГ - один из основных методов диагностики ИМпST, который позволяет установить диагноз ИМ, уточнить его локализацию, глубину и обширность поражения, фазу течения; подтвердить или выявить нарушения ритма и проводимости; высказать предположение о развитии аневризмы сердца.
-У больных с ОКСпST и у больных с ИМпST в период развивающегося ИМ и в начальный период острого ИМ (первые 6-12 ч заболевания) отмечают подъем сегмента ST
втак называемых «прямых» отведениях (в этих отведениях в последующем будет формироваться патологический зубец Q) и реципрокное снижение ST в отведениях, при этом изменений комплекса QRS и формирования патологических зубцов Q пока еще не будет. Диагностически значимым считают подъем сегмента ST в точке J в 2 последовательных отведениях и более >0,2 мм (0,2 мВ) для мужчин и >=0,15 мм (0,15 мВ) для женщин в отведениях V2-V3 и >0,1 мм (0,1 мВ) в других отведениях.
-В период острого ИМ в «прямых» отведениях ЭКГ резко снижается амплитуда зубца R и формируется патологический зубец, по амплитуде равный не менее 1/3 зубца R, а по длительности - равный 0,04 с и более (ранее называвшийся «крупноочаговым» ИМ). Либо зубец R исчезает полностью и формируется патологический комплекс QS (ранее называвшийся трансмуральным ИМ; рис. 2-18).
392
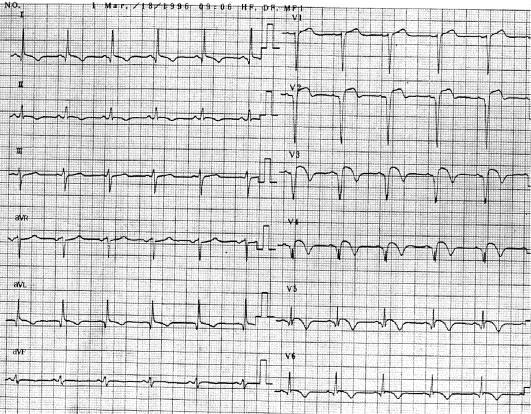
-Последующая эволюция ЭКГ при ИМпST сводится к возвращению сегмента ST к изоэлектрической линии и формированию в «прямых» отведениях отрицательного («коронарного») зубца Т.
-Для распространенного ИМ передней стенки левого желудочка, включая область верхушки, межжелудочковой перегородки и боковой стенки, характерны изменения ЭКГ
вотведениях I, II, aVL и с V2 по V6; для инфаркта в области верхушки левого желудочка -
вотведениях V3-V4; при поражениях области межжелудочковой перегородки выявляют изменения в отведениях V1-V3; при инфаркте боковой стенки - в отведениях I, aVL и V5, V6; для инфаркта нижней стенки характерны изменения - в отведениях II, III и aVF.
Рис. 2-18. Острый период инфаркта миокарда (3-и сут) у больного с ИМпST (тот же больной, что и на рис. 2-15): ЭКГ-признаки формирования инфаркта миокарда с зубцом Q передней, верхушечной, септальной и боковой областей левого желудочка: появление патологических зубцов Qи QS в отведениях I, aVL, V2-6; сегмент ST снизился по сравнению с рис. 2-18, однако еще не опустился до изолинии. Начало формирования негативных «коронарных» зубцов Т отведениях I, aVL, V2-6
-ЭКГ в 12 стандартных отведениях не является информативной в случае предшествовавшей блокады левой ножки пучка Гиса и при инфаркте правого желудочка.
-На ЭКГ могут выявлять самые разнообразные нарушения ритма, встречающиеся при ИМ. По ЭКГ можно узнать впервые о нарушениях предсердно-желудочковой проводимости и проводимости по ножкам пучка Гиса, определить характер блокады.
393
- Признаком, позволяющим предположить аневризму, является так называемая «застывшая» ЭКГ - сохранение подъема сегмента ST в сочетании с комплексом QS в «прямых» отведениях, при этом может отмечаться «коронарный» зубец Т.
•Ультразвуковое исследование сердца - важный дополнительный метод исследования у больных с инфарктом. УЗИ позволяет выявить участки нарушения локальной сократимости миокарда левого желудочка (гипокинезия, акинезия), соответствующие зоне поражения, а также состояние сосочковых мышц и межжелудочковой перегородки, которые также могут поражаться при ИМ. Велико значение УЗИ сердца в оценке глобальной сократимости левого желудочка (величина фракции выброса левого желудочка), в оценке его формы, размеров, в распознавании таких осложнений, как образование тромбов в полостях сердца, разрывов миокарда, возникновении перикардита.
•Рентгеноскопию органов грудной клетки рекомендуется проводить у всех больных с подозрением на ИМ либо с уже установленным диагнозом инфаркта. Для этого обычно используют передвижные рентгеновские установки. Рентгенография органов грудной клетки позволяет уточнить состояние легких, сердца. Особенно велико ее значение в диагностики начальных признаков застоя в малом круге кровообращения, которые еще не проявляются клинически.
В подавляющем большинстве случаев на этом третий этап диагностического поиска заканчивается и формулируется развернутый клинический диагноз. Иногда прибегают к
специальным методам диагностики.
• Визуализация ИМ с помощью радиоактивных изотопов. Этот метод применяют, если затруднена диагностика ИМ с помощью ЭКГ, а исследование активности ферментов сыворотки крови невозможно или малоинформативно.
-Пирофосфат, меченный технецием (99mTc-MIBI), начинает накапливаться в зоне некроза спустя 12 ч от начала заболевания, и очаг «свечения» определяется до 2 нед, а при обширных поражениях - 2-3 мес.
-Реже используют радиоактивный талий (T1201), который накапливается в хорошо кровоснабжаемых участках миокарда и не поступает в зону некроза.
• Селективная коронарография в остром периоде ИМ применяется, если планируется выполнение первичной ангиопластики и стентирования коронарных артерий.
Диагностические критерии инфаркта миокарда
Повышение и (или) последующее снижение уровня биохимических маркеров некроза миокарда в крови (предпочтительно сердечных тропонинов), если их концентрация как минимум в одной пробе крови превышает верхнюю границу нормы, принятую в данной лаборатории, и имеется как минимум одно из следующих свидетельств ишемии миокарда:
•клиническая картина ишемии миокарда;
•изменения ЭКГ, указывающие на появление ишемии миокарда (возникновение смещений сегмента ST-T, блокады левой ножки пучка Гиса);
•появление патологических зубцов Q на ЭКГ;
394
• появление признаков потери жизнеспособного миокарда или нарушений локальной сократимости при использовании методик, позволяющих визуализировать сердце.
Формулировка развернутого клинического диагноза ИМ должна отражать:
•характер течения (первичный, рецидивирующий, повторный);
•глубину некроза (ИМ с зубцом Q, или ИМ без зубца Q);
•локализацию ИМ;
•дату возникновения ИМ;
•осложнения (если они имелись): нарушения ритма и проводимости, острая сердечная недостаточность и др.;
•фоновые заболевания - атеросклероз коронарных артерий (если выполнялась коронароангиография, то указывается его тяжесть, распространенность и локализация), ГБ (при ее наличии) и ее стадия, сахарный диабет и др.
Лечение
Оказание помощи больным с ИМпST складывается из системы организационных и лечебных мероприятий.
• Организационные мероприятия включают:
-раннюю диагностику врачами скорой медицинской помощи, участковыми врачами, терапевтами и врачами общей практики районных поликлиник ОКСпST на основании критериев, приведенных ранее (см. ОКСпST);
-как можно более раннюю госпитализацию бригадой скорой помощи больного с ОКСпST в блок интенсивной кардиологии отделения неотложной кардиологии;
-как можно более раннее начало мероприятий, направленных на восстановление коронарного кровотока: выполнение первичных ЧКВ в течение 90 мин от момента поступления больного в стационар, располагающий такими возможностями, или введение тромболитических препаратов на догоспитальном этапе либо не позднее 30 мин от момента поступления больного в стационар, не располагающий возможностями выполнения первичных ЧКВ;
-пребывание больного в течение острого периода ИМпST в блоке интенсивной кардиологии;
-систему восстановительного лечения (реабилитация).
• Лечебные мероприятия проводятся с учетом стадии ИМпST, выраженности и характера осложнений.
В начальном периоде ИМпST основные лечебные мероприятия направлены на обезболивание, скорейшее полноценное и стойкое восстановление коронарного кровотока в инфаркт-связанной артерии и лечение осложнений, если они возникают.
395
Купирование болевого синдрома. Обезболивание является одной из важнейших задач начального периода лечения больных с ИМпST. При неэффективности 1-2-кратного приема 0,4 мг нитроглицерина в виде таблеток или спрея, используют внутривенное введение наркотических анальгетиков, среди которых наиболее эффективен 1% раствор морфина (морфина гидрохлорида). Обычно внутривенно струйно (медленно!) вводят 1,0 мл препарата, разведенного в 20,0 мл изотонического раствора натрия хлорида. Вместо морфина могут быть использованы и другие наркотические анальгетики: 1,0 мл 1% раствора тримеперидина (промедола*), 1-2 мл 0,005% раствора фентанила, как в сочетании с транквилизаторами или нейролептиками (2 мл 0,25% раствора дроперидола), так и без них.
Оксигенотерапия через лицевую маску либо носовые катетеры показана больным, имеющим одышку или клинические признаки острой сердечной недостаточности (отек легких, кардиогенный шок).
Восстановление коронарного кровотока и перфузии миокарда. Скорейшее восстановление кровотока в окклюзированной коронарной артерии (реперфузия) служит краеугольной задачей в лечении больных с ИМпST, решение которой влияет как на госпитальную смертность, так и на ближайший и отдаленный прогноз. При этом желательно, чтобы, помимо как можно более быстрого, восстановление коронарного кровотока было полноценным и стойким. Ключевым моментом, влияющим как на эффективность любого реперфузионного вмешательства, так и на его отдаленные результаты, является фактор времени: потеря каждых 30 мин увеличивает риск смерти в стационаре примерно на 1%.
Существует две возможности восстановления коронарного кровотока: тромболитическая терапия, т.е. реперфузия с помощью тромболитических препаратов (стрептокиназа, тканевые активаторы плазминогена), и ЧКВ, т.е. реперфузия с помощью механического разрушения тромботических масс, окклюзирующих коронарную артерию (баллонная ангиопластика и стентирование коронарных артерий).
Попытка восстановления коронарного кровотока с помощью того или другого метода должна быть предпринята у всех больных с ИМпST в первые 12 ч заболевания (при отсутствии противопоказаний). Реперфузионные вмешательства оправданы и после 12 ч от начала заболевания, если имеются клинические и ЭКГ-признаки продолжающейся ишемии миокарда. У стабильных больных, при отсутствии клинических и ЭКГ-признаков продолжающейся ишемии миокарда, проведение ни тромболитической терапии, ни ЧКВ позднее 12 ч от начала заболевания не показано.
В настоящее время методом выбора восстановления коронарного кровотока у больных с ИМпST в первые 12 ч заболевания служит первичное ЧКВ (рис. 2-19).
396
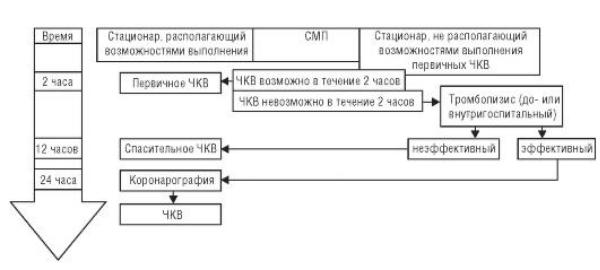
Рис. 2-19. Выбор реперфузионной стратегии лечения больных с инфарктом миокарда с подъемом сегмента ST в первые 12 ч заболевания
Под первичным ЧКВ понимают баллонную ангиопластику со стентированием (либо без него) инфаркт-связанной коронарной артерии, выполненные в первые 12 ч от начала клинической картины ИМпST без предшествующего применения тромболитических либо других препаратов, способных растворять тромбы.
В идеальном случае в первые 12 ч заболевания больной с ИМпST должен быть доставлен в стационар, располагающий возможностями выполнения первичного ЧКВ 24 часа в сутки 7 дней в неделю при условии, что предполагаемые потери времени между первым контактом пациента с врачом и моментом раздувания баллонного катетера в коронарной артерии (т.е. момента восстановления коронарного кровотока) не превысят 2 ч. У больных с обширным ИМпST, диагностированным в первые 2 ч от начала заболевания, потери времени не должны превышать 90 мин.
Однако в реальной жизни далеко не у всех больных с ИМпST возможно выполнение первичного ЧКВ, поскольку, с одной стороны, по различным причинам в первые 12 ч заболевания госпитализируются значительно менее 50% больных, а в первые 6 ч, наиболее благоприятных для лечения, - менее 20% больных с ИМпST. С другой стороны, далеко не все крупные стационары имеют возможность выполнения экстренных ЧКВ 24 часа в сутки 7 дней в неделю.
В связи с этим во всем мире, в том числе и в Российской Федерации, основным способом восстановления коронарного кровотока у больных с ИМпST пока остается тромболитическая терапия. К преимуществам тромболитической терапии относится простота ее проведения, относительно невысокая стоимость, возможность ее проведения как на догоспитальном этапе (существенное, не менее чем на 30 мин (!) сокращение времени до начала реперфузионной терапии), так и в любом стационаре. К ее недостаткам следует отнести недостаточную эффективность (50-80% в зависимости от типа тромболитического препарата и времени, прошедшего от начала заболевания), развитие ранних (5-10% больных) и поздних (30% больных) повторных окклюзий коронарных артерий, возможность тяжелых геморрагических осложнений, включая геморрагический инсульт (у 0,4-0,7% больных).
397
При отсутствии противопоказаний проведение тромболитической терапии должно быть осуществлено в первые 12 ч от начала клинической картины ИМпST у больных, которым первичное ЧКВ по каким-либо причинам не может быть выполнено в указанные выше интервалы времени.
Принципиально важным является положение, что проведение системного тромболизиса целесообразно только в первые 12 ч от начала клинической картины ИМпST.
Вболее поздние сроки проведение системного тромболизиса не показано, поскольку эффективность его крайне низкая, и он не оказывает существенного влияния на показатели госпитальной и отдаленной смертности.
Внастоящее время наиболее широко используемыми тромболитическими препаратами являются стрептокиназа (самый часто используемый в мире препарат) и тканевые активаторы плазминогена, к которым относятся алтеплаза (t-PA), ретеплаза (rt-PA) и тенектеплаза (nt-PA), проурокиназа (пуролаза).
Преимущество имеют тканевые активаторы плазминогена, поскольку они являются фибринспецифичными тромболитическими препаратами.
При наличии обученного персонала рекомендуется начинать тромболитическую терапию на догоспитальном этапе в условиях бригады скорой помощи, что позволяет значительно (минимум на 30-60 мин) сократить потери времени, связанные с проведением реперфузионных вмешательств.
Показания к проведению системного тромболизиса:
•наличие типичной клинической картины острого коронарного синдрома в сочетании с изменениями ЭКГ в виде подъема сегмента ST >1,0 мм в 2 смежных стандартных отведениях от конечностей либо подъема сегмента ST >2,0 мм в двух смежных грудных отведениях и более;
•впервые выявленная полная блокада левой ножки пучка Гиса в сочетании с типичной клинической картиной.
К абсолютным противопоказаниям к проведению системного тромболизиса относятся:
•геморрагический инсульт или инсульт неизвестного характера любой давности в анамнезе;
•ишемический инсульт в течение последних 6 мес;
•наличие сосудистой патологии головного мозга (артериовенозная мальформация);
•наличие злокачественной опухоли головного мозга или метастазов;
•недавняя травма, в том числе черепно-мозговая, полостная операция, в течение последних 3 нед;
•желудочно-кишечное кровотечение в течение последнего 1 мес;
398
•известные заболевания, сопровождающиеся кровоточивостью;
•подозрение на расслоение стенки аорты;
•пункции неподдающихся компрессии органов (пункция печени, люмбальная пункция),
втом числе сосудов (подключичная вена).
К относительным противопоказаниям к проведению системного тромболизиса
относятся:
•транзиторная ишемическая атака в течение последних 6 мес;
•терапия непрямыми антикоагулянтами;
•беременность и 1-я неделя после родов;
•реанимационные мероприятия, сопровождавшиеся травмой грудной клетки;
•неконтролируемая АГ (систолическое АД >180 мм рт.ст.);
•язвенная болезнь желудка и двенадцатиперстной кишки в фазе обострения;
•далеко зашедшие заболевания печени;
•ИЭ.
Стрептокиназу вводят внутривенно капельно в дозе 1,5 Ед, растворенные в 100 мл 0,9% раствора натрия хлорида или 5% глюкозы* в течение 30-60 мин. Предварительно, для снижения вероятности аллергических реакций, целесообразно ввести внутривенно 60-90 мг преднизолона.
Алтеплаза вводится внутривенно в суммарной дозе 100 мг следующим образом: первоначально внутривенно в виде болюса вводят 15 мг препарата, затем в течение следующих 30 мин начинают внутривенное капельное введение алтеплазы из расчета 0,75 мг/кг массы тела, в последующие 60 мин продолжают внутривенное капельное введение препарата из расчета 0,5 мг/кг массы тела.
Тенектеплазу вводят внутривенно в виде однократной болюсной инъекции в дозе, рассчитываемой в зависимости от веса больного: при весе 60-70 кг - вводится 35 мг препарата, при весе 70-80 мг - вводится 40 мг тенектеплазы, при весе 80-90 кг - вводят 45 мг препарата, при весе более 90 кг - 50 мг.
Проурокиназа (пуролаза), отечественный препарат, вводится внутривенно (предварительно препарат растворяют в 100-200 мл дистиллированной* воды или изотоническом растворе хлорида натрия) по схеме «болюс + инфузия». Болюс составляет 2 000 000 МЕ; последующая инфузия 4 000 000 МЕ в течение 30-60 мин.
По сравнению со стрептокиназой (тромболитик 1-го поколения), алтеплазой и ретеплазой (тромболитики 2-го поколения), которые требуют внутривенного капельного введения в течение определенного времени, удобство применения тенектеплазы (тромболитик 3-го поколения) состоит в возможности его болюсного внутривенного
399
введения. Это чрезвычайно удобно при проведении догоспитального тромболизиса в условиях бригады скорой медицинской помощи.
Косвенно эффективность тромболитической терапии оценивают по степени снижения интервала S-T (по сравнению с выраженностью первоначального подъема) через 90 мин после начала введения тромболитического препарата. Если интервал S-T снизился на 50% или более по сравнению с первоначальным уровнем, принято считать, что тромболизис оказался эффективным. Еще одним косвенным подтверждением эффективности тромболитической терапии служит появление так называемых реперфузионных аритмий (частая желудочковая экстрасистолия, пробежки медленной желудочковой тахикардии, крайне редко возникает фибрилляция желудочков). Однако необходимо отметить, что далеко не всегда формально эффективная по косвенным признакам тромболитическая терапия приводит к восстановлению коронарного кровотока (по данным коронароангиографии). Реперфузионная эффективность стрептокиназы составляет около 50%, алтеплазы, ретеплазы*9 и тенектеплазы - 75-85%.
При неэффективности тромболитической терапии может рассматриваться вопрос о переводе больного с ИМпST в стационар, имеющий возможность проведения ЧКВ (для того чтобы в течение 12 ч от начала заболевания ему было выполнено так называемое «спасительное» ЧКВ).
В случае эффективного системного тромболизиса больному в течение ближайших 24 ч, но не ранее 3 ч от начала введения тромболитического препарата, целесообразно проведение коронароангиографии и при показаниях - выполнение ЧКВ.
С целью усиления тромболитического эффекта и предупреждения повторного тромбоза коронарной артерии (при эффективном тромболизисе) используют антитромбоцитарные препараты (ацетилсалициловую кислоту и клопидогрел) и антитромбиновые препараты (НФГ, НМГ, ингибиторы Ха-фактора).
Учитывая чрезвычайно важную роль тромбоцитов в патогенезе ОКСпST, подавление адгезии, активации и агрегации тромбоцитов служит одним из ключевых моментов в лечении этой категории больных. Ацетилсалициловая кислота, блокируя циклооксигеназу-1 тромбоцитов, нарушает синтез в них тромбоксана А2 и, таким образом, необратимо подавляет агрегацию тромбоцитов, индуцированную коллагеном, АДФ и тромбином.
Ацетилсалициловую кислоту (аспирин) в качестве антиагреганта назначают больному как можно раньше заболевания (еще на догоспитальном этапе). Первую нагрузочную дозу 250 мг больного просят разжевать; затем в дозе 100 мг больной принимает аспирин* внутрь (желательно в кишечнорастворимой форме) один раз в сутки неограниченно долго. Назначение аспирина* одновременно с проведением тромболитической терапии сопровождается снижением 35-дневной смертности на 23%.
Тиенопиридины (клопидогрел). Еще более эффективным является добавление к тромболитической терапии комбинации аспирина* и клопидогрела (как с использованием нагрузочной дозы клопидогрела 300-600 мг, так и без нее). Такая двухкомпонентная антитромбоцитарная терапия приводит к достоверному снижению на 30-й день заболевания частоты серьезных сердечнососудистых осложнений на 20%.
Антитромбиновые препараты (антикоагулянты). Целесообразность применения антикоагулянтов (НФГ, НМГ, ингибиторы Ха-фактора) связана с необходимостью
400
