
Журнал неврологии и психиатрии / 2009 / NEV_2009_09_19
.pdf
ЛЕКЦИЯ
Болевые синдромы в неврологической практике
Д.м.н., проф. М.М. ОДИНАК, д.м.н., ст. преп. С.А. ЖИВОЛУПОВ1, нач. отд. И.Н. САМАРЦЕВ
Pain syndroms in neurological practice
M.M. ОDINAK, S.A. ZHIVOLUPOV, I.N. SAMARTSEV
Кафедра нервных болезней Военно-медицинской академии, Санкт-Петербург
Ключевые слова: боль, патофизиология боли, лечение.
Key words: pain, pathophysiology, treatment.
Боль — самый частый симптом, встречающийся в неврологической практике. Несмотря на многовековую историю изучения боли в различных областях медицины, до сих пор существуют разные мнения в определении, классификации и понимании патогенеза болевых синдромов.
Эволюция концепции боли начинается с античных времен, когда боль расценивали как «божью кару» или следствие нарушения внутренней «жизненной энергии». Во времена Гиппократа и Аристотеля сердце считалось центром чувствительности, а боль рассматривалась как форма восприятия окружающего мира [14]. С развитием идей нервизма в медицине и физиологии (1-я половина XVII века) появились концепция [30] специфичности боли, согласно которой болевой сигнал генерируется только определенными рецепторами, и концепция [18], акцентирующая внимание на интенсивность раздражения и предполагающая, что боль может восприниматься любыми рецепторами при достижении силы раздражителя определенного уровня. В настоящее время этим концепциям в определенной мере соответствуют представления об эпикритической боли, являющейся результатом активации специфических рецепторов, и протопатической боли. Их основные особенности приведены в табл. 1.
Современные концепции боли стали формироваться в середине прошлого века. По мнению Л.В. Калюжного [3], боль как интегративная функция организма является отрицательной биологической потребностью, ответственной за формирование функциональной системы сохранения гомеостаза. Наиболее приемлемым для клиницистов является определение боли, предложенное Международной ассоциацией по изучению боли (IASP) в 1994 г.: «Боль
— неприятное сенсорное и эмоциональное переживание, связанное с существующими или возможными повреждениями ткани или описываемое в терминах такого повреждения» [28]. В дальнейшем предлагалось большое количество вариантов определения боли. Мы предлагаем следующее: «боль — мультисистемная реакция организма, про-
текающая в рамках физиологических (защитный рефлекс) или патофизиологических (один из синдромов какоголибо заболевания) процессов и направленная на восстановление гомеостаза или реализацию патологической доминанты».
В настоящее время в литературе [9] преобладает точка зрения о целесообразности деления боли на ноцицептивную и невропатическую. Ноцицептивная боль вызвана активацией ноцицепторов при тканевом повреждении, соответствует степени тканевой деструкции и длительности заживления. Невропатическая боль (НБ) — боль, вызванная повреждением периферической или центральной нервных систем (или обеих), сопровождающаяся нарушениями чувствительности. К НБ относятся все болевые синдромы, развивающиеся при заболеваниях и травмах нервной системы [13]. Классическими примерами такой боли являются: боль после травмы периферического нерва, боль при полиневропатии, фантомная боль, невралгия тройничного нерва и др.
Изложенный подход к систематизации болевых синдромов носит несколько условный характер, поскольку боль как неврологический синдром подлежит топическому анализу, а разделение болевых синдромов на ноцицептивные и невропатические «уводит» клинициста от необходимости топической диагностики заболевания. Поэтому совершенной классификации болевых синдромов в неврологии до сих пор не существует.
Нам представляется оправданным использование в клинической практике топического подхода к систематизации болевых синдромов, учитывающего не только локализацию боли, но и предполагаемый уровень поражения нервной системы. Международная ассоциация по изучению боли приводит [28] следующее распределение 530 болевых синдромов по их локализации: генерализованные болевые синдромы — 36; боли в области шеи и головы — 66; боли в руках — 35; боли в области грудного и шейного отделов позвоночника — 154; боли в поясничной, сакральной и копчиковой области — 136; боли в туловище
© Коллектив авторов, 2009 |
1e-mail: peroslava@yandex.ru |
Zh Nevrol Psikhiatr Im SS Korsakova 2009;109:9:80
80 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2009 |

|
|
БОЛЕВЫЕ СИНДРОМЫ |
||
Таблица 1. Основные различия эпикритической и протопатической сигнальных систем |
||||
|
|
|
||
Характеристика |
|
Система |
|
|
эпикритическая |
протопатическая |
|||
|
||||
Функции |
Констатация, идентификация |
Передача сигнала, свидетельствующего об отсутствии |
|
|
|
и локализация повреждающего |
патологических изменений в тканях, а также воспри- |
||
|
воздействия, реализация безусловятие повреждения и воспалительных изменений в |
|||
|
ных защитных рефлексов |
тканях. Эмоциональное восприятие боли. Формиро- |
||
|
|
вание противоболевой мотивации. Реализация услов- |
||
|
|
ных защитных рефлексов |
||
Тип рецепции |
Механо- и терморецепция |
Хемо-, механо- и терморецепция |
||
Тип сегментарных волокон |
Aδ-волокна |
С-волокна |
||
Медиаторы болевой передачи |
Глутамат, аспартат |
Субстанция Р |
||
Супрасегментарные проводники |
Спиноталамический тракт |
Спиноретикулярный тракт, спиномезэнцефальный |
||
|
|
тракт |
||
Супрасегментарные центры |
Задняя центральная извилина |
Лимбикоретикулярная формация, премоторная зона |
||
|
|
коры |
|
|
Таблица 2. Cвязь клинических симптомов и предполагаемых механизмов их возникновения у пациентов с невропатическими болями
Клинические симптомы |
Патофизиологические механизмы |
Длительная жгучая боль |
Нарушение центрального тормозного контроля, центральная сенситиза- |
|
ция, эктопические разряды |
Стреляющая, пронзающая боль |
Эктопические разряды |
Парестезия |
Эктопические разряды, центральная сенситизация |
Гипералгезия |
Центральная сенситизация, вызванная усилением ноцицептивной аффе- |
|
рентации |
Аллодиния |
Нарушения центрального торможения, центральная сенситизация, сен- |
|
ситизация ноцицепторов |
Рис. 1. Клинические проявления невропатической боли.
— 85; боли в ногах — 18. К сказанному можно добавить, что анализ 12 000 больных, лечившихся в Клинике нервных болезней Военно-медицинской академии с 1985 по 2008 г., показал, что в структуре болевых синдромов преобладают дорсопатии (77%); на 2-м месте по частоте были дисметаболические полиневропатии (алкогольные, диабетические и др.) — 10%; на 3-м — моно- и мультиневропатии, вызванные инфекционными заболеваниями (постгерпетическая невропатия и др.) и травмами периферической нервной системы — 8%; на 4-м — боли, обусловленные заболеваниями ЦНС (последствия острых нарушений мозгового кровообращения, сирингомиелия и др.) и травмами головного и спинного мозга — 5%.
Клинические проявления болевых синдромов, несмотря на разную этиологию и локализацию, во многом
сходны, характеризуясь продолжительной спонтанной (стимулонезависимой) болью, которая локализуется в области измененной тактильной, температурной и болевой чувствительности, и стимулозависимыми болезненными проявлениями — гиперпатией, гипералгезией (первичная
— в зоне повреждения, вторичная — в рядом лежащих неповрежденных тканях), аллодинией, а также трофическими расстройствами. Стимулонезависимая боль может быть постоянной или пароксизмальной. Клинические особенности НБ представлены на схеме 1 (рис. 1). Характер болевых ощущений в каждом конкретном случае может различаться и включать стреляющую, сдавливающую, сжимающую или жгучую боль. Эпизодическая пароксизмальная боль длится несколько секунд и часто похожа на «удар током» или «электрический разряд». Типичными примерами пароксизмальной боли являются боли у пациентов с невралгией тройничного нерва. Другой тип боли (стимулозависимая) вызывается движением, прикосновением, теплом или холодом. Боли могут возникать на тактильное или холодовое раздражение и ощущаться в парадоксальной форме, например, «обжигающий лед» при комплексном регионарном болевом синдроме [5].
Идентификация патофизиологических механизмов боли в каждом конкретном случае крайне затруднительна. Поэтому во врачебной практике с целью разработки тактики патогенетической терапии для дифференциации болевых синдромов целесообразно использовать клинико-функциональные критерии — локализация, характер, продолжительность, сопутствующие симптомы (табл. 2).
В соответствии с этими критериями периферические болевые синдромы условно разделяются на дизестезиче-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2009 |
81 |

ЛЕКЦИЯ
ские и трункальные. Дизестезическая (деафферентационная, поверхностная) боль характеризуется пациентами как жгучая, саднящая, сопровождающаяся зудом, ползанием мурашек и прохождением электрического тока. Дизестезические боли возникают при вовлечении в патологический процесс тонких С-волокон. Трункальная (глубокая) боль характеризуется как ноющая, режущая, ломящая. Возникает, как правило, при невропатиях (радикулопатиях) и связана с дисфункцией Аδ-волокон. Рассматриваемые типы НБ редко встречаются в чистом виде. Чаще они сопровождаются невротическими (в том числе эмоциональными) реакциями [1, 10]. По существу это защитные реакции, которые подготавливают человека или животное к тому, чтобы обороняться или спасаться бегством. Боль весьма определенно сигнализирует о необходимости что-то предпринять для прекращения контакта с потенциально опасным (вредоносным) объектом и она запускает компенсаторные реакции, если повреждение какой-либо части тела уже произошло. Редкие люди нечувствительны к боли. Если такое явление существует, то оно, как правило, является проявлением заболевания (например, сирингомиелия), приводящего не только к серьезным травмам, но и к гибели.
Сенсорные сигналы, поступление которых в нервную систему вызывает болевые ощущения, называют ноцицептивными. Известно, что все соматические рецепторы разделяются на низкопороговые и высокопороговые [17]. Низкопороговые рецепторы возбуждаются неповреждающими раздражителями (прикосновение, вибрация, умеренное давление и т. д.) и передают импульсацию по Аα- и В-волокнам. Высокопороговые рецепторы возбуждаются при воздействии сильных (повреждающих) раздражителей (уколы, разрезы, действие химических веществ и т.д.). Эти рецепторы получили название болевых рецепторов, или ноцицепторов. Различают два типа ноцицепторов: механоноцицепторы и хемоноцицепторы [6].
Ноцицепторы представляют собой сеть свободных окончаний, пронизывающих ткани. Рецепторы боли у человека находятся в коже, в оболочках мышц, во внутренних органах, надкостнице, роговице глаза. Болевые импульсы, возникающие в ноцицепторах, поступают в центральные образования нервной системы по тонким миелинизированным волокнам (Аδ), проводящим «быструю» боль, или по немиелинизированным С-волокнам, проводящим «медленную» боль [6, 22].
Первичный анализ болевой импульсации происходит в спинном мозге. В первую очередь возникает разделение ноцицептивных волокон на два пучка: медиальный, входящий в состав задних восходящих столбов спинного мозга, и латеральный, переключающийся на нейроны заднего рога спинного мозга. Латеральный пучок представлен Аδ- и С-волокнами [3, 15]. Причем Аδ-волокна заканчиваются в первых двух слоях (пластинах) серого вещества спинного мозга, тогда как С-волокна — в студенистом веществе [23], прилегающем наподобие полулуния к дорсальному концу заднего рога. В студенистом веществе осуществляется передача раздражений на соседние сегменты спинного мозга.
Клетки 1-го слоя серого вещества, по классификации B. Rexed [29], находящиеся в маргинальной зоне, активируются как ноцицептивными, так и неноцицептивными стимулами и обеспечивают проведение болевой импульсации к супраспинальным структурам, образуя наряду с
другими интернейронами спиноталамический тракт [4, 7, 16].
Клетки 2-го и 3-го слоев возбуждаются при воздействии механических и термальных стимулов от Аδ- и С-волокон и содержат значительное количество Т-клеток (трансмиссионных), образующих обратную связь с терминалями первичных афферентов и дендритами пирамидных клеток [4, 29].
На нейроны 4-го слоя конвергируют импульсы от всех типов кожных афферентов, возникающие при механических, термальных и химических раздражениях кожи, но они индифферентны к мышечным и висцеральным стимулам. Импульсация, идущая по афферентам С-волокон, вызывает интенсивное и длительное возбуждение нейронов этого слоя. Аксоны клеток 4-й пластины образуют часть спиноталамических трактов [4, 12, 29].
Нейроны 5-го и 6-го слоев считаются источниками основной массы проприоспинальных (сегментарных) связей и некоторых восходящих трактов и играют определенную роль в формировании соматовисцерального болевого потока. В медиальной части 5-го слоя расположены крупные нейроны Кларка, аксоны которых образуют восходящие спинномозжечковые тракты [4, 12, 29].
Нейроны 7-го и 8-го слоев занимают промежуточное положение между передними и задними рогами спинного мозга. Не имея прямых контактов с первичными афферентами, нейроны данных пластин получают импульсацию от дорсальных нейронов, имеют широкие рецептивные поля и активируются ноцицептивной импульсацией. Аксоны интернейронов этих пластин оканчиваются на мотонейронах передних рогов, а также входят в восходящие и нисходящие тракты. Поэтому простейший ответ на болезненный стимул происходит рефлекторно (отдергивание руки или ноги). Другие ветви сенсорных нервных волокон через синапсы с интернейронами передают информацию по восходящим путям в мозг [4, 12, 29].
Таким образом, нейроны спинного мозга представляют собой «модуль первичного рефлекторного анализа» ноцицептивной импульсации, где, с одной стороны, возникают двигательная, висцеральная и вазомоторная реакции на боль, а с другой — формируются восходящие пути болевой импульсации. Этот модуль имеет определенные особенности строения, связанные с тем, что моносинаптические контакты с первичными афферентами имеют нейроны только 1—3-й пластин, тогда как нейроны последующих слоев получают импульсацию уже после данного переключения. Часть нейронов активируется только сенсорными стимулами, другая часть — сенсорными и ноцицептивными, третья — преимущественно ноцицептивными, причем последние проецируются в спиноталамический путь, а остальные нейроны — в спиноталамический и спиноцервикальный пути. Ноцицептивные нейроны подразделяются на специфические, реагирующие только на ноцицептивные раздражители, и, так называемые, широко динамичные нейроны, составляющие треть всех нейронов, реагирующие также на низкопороговые механические стимулы, но максимально — на ноцицептивные раздражители [4, 13, 16].
Далее ноцицептивная импульсация поднимается в головной мозг по разным системам. Одна из них является боковым спиноталамическим трактом, состоящим из миелинизированных быстропроводящих толстых волокон («быстрый путь»), активация которых дает ощущение
82 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2009 |

БОЛЕВЫЕ СИНДРОМЫ
острой боли. Волокна «быстрого» пути имеют относительно небольшое число коллатералей, и приблизительно 30% из них заканчиваются моносинаптически в таламусе. Эта система позволяет точно различать, где и в какой момент времени произошло повреждение, насколько оно опасно для организма [5]. Другая система формирует «медленный» путь и называется мультисинаптической восходящей или спиноретикулодиэнцефальной. Она состоит из безмиелиновых медленно проводящих волокон, при возбуждении которых возникает разлитая ноющая боль. Эта система отличается диффузностью, большим количеством синапсов и коллатералей к различным образованиям спинного мозга и ствола головного мозга. Волокна «медленного» пути идут к ретикулярной формации, к клеткам и центрам продолговатого и среднего мозга, моста, серому веществу около сильвиева водопровода, гипоталамусу и таламусу [4, 14, 22]. Одни волокна образуют синапсы на нейронах, связанных с гипоталамусом и миндалиной в лимбической системе, другие — на клетках диффузных нервных сетей, соединенных с многочисленными образованиями головного мозга. Наличие большого числа синапсов, отсутствие миелиновой оболочки и малая толщина волокон замедляют прохождение импульсов по этому пути.
Обе вышеуказанные системы имеют различные зоны назначения в таламусе — конечной станции переключения болевой импульсации. «Быстрый» путь заканчивается в релейных нейронах вентробазального комплекса, а «медленный» — в интраламинарном и медиальном ядрах. Волокна вентробазального комплекса оканчиваются в постцентральной извилине, островковой коре (теменная доля) и височной доле. В постцентральной извилине происходит определение локализации боли, оценка ее типа и вероятной причины. Данное болевое ощущение имеет незначительный эмоциональный компонент и названа «первичной болью» острого повреждения, которая предшествует тревожно ожидаемой «вторичной боли», имеющей значительную эмоциональную окраску. Такое распознавание особенно применимо для нижних и верхних конечностей, где расстояние позволяет значительно разграничить «быстрый» и «медленный» ноцицептивные пути [2, 4, 15].
В островковой коре устанавливается локализация, тип и вероятная причина боли. Теменная доля обеспечивает мнемонический анализ для определения, является ли данная боль новой или повторением предыдущего болевого опыта в подобных обстоятельствах.
Кроме гипоталамуса в данную систему входят гиппокамп, миндалевидный комплекс, лимбическая кора, передняя группа ядер таламуса, дорсомедиальное таламическое ядро, а также прозрачная перегородка [13, 17].
При функционировании корковых ассоциативных связей осуществляется участие лимбической системы в актах эмоциональной оценки внешних стимулов. Ноцицептивное возбуждение лимбической системы формирует сознательно переживаемую боль и вызывает висцеральные реакции (тошноту, рвоту, непроизвольное испражнение или мочеиспускание и др.). Лобные доли, особенно префронтальная кора, генерируют предупреждающую тревогу и страх в отношении возможного повторения боли [5].
Таким образом, «быстрая» система, свободная от эмоций, может выполнять функцию предупреждения, до-
ставляя информацию о повреждении, его размерах и месте. Неприятная ноющая боль, характерная для «медленной» системы, как бы напоминая мозгу о происшедшем повреждении, на которое следует обратить внимание, позволяет приписать болевым ощущениям те или иные эмоциональные качества, поскольку наше восприятие боли включает как самоощущение ее, так и эмоциональную реакцию на этот феномен [9]. Больные, перенесшие фронтальную лоботомию, редко жалуются на сильную боль. Обе ноцицептивные системы функционируют как единое целое, выполняя аналитическое и интегрирующее действие.
При повреждении периферических и центральных образований нервной системы происходит активация «молчащих» ноцицепторов; ускорение синтеза мембранных каналов в ноцицептивных нейронах ганглиев заднего корешка; увеличение количества внутримембранных Nа+- каналов на протяжении поврежденного нервного волокна, что способствует формированию эктопической нейрональной активности; развитие центральной сенситизации вследствие усиления афферентной периферической импульсации; спрутинг центральных терминалей ноцицепторов в дорсальных рогах спинного мозга и реорганизация работы ноцицептивных нейронов дорсальных рогов; спрутинг симпатических эфферентов, которые формируют синаптическую сеть вокруг тел нейронов, увеличивая свое влияния на ноцицепторы, тем самым вызывая усиление болевого импульса; спрутинг центральных терминалей неноцицептивных нейронов (Аβ-аксоны), локализованных в ганглиях заднего корешка; изменение обработки ноцицептивных сигналов в центральных структурах мозга с вовлечением в этот процесс структур, ранее не участвовавших в ноцицепции.
Чувствительность к боли (болевой порог и уровень толерантности к боли) варьирует в широких пределах. Она зависит от физиологического состояния организма, прошлого опыта, культурных традиций, от значения, которое человек придает воздействию, вызывающему боль, и от психологических факторов (тревожность, внушаемость и т.д.). Так, этнические группы, проживающие в северных регионах, легче переносят боль по сравнению с южанами [26]. Кроме того, известны факты, когда солдатам, раненным в бою, значительно реже требовался морфин, чем гражданским лицам в послеоперационном периоде [8]. Основная причина этого видится в том, что раненый солдат испытывал облегчение, благодарность судьбе и даже эйфорию от того, что ему удалось уйти живым с поля боя. Внушение может изменить восприятие боли. Если испытуемым давать в качестве обезболивающего средства плацебо, у некоторых людей боль действительно уменьшится. Зачастую значительное повышение толерантности к боли может происходить под влиянием гипноза [15].
В основе вышеуказанных феноменов лежат механизмы регуляции болевой чувствительности, описываемой теорией «воротного контроля» [24, 25]. Смысл ее заключается в том, что на уровне нейронов заднего рога спинного мозга импульсация, идущая по первичным афферентам, может тормозиться или амплифицироваться на основе механизма пресинаптического торможения или облегчения [21]. Нейроны студенистого вещества спинного мозга (2-й и 3-й слои по B. Rexed [29]) посылают аксоны к пресинаптическим афферентным терминалям, образуя аксо-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2009 |
83 |

ЛЕКЦИЯ
аксональные синапсы. При возбуждении клеток студенистого вещества импульсацией от толстых сенсорных волокон через аксо-аксональные синапсы происходит деполяризация ноцицептивных терминалей с угнетением выделения трансмиттера в синаптическую щель, что и определяет механизм пресинаптического торможения. Активация тонких ноцицептивных волокон вызывает торможение нейронов студенистого вещества с последующим пресинаптическим облегчением (увеличение выделения трансмиттера и облегчение транссинаптической передачи). Кроме этого, теория «воротного контроля» постулирует наличие центральной модуляции данного феномена через изменения функционального состояния нейронов студенистого вещества, осуществляемые супраспинальными структурами (центральное серое околоводопроводное вещество, ядра шва, хвостатое и красное ядра, парагигантоклеточное ядро ретикулярной формации, паравентрикулярные и передние отделы гипоталамуса, некоторые ядра таламуса и кора больших полушарий) через волокна кортикоспинального тракта [22].
В 1999 г. R. Melzack [27] предложил нейроматриксную теорию боли, согласно которой болевое ощущение формируется паттерном нервных импульсов в нейрональных цепях ЦНС (преимущественно в лимбической системе). Нейроматрикс представляет собой обширную сеть нейронов, образующих функциональные петли между таламусом и корой, корой и лимбической системой. Синаптические связи в этой нейронной сети генетически детерминированы и, в некотором смысле, составляют материнскую «матрицу», генерирующую, воспроизводящую и модулирующую сенсорную информацию. Нейронные петли дивергируют, т.е. расходятся в пространстве и формируют 3 основных компонента нейроматрикса — «нейромодули», в которых ведется одновременная параллельная обработка афферентных импульсов. Нейромодули соответствуют 3 главным психологическим компонентам болевого ощущения: сенсорно-дискриминативному, аффектив- но-мотивационному и оценочно-познавательному. Обработка данных в нейромодулях завершается конвергенцией информации, взаимодействием между ними и формированием конечного результата — нейросигнатуры. Нейросигнатура представляет собой непрерывный, исходящий из нейроматрикса поток импульсов, направляющихся в следующий компонент системы — «сенсорный невральный центр», в котором происходит оценка этого потока сигналов, его осознание, осмысление и накопление опыта [6].
Нами с 2000 г. разрабатывается концепция, названная концепцией «песочных часов». Суть ее заключается в представлении о динамическом нейрохимическом взаимодействии двух противоположных по предназначению систем — ноцицептивной и антиноцицептивной, которые имеют единый тип устройства (сегментарные и надсегментарные образования нервной системы) и формируют одновременно при действии на организм повреждающего фактора. Большое количество структур, участвующих в работе антиноцицептивной системы, с различными механизмами их активации, а также различные состояния организма, при которых возникают изменения болевой чувствительности (эмоции, гипноз, мотивации, акупунктура и т. д.), указывают на то, что антиноцицептивная система является гетерогенным образованием и имеет несколько механизмов контроля и регуляции болевой чувствительности [12].
В регуляции боли значительное место принадлежит опиоидным пептидам — эндорфинам и энкефалинам. В настоящее время установлено, что первые вырабатываются в гипоталамусе и гипофизе, а вторые — в гипоталамусе. Эндорфиновые терминали практически не контактируют с переключательными станциями болевой импульсации, за исключением таламических переключательных ядер, и зоной центрального серого околоводопроводного вещества, а имеют тесные контакты с паравентрикулярными ядрами гипоталамуса, преоптической областью и срединным возвышением, которые, в свою очередь, тесно связаны с гипофизом [7]. Активация β-эндорфиновых механизмов гипоталамуса ведет к усилению выделения гормонов и β-эндорфина в гипофизе, что позволяет ему тем самым контактировать с опиоидными рецепторами, расположенными на всех уровнях ноцицептивной системы [13]. Поскольку энкефалинсодержащие клетки расположены практически на всех переключательных станциях ноцицептивной системы (нейронах заднего рога спинного мозга, гигантоклеточного ядра, ретикулярной формации среднего мозга и центрального серого околоводопроводного вещества, ядрах гипоталамуса, таламуса и фронтальной коры), механизмы воздействия энкефалинов на ноцицептивную систему связаны с их прямым влиянием на опиоидные рецепторы и осуществляются в зависимости от их локализации [15, 19].
Эндогенные опиоиды, а также морфин и морфиноподобные вещества при системном введении угнетают действие алгогенных веществ уже на уровне периферических ноцицепторов [10]. Увеличение их концентрации
вобласти переключательных станций ноцицептивной импульсации, в частности, в области заднего рога спинного мозга, вызывает снижение активности С-волокон, угнетает спонтанную и вызванную активность нейронов
вответ на ноцицептивную импульсацию, формируя состояние аналгезии. Эндорфины и морфин оказывают преимущественно пресинаптическое, а энкефалины как пре-, так и постсинаптическое действие на нейроны заднего рога спинного мозга. Угнетающее действие опиоидов и морфина прослеживается и на всех других уровнях переключения ноцицептивной импульсации: гигантоклеточного ядра, ретикулярной формации, таламуса, коры больших полушарий. Энкефалины оказывают общее угнетающее действие на активность нейронов ЦНС, снижая их реакции на любую, в том числе сенсорную и ноцицептивную импульсации. Эндорфины и морфиноподобные субстанции селективно угнетают только ноцицептивные синаптические входы, но при этом они активируют большинство нейронов антиноцицептивных структур, в том числе часть энкефалиновых нейронов этих образований [13].
Кроме опиоидов антиноцицептивным эффектом обладают нейротензин, окситоцин, ангиотензин, серотонин. Нейротензин локализуется в синапсосоматической фракции нервных клеток, преимущественно в студенистом веществе, вентральной покрышке мозга и парабрахиальных ядрах. Он, как окситоцин и ангиотензин, оказывает угнетающее влияние на нейроны заднего рога. Большинство нейронов ядер шва является серотонинергическими, поэтому при их активации происходит выделение серотонина в терминалях волокон нисходящего пути, что приводит к повышению порога ноцицепции. Доказана независимость опиоидного и серотонинергическо-
84 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2009 |

БОЛЕВЫЕ СИНДРОМЫ
го механизмов регуляции болевой чувствительности [6, 14].
Кроме указанных, имеется адренергический механизм антиноцицепции, связанный с активацией отрицательных эмоциогенных зон мозга, имеющий приспособительное значение, так как позволяет организму в стрессовых ситуациях пренебрегать воздействием ноцицептивных раздражителей и, тем самым, бороться за сохранение жизни: при эмоциях страха — спасаться бегством, при эмоциях гнева — агрессией [17].
Эндогенные механизмы, регулирующие болевую импульсацию, гетерогенны, связаны с различными образованиями ЦНС и опосредуются различными нейрохимическими механизмами. Почти все эти механизмы участвуют в активации или угнетении ноцицептивной импульсации уже на уровне ее первой переключательной станции
— нейронов заднего рога спинного мозга, на которых конвергирует множество активирующих и тормозных, восходящих и нисходящих влияний. Так, выделение вещества Р, брадикинина, гистамина, соматостатина усиливает ноцицептивную импульсацию, а эндорфины, энкефалины, катехоламины, серотонин, окситоцин, нейротензин, ангиотензин ее угнетают [1, 17].
Суточные колебания содержания опиоидных пептидов в спинномозговой жидкости характерны для эндорфинов и лейцин-энкефалина. Энкефалиновая система, преимущественно ее метионин-энкефалитический компонент, не подверженный суточным (функциональным) колебаниям активности, обеспечивает постоянство порога боли [15]. Искусственное длительное увеличение количества опиоидных пептидов, например, при экзогенном введении морфиноподобных веществ, вызывает состояние толерантности, обусловленное включением механизмов, контролирующих этот уровень и уменьшающих выработку эндогенных опиоидных пептидов, что приводит к развитию абстинентного синдрома [4]. Тормозное влияние на болевую чувствительность оказывает и серотонинергический антиноцицептивный механизм. Выключение его приводит к гипералгезии вплоть до появления спонтанных болевых ощущений [13]. Изменение порога болевой чувствительности также связано с выделением простагландинов, кининов, соматостатина и вещества Р [5].
Совокупность влияний антиноцицептивных механизмов не является простым суммированием отдельных эффектов, а сложной их интеграцией, как синергичной, так и антагонистичной, на различных уровнях ЦНС. Интенсивность тонического тормозного влияния антиноцицептивной системы на порог боли определяется интегративным взаимодействием опиоидного, серотонинергического и адренергического механизмов, что обусловлено функциональным состоянием различных физиологических систем организма.
Разработано несколько методов количественной оценки хронической боли.
Так, существует краткий опросник боли — BPI (Brief Pain Inventory) для определения тяжести боли и ее влияния на различные аспекты жизни (общая активность, ходьба, нормальная работа, отношения с другими людьми, настроение, сон и наслаждение жизнью). Оценка каждого из перечисленных компонентов проводится в диапазоне от 0 до 10 баллов. Опросник боли МакГилла — MPQ (McGill Pain Questionnaire) и его краткая форма
определяют сенсорные, аффективно-эмоциональные и другие аспекты болевого состояния пациента в диапазоне от 0 до 3 баллов; имеется также опросник с 5-балльной шкалой. Определяют интенсивность боли и по визуальной аналоговой шкале (ВАШ). Для оценки НБ существуют специализированные шкалы: Лидская шкала оценки нейропатических симптомов и знаков и нейропатической боли — LANSS (Leeds Assessment of Neuropathic Symptoms and Sign), шкала оценки качества боли — PQAS (Pain Quality Assessment Scale). Кроме того, существуют рекомендации IMMPACT, разработанные для улучшения методологического уровня клинических исследований боли [11].
Насколько просто выявление болевого синдрома по жалобам больного, настолько затруднительна диагностика сопровождающегося болью основного заболевания. На рис. 2 и табл. 3 представлены основные направления диагностического поиска при дорсалгиях в аспекте их возможного возникновения при разных заболеваниях.
Купирование боли практически всегда представляет значительные трудности как для пострадавшего, так и для медицинского персонала, поскольку интенсивность болевого синдрома зависит от большого числа взаимосвязанных факторов. Лечение должно быть максимально индивидуализированным, комплексным, патогенетическим, этапным и преемственным. Лечение боли необходимо рассматривать в аспекте неотложной помощи и проведения профилактики.
К обезболивающим средствам относятся наркотические анальгетики и «малые» анальгетики — нестероидные противовоспалительные средства (НПВС).
Наркотические анальгетики оказывают выраженное угнетающее действие на ЦНС.
По взаимодействию с опиоидными рецепторами наркотические анальгетики разделяют на агонисты и частичные агонисты. Типичным представителем данной группы является морфин, который, как известно, обладает седативным и снотворным эффектом, вызывает эйфорию и дисфорию, угнетает дыхание и кашлевой рефлекс, повышает тонус гладкой мускулатуры бронхов, желудочнокишечного тракта и мочевого пузыря [15]. Аналгезирующий эффект дает омнопон (пантопон), представляющий смесь алкалоидов опия. Некоторые наркотические аналь-
Рис. 2. Алгоритм диагностического поиска при дорсалгиях.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2009 |
85 |

ЛЕКЦИЯ
Таблица 3. Дифференциальная диагностика болей в спине
Заболевания |
Особенности |
|
|
Неспецифическая боль, вызванная механическими причинами: заболевания и повреждения костносуставного и мышечно-связочного аппаратов
Ишиалгия (чаще грыжа диска L4—L5 и L5—S1)
Перелом позвоночника (компрессионный перелом)
Спондилолистез (смещение тела вышележащего позвонка, чаще на уровне L5—S1)
Злокачественные заболевания (миеломная болезнь), метастазы
Заболевания соединительной ткани
Инфекции (дисцит, туберкулезный спондилит и остеомиелит позвонков, эпидуральный абсцесс)
Аневризма брюшного отдела аорты
Синдром «конского хвоста» (опухоль, срединная грыжа диска, кровоизлияние, абсцесс)
Гиперпаратиреоз
Анкилозирующий спондилит
Нефролитиаз
Боль локализуется в люмбосакральной области, нет корешковых симптомов
Корешковые симптомы со стороны нижних конечностей, положительный тест с поднятием выпрямленной ноги (прием Ласега)
Предшествующая травма, остеопороз
Физическая нагрузка и занятия спортом — частые провоцирующие факторы; боль усиливается при разгибании спины; рентгенография в косой проекции выявляет дефект межсуставной части дужек позвонка
Необъяснимая потеря массы тела, лихорадка, изменения при электрофорезе белков сыворотки, злокачественные заболевания в анамнезе
Лихорадка, увеличение СОЭ, антинуклеарные антитела, склеродерма, ревматоидный артрит
Лихорадка, введение препаратов парентерально, туберкулез в анамнезе или положительная туберкулиновая проба
Больной мечется, боли не уменьшаются в покое, пульсирующая масса в животе
Задержка мочи, недержание мочи или кала, седловидная анестезия, выраженная и прогрессирующая слабость нижних конечностей
Постепенное начало, гиперкальциемия, камни в почках, запоры
В большинстве случаев мужчины 3-го десятилетия жизни, утренняя скованность, положительный HLA-B27 антиген, увеличение СОЭ
Коликообразные боли в боковых отделах с иррадиацией в пах, гематурия, невозможность найти удобное положение тела
гетики морфинного ряда (кодеин и др.) достаточно эф- |
НПВС представляют собой обширную и разнообраз- |
фективны при приеме внутрь. К наркотическим агони- |
ную по химическому строению группу лекарственных |
стам относятся также: промедол (тримеперидин), фента- |
препаратов, широко применяющихся в неврологической |
нил (сентонил) и препараты группы метадона. Промедол |
практике для купирования болевых синдромов. В дей- |
в 2—4 раза слабее, чем морфин, по аналгезирующему дей- |
ствии НПВС выделяют следующие основные механизмы: |
ствию, но вызывает существенно меньше побочных явле- |
предупреждение повреждения клеточных структур, умень- |
ний, действует 3—4 ч. Фентанил намного эффективнее |
шение проницаемости капилляров, ограничивающее экс- |
морфина, но его аналгезирующее действие продолжается |
судативные проявления, ингибирующее влияние на син- |
20—30 мин. Одно из главных осложнений при примене- |
тез или инактивация медиаторов воспаления (гистамин, |
нии наркотических анальгетиков — развитие толерантно- |
серотонин, брадикинин, лимфокины, простагландины) и |
сти и зависимости. |
др. |
Частичные наркотические агонисты (средства со сме- |
В комбинированной терапии болевых синдромов ис- |
шанными свойствами агонистов и антагонистов опиоид- |
пользуют также некоторые психотропные средства, в |
ных рецепторов) разделяют на морфиноподобные и на- |
частности антидепрессанты. Последние оказывают анал- |
лорфиноподобные. Морфиноподобные (пропирам, про- |
гетический эффект по 3 основным механизмам: купиро- |
фадол, бупренорфин) при парентеральном введении дей- |
вание тревоги и страха, уменьшение психовегетативных |
ствуют в 20—30 раз сильнее, а при приеме внутрь — в |
компонентов болевого синдрома; потенцирование дей- |
10 раз сильнее морфия, толерантность и привыкание к |
ствия анальгетиков или эндогенных опиоидных пептидов; |
ним очень низкие. Болеутоляющее действие налорфино- |
пролонгация синаптической активности норадреналина и |
подобных агонистов (пентазоцина, нальбуфина, буторфа- |
серотонина. Для лечения болевых синдромов применяют- |
нола) продолжительнее, чем у агонистов, побочные дей- |
ся антидепрессанты различных групп: неселективные (три- |
ствия выражены меньше, реже развиваются толерантность |
и четырехциклические) и селективные (ингибиторы об- |
и физическая зависимость [12]. |
ратного захвата серотонина и норадреналина). Они спо- |
86 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2009 |

БОЛЕВЫЕ СИНДРОМЫ
Рис. 3. Алгоритм лечения болей в спине.
собны подавлять жгучую постоянную боль. Известен также аналгетический эффект некоторых антиконвульсантов (карбамазепин). Он связан преимущественно с блокадой потенциалзависимых натриевых каналов, обусловливающей торможение эктопических разрядов, возникающих в поврежденном нерве, и снижением возбудимости центральных нейронов. Эффективность карбамазепина доказана у пациентов с тригеминальной невралгией, диабетической невропатией, фантомно-болевым синдромом [15]. К этой группе относится и ламотриджин, который также, ингибируя потенциалзависимые натриевые каналы, блокирует выделение возбуждающих аминокислот из центральных терминалей ноцицепторов и тем самым снижает сенситизацию ноцицептивных нейронов. Его терапевтическая эффективность показана у пациентов с невралгией тройничного нерва, диабетической невропатией, центральными болевыми синдромами [14]. Используют препараты вальпроевой кислоты – в основном для лечения невропатических болевых синдромов и профилактики возникновения приступов мигрени.
Из антиконвульсантов, усиливающих ГАМКергическое торможение, применяется габапентин. Его положительное терапевтическое действие было установлено у пациентов с посттравматической невропатией, центральным болевым синдромом, диабетической невропатией и постгерпетической невралгией [12].
Препараты, усиливающие ГАМКергическое торможение и подавляющие активность NMDA-рецепторов (кетамин), эффективны при устранении аллодинии [16, 22].
Чаще других из производных бензодиазепинов применяют клоназепам, поскольку он усиливает сродство ГАМК к соответствующим рецепторам, вызывая таким образом торможение сенситизированных нейронов. Установлена его эффективность при невропатических и центральных болевых синдромах [16].
Перспективным представляется поиск новых препаратов, обладающих многоуровневым воздействием, а также способных оказывать нейромодулирующий и нейропротекторный эффект. Наиболее адекватным для этих целей является антихолинэстеразный препарат нейромидин (ипидакрин).
Ипидакрин (NIK247, 9-амино-2,3,5,6,7,8-гексагидро- 1Н-циклопента [b] хинолина гидрохлорид моногидрат) был синтезирован в 1988 г. и разрешен к применению как стимулятор нервно-мышечной передачи для лечения заболеваний периферической нервной системы. Препарат обладает двойным механизмом действия: способностью блокировать ионную (калиевую и натриевую) проницаемость мембраны, а также вызывать обратимое ингибирование холинэстеразы [12]. Выявлено также влияние ипидакрина на ГАМКергическую и катехоламиновую системы, что предполагает его центральное нейропротективное и нейромодулирующее действие [13]. Аналгетический эффект нейромидина, блокирующего ионные каналы, достигается торможением эктопических разрядов и эфаптической передачи возбуждения в поврежденном нерве и в регенерирующих аксональных ветвлениях, а также снижением возбудимости центральных нейронов [5].
Исследование эффективности нейромидина при лечении травматических невропатий и плексопатий выявило его отчетливое аналгетическое действие, особенно в отношении таких болевых феноменов, как парестезия, «стреляющая боль» и аллодиния [4]. Важным, хотя и не столь выраженным, был умеренный седативный эффект нейромидина, реализуемый, по всей видимости, за счет модуляции функционирования натриевых каналов.
Существуют отдельные болевые синдромы, нуждающиеся в специфической терапии. Примером может служить постгерпетическая невралгия, для профилактики и лечения которой применяют варицелла-зостер гипериммунный глобулин (VZV-IG) [20].
Учитывая большое число и разнообразие заболеваний, сопровождающихся болевыми синдромами, и огромное количество препаратов, оказывающих обезболивающее действие, значительные трудности представляет выбор стратегии или алгоритма терапии в каждом конкретном случае. В качестве примера на рис. 3 приведен алгоритм лекарственного лечения острых дорсалгий.
Лечение болевых синдромов не ограничивается только применением медикаментозных средств. Существенную роль при их лечении играют и физиотерапевтические методы. Различные модальности воздействия и приемы использования физических и бальнеологических лечебных факторов позволяют селективно активизировать периферические и/или центральные нисходящие звенья антиноцицептивной системы и уменьшить восходящую болевую импульсацию. Купирование болевого синдрома приносит, например, электрофорез 5—10% раствора новокаина, который проводится по продольной методике по ходу нервов верхних или нижних конечностей. Выраженное обезболивание нередко достигается и при ультрафиолетовом облучении (особенно с последующим новокаинэлектрофорезом). При хронических болевых синдромах целесообразно назначать трансцеребральный бромэлектрофорез по Бургиньону или электросон.
Широкое применение в лечении боли получили грязевые аппликации невысокой температуры на пораженную конечность и по внеочаговой методике на шейную или поясничную часть спинного мозга и соответствующие узлы пограничного симпатического ствола. Целесообразно проводить гальванизацию через грязевую аппликацию (10—12 процедур на курс лечения). Средством лечения болевых синдромов является и рентгенотерапия. Она проводится по 3 методикам: прямым воздействием на пора-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2009 |
87 |
ЛЕКЦИЯ
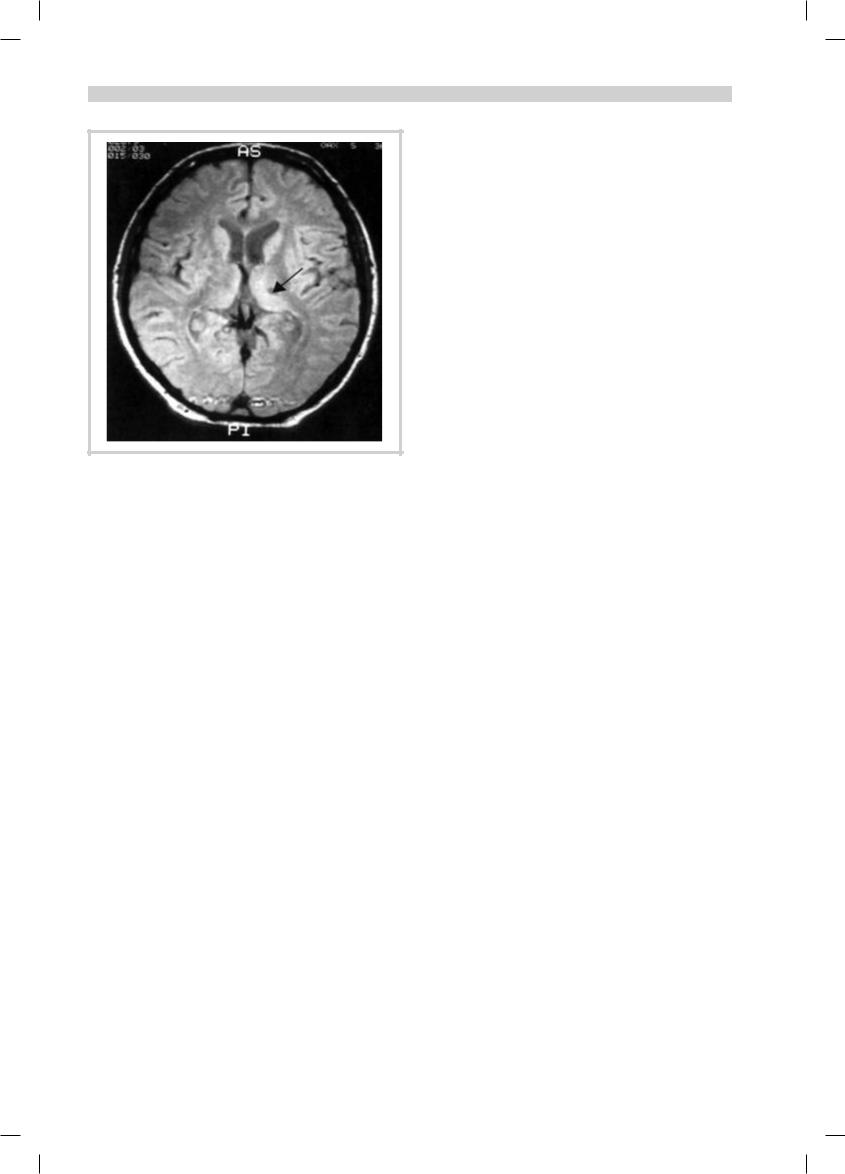
Рис. 4. МРТ-картина инсульта в области таламуса (стрелка), клинически проявляющаяся выраженным болевым синдромом.
женную зону, непрямым воздействием (облучением соответствующих сегментов спинного мозга и пограничного симпатического ствола) и комбинированным методом.
Новым подходом к лечению хронических болевых синдромов является также применение нейромодуляции. Речь идет о малоинвазивных методах оперативных вмешательств, связанных с электрической или медиаторной стимуляцией различных отделов нервной системы. Они делятся на нейростимуляцию и метод подоболочечного введения анальгетиков и анестетиков. Суть нейростимуляции заключается в использовании электродов на любом уровне выше источника боли таким образом, что электрический импульс, возникающий при включении системы для стимуляции, блокирует путь для прохождения болевого раздражения. Имплантируемый генератор или приемник через электрод оказывают импульсное воздействие на
определенные структуры нервной системы. При боли в поясничной области, нижних конечностях электроды имплантируются на область поясничного утолщения спинного мозга эпидурально, при невралгии тройничного нерва электроды могут устанавливаться эпидурально на моторную область коры головного мозга. При центральных болях (например, таламических болях после инсульта), применяется стимуляция глубинных структур головного мозга (рис. 4) [14, 15, 17].
Дозированное автоматическое подоболочечное введение анальгетиков и анестетиков позволяет проводить длительное обезболивание при минимуме побочных эффектов. Так, интратекальное введение морфина позволяет значительно снизить его дозу, что дает возможность избежать наркотической зависимости и нивелировать побочные эффекты. Применяются также нетрадиционные методы обезболивания (например, акупунктура).
И, наконец, нельзя не отметить, что в неврологической практике широко используются местные анестетики (лидокаин, бупивакаин), в том числе в виде пластырей, и новокаиновые блокады: местные (по Аствацатурову), проводниковые, корешковые и по Котлену с применением глюкокортикоидов (кеналог, дипроспан). Наиболее эффективно их использование для лечения вторичной гипералгезии (снижение порогов болевой чувствительности вне зоны повреждения).
Таким образом, несмотря на значительные успехи в раскрытии механизмов боли и в разработке новых лекарственных препаратов для лечения болевых синдромов, боль остается актуальной проблемой современной неврологии в связи с недостаточной эффективностью лечения пострадавших и нуждается в дальнейших клинических и экспериментальных исследованиях. Поэтому на сегодняшний день многие аспекты развития болевых синдромом остаются дискутабельными. Так, не определена значимость различных нейротрансмиттерных систем в цепи восстановительных и компенсаторных реакций организма. По данным клинических исследований, очевидна определенная несостоятельность антиноцицептивной системы в поддержании структурно-функционального постоянства организма при хронических болевых синдромах. В связи с этим представляется актуальным поиск путей регуляции и стимуляции нейропластичности, а также стандартизации схем лечения.
ЛИТЕРАТУРА
1.Данилов А.Б. Прегабалин (лирика) в лечении нейропатической боли. Материалы конференции, посвященной 80-летию со дня рождения профессора Б.М. Гехта. М 2007;86—97.
2.Живолупов С.А., Самарцев И.Н. Особенности болевого синдрома при травматических невропатиях. Всероссийская научно-практическая конференция. «Актуальные вопросы клиники, диагностики и лечения больных в многопрофильном лечебном учреждении», 8-я: Материалы. Вестн Рос Воен-мед акад 2007;1:17:380.
3.Калюжный Л.В. Физиологические механизмы регуляции болевой чувствительности. М: Медицина 1984;10—34.
4.Кукушкин М.Л. Патофизиологические механизмы болевых синдромов. Боль 2003;1:5—12.
5.Одинак М.М., Живолупов С.А., Рашидов Н.А., Медына О.Д. К вопросу о патогенезе некоторых болевых синдромов в неврологии. Клин патофизиол 2005;2:1:17—24.
6.Одинак М.М., Живолупов С.А., Самарцев И.Н. Патогенетическое лечение болевых синдромов в неврологической практике: трудности и перспективы. Справочник поликлинического врача 2006;7:52—58.
7.Одинак М.М., Живолупов С.А., Вознюк И.В., Рашидов Н.А. Современные методы модуляции компенсаторно-восстановительных процессов при травматических невропатиях и плексопатиях. М 2007;97—109.
8.Beecher H.K. Measurement of Subjective Responses: Quantitative Effect of Drugs. New York: Oxford University Press 1959;23—30.
9.Bennett M.I., Smith B.H., Torrance N., Lee A.J. Can pain be more or less neuropathic? Comparison of symptom assessment tools with ratings of certainty by clinicians. Pain 2006;122:289—294.
10.Bouhassira D., Attal N., Fermanian J. et al. Development and validation of the neuropathic pain symptom inventory. Pain 2004;108:248—257.
11.Breivik H., Borchgrevink P.C., Allen S.M. et al. Assessment of pain. Br J Anaesth 2008;101:1:17—24.
88 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2009 |

БОЛЕВЫЕ СИНДРОМЫ
12.Coplan P.M., Schmader K., Nikas A. et al. Development of a measure of the burden of pain due to herpes zoster and postherpetic neuralgia for prevention trials: adaptation of the brief pain inventory. Pain 2004;5:344—356.
13.Dworkin R.H., Backonja M., Rowbotham M.C. et al. Advances in neuropathic pain. Arch Neurol 2003;60:1524—1534.
14.Finnerup N.B., Otto M., McQuay H.J. et al. Algorithm for neuropathic pain treatment: An evidence based proposal. Pain 2005;118:289— 305.
15.Foley K.M. Opioids and chronic neuropathic pain. N Engl J Med 2003;348:1279—1281.
16.Gallagher R.M. Neuropathic pain: the global challenge. Pain Med 2004; 5:Suppl 1:1—2.
17.Gilron I., Bailey J.M., Tu D. et al. Morphine, gabapentin, or their combination for neuropathic pain. N Engl J Med 2005;352:1324—1334.
18.Goldscheider A. Physiologie der Hautsinnesnerven. Leipzig: Johann Ambrosius Barth 1898;1—432.
19.Grelik C., Bennett G.J., Ribeiro-da-Silva A. Autonomic fibre sprouting and changes in nociceptive sensory innervation in the rat lower lip skin following chronic constriction injury. Eur J Neurosci 2005;21:2475—2487.
21.Jensen T.S., Gottrup H., Sindrup S.H. et al. The clinical picture of neuropathic pain. Eur J Pharmacol 2001;429:1—11.
22.Lopez B.C., Hamlyn P.J., Zakrzewska J.M. Systematic review of ablative neurosurgical techniques for the treatment of trigeminal neuralgia. Neurosurgery 2004;54:973—982.
23.McHenry L.C.Jr. Garrison’s History of Neurology. Springfield IL: CC Thomas 1969;3—24.
24.Melzack R., Wall P.D. Pain mechanisms: a new theory. Science 1965;150:9719.
25.Melzack R., Wall P.D. Evolution of pain theories. Intern Anesthesiol Clin 1970;8:1:3—34.
26.Melzack R., Taenzer P., Feldman P. Labour is still painful after prepared childbirth training. Can Med Ass J 1981;125:4:357—363.
27.Melzack R. From the gate to the neuromatrix. Pain 1999;6:121—126.
28.Merskey H., Bogduk N. Classification of Chronic Pain. IASP Task Force on Taxonomy, Second Edition. Seattle: IASP Press 1994;209.
29.Rexed B. The cytoarchitectonic organization of the spinal cord in the cat. J Comp Neurol 1952;96:3:414—495.
20.Hugler P., Siebrecht P., Hoffmann K. et al. Prevention of postherpetic neural30. Von Frey M. Beiträge zur Physiologie des Schmerzsinns (2 Mitt.). Berichte
gia with varicella-zoster hyperimmune globulin. Eur J Pain 2002;6:435— |
über die Verhandlungen der Königlich Sächsischen Gesellschaft der Wis- |
445. |
senschaften 1894;46:283—297. |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2009 |
89 |
