
Журнал неврологии и психиатрии / 2006 / NEV_2006_10_08
.pdf
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Клинико-иммунологическая оценка эффективности применения мексидола при пояснично-крестцовой радикулопатии
Е.Б. ЛИХАЧЕВА, И.И. ШОЛОМОВ
Clinical and immunological assessment of efficacy of mexidol in the treatment of lumbosacral radiculopathy
E.B. LIKHACHEVA, I.I. SHOLOMOV
Кафедра нервных болезней Саратовского государственного медицинского университета
Проведен анализ эффективности применения препарата мексидол в комплексном лечении пояснично-крестцовых радикулопатий. Доказано превосходство данного метода перед традиционными с использованием клинико-имму- нологических методик. Выявлена зависимость между скоростью ремиелинизации нервных волокон и применением цитопротективной антигипоксической терапии.
Ключевые слова: нейропротекция, гипоксия, аутоагрессия, ремиелинизация.
Efficacy of mexidol in the complex treatment of lumbosacral radiculopathy has been analyzed. Comparing to the traditional treatment using clinical and immunological methods, this method proved to be superior.
Key words: citoprotecion, antihipoxiy, lumbosacral radiculopathy, treatment, remyelinisation.
Среди поражений периферической нервной системы на пояснично-крестцовые радикулопатии (ПКР) приходится 70% [7]. По современным представлениям, они могут быть вертеброгенного (чаще всего остеохондроз позвоночника) и невертеброгенного происхождения. Корешковые синдромы выявляются у 37,4% больных с дегенеративно-дистрофическими изменениями межпозвонковых дисков [10]. При вертеброгенном поражении корешка в клинической картине проявляется действие вегетативно-сосудистых, реактивно-воспалительных, застойных и других факторов [1]. Рассмотрим более подробно современные представления о патогенезе ПКР.
Относительно давно [16, 17] было установлено, что при повреждении волокон нервного корешка в результате механического воздействия в одной их части отмечается сегментарная демиелинизация, в другой — валлеровское перерождение клеток. Такого рода изменения ультраструктуры нервных волокон корешка приводят к нарушению проведения электрических импульсов и аксонального транспорта. В условиях гипоксии и отека корешка при ПКР страдают трофические процессы и обмен веществ между телом нейрона и его отростками. Продукты распада и токсины из мест дегенерации корешка за счет большего проксимально-дисталь- ного аксоплазменного градиента переносятся в нижние отделы сплетения, периферические нервы, вызывая там такие же процессы, клинически проявляющиеся дистальными парезами. С помощью ретроградного транспорта те же продукты распада попадают в тело нервной клетки, нарушая работу ее цитоплазменных структур и изменяя защит-
© Е.Б. Лихачева, И.М. Шоломов, 2006
Zh Nevrol Psikhiatr Im SS Korsakova 2006;106:10:52—57
ную функцию всего неврального аппарата. В результате происходят уменьшение выработки миелина, дальнейшее повреждение гематоневрального барьера (вторичная демиелинизация) и в итоге хронизация заболевания [7]. Все это объясняет наличие у больных ПКР признаков активации перекисного окисления липидов, проявляющейся повышением уровня диеновых конъюгатов и малонового диальдегида [2, 6].
В настоящее время рассматривается и теория аутоиммунных механизмов развития ПКР [5]. Она основана на признании [4, 12] роли нейроиммунных механизмов в формировании генераторов патологически усиленного возбуждения и формировании патологической алгической системы, данных о существовании общих для нервных и иммунокомпетентных клеток молекулярных рецепторов, через которые осуществляется сочетанная регуляция систем контроля боли и иммунных реакций, а также о наличии аутоантител к разнообразным антигенам нервной ткани при различных формах патологии нервной системы [12].
Развивающиеся в организме при ПКР иммунные реакции имеют как патогенетическую, так и саногенетическую направленность. При первом виде реакций возможны прогрессирование дистрофического процесса в межпозвонковых дисках в результате аутоагрессивного действия антител [9], распространение дистрофии на другие структуры позвоночного сегмента вследствие перекрестной аутоагрессии
êтканям, близким к диску по антигенным свойствам [13]. Кроме того, развивается аутоиммунный воспалительный процесс в корешках спинномозговых нервов, прилегающих
êдиску, эпидуральной клетчатке, оболочках спинного мозга [11]. Саногенетические иммунные механизмы заключаются в усилении Т-супрессорной активности лимфоцитов, способствующей уменьшению образования антител, элиминации антигенов и иммунных комплексов из крови и тканей [9], в рассасывании тканей выпавшей грыжи под влиянием макрофагов и лимфоцитов, усилении регенеративных про-
52 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2006 |

цессов в диске. Чем раньше включаются механизмы саногенеза, тем более благоприятно протекает заболевание. Длительно текущие болевые синдромы при остеохондрозе позвоночника приводят к вторичным иммунодефицитным состояниям, при которых страдают и клеточная, и гуморальная системы иммунитета [15]. Ряд исследователей показывают повышение иммунологических показателей при ПКР, в частности интерлейкина-1, фактора некроза опухоли, антител к основному белку миелина и фактору роста нерва [7], которые могут свидетельствовать об аутоиммунном воспалении в нервной ткани.
Âпоследние годы возрастает интерес к выявлению антинейтрофильных цитоплазматических антител (АНЦА). Основным их компонентом являются антитела к миелопероксидазе (МПО). МПО представляет собой содержащийся в азурофильных гранулах полиморфно-ядерных лейкоцитов гемопротеин, играющий важную роль в их антибактериальной и цитотоксической активности. Антитела к МПО обнаруживаются при васкулитах, гломерулонефрите, узелковом периартериите, системной красной волчанке, ревматоидном артрите, их титр возрастает во время обострения болезни. АНЦА могут обнаруживаться и при других заболеваниях. Положительный тест на AНЦA отмечен у 2—4% здоровых людей. В последнее время высказывается гипотеза об участии АНЦА в патогенезе микроваскулитов. Аутоантитела
êколлагену наиболее часто обнаруживают при ревматоидном артрите (вследствие иммунокомплексного внутрисуставного воспаления), системной красной волчанке, системной склеродермии, болезни Бехтерева, болезни Бехчета, гранулематозе Вегенера и др. Поскольку аутоагрессия является отражением патогенетических иммунных реакций и может быть направлена не только на нервные элементы корешка и периферического нерва, но и на окружающие их образования, т.е. сосуды и костно-суставную систему позвоночника, нам представилось интересным изучить уровень антител к коллагену и МПО в сыворотке крови больных ПКР и его динамику под влиянием проводимого лечения.
Âсвете сказанного осуществляется комплексное лече- ние ПКР, которое включает следующие направления: купирование основных механизмов раздражения синусвертебрального нерва и устранение сосудистых и дистрофических изменений в области экстравертебральных очагов (стероидные и нестероидные противовоспалительные средства, сосудистые препараты, миорелаксанты); активизация трофи- ческих процессов (биогенные стимуляторы, хондропротекторы, препараты витаминов, анаболические препараты); симптоматическая терапия (транквилизаторы, антидепрессанты, гастропротекторы). Перечень основных медикаментозных средств позволяет выбрать индивидуальную схему для конкретного больного в зависимости от предполагаемого патогенеза и ведущих клинических симптомов в картине ПКР. Среди соответствующих лекарственных средств привлекают к себе внимание препараты с нейропротективным действием, в частности мексидол.
Мексидол (3-окси-6-метил-2-этилпиридина сукцинат) является антиоксидантом, ингибитором свободных радикалов и мембранопротектором. Он уменьшает активацию перекисного окисления липидов и повышает активность антиоксидантной системы. Нейропротективное действие мексидола проявляется в восстановлении нарушенных при различной патологии структуры и функций мембран; модулирующем влиянии на мембраносвязанные ферменты, ионные каналы, транспортеры нейромедиаторов, рецепторные комплексы, в том числе бензодиазепиновый, ГАМК, ацетилхолиновый; оптимизации синаптической передачи между структурами ЦНС. Мексидол улучшает мозговой метаболизм и кровоснабжение мозга, реологи- ческие свойства крови, деятельность иммунной системы, подавляет агрегацию тромбоцитов. Антигипоксическое действие этого препарата проявляется в снижении потребности нейронов в кислороде в условиях гипоксии. Мексидол
оказывает антиатерогенное действие, замедляет процесс старения. Таким образом, он обладает широким спектром фармакологических эффектов, реализующихся по крайней мере на двух уровнях — нейрональном и сосудистом. Препарат оказывает церебропротективное, противогипоксиче- ское, транквилизирующее, антистрессорное, ноотропное (улучшение памяти, внимания, умственной работоспособности), антиалкогольное, противосудорожное, противопаркинсоническое, вегетотропное действие. Важно, что мексидол не вызывает побочных эффектов (за исключе- нием случаев индивидуальной непереносимости) и отли- чается низкой токсичностью.
Целью настоящей работы являлись анализ эффективности комплексной терапии ПКР с применением мексидола, оценка влияния цитопротективной антигипоксической терапии на скорость ремиелинизации нервных волокон, сопоставление сроков наступления клинической и иммунологической ремиссии.
Материал и методы
Исследование проведено на базе неврологического отделения городской клинической больницы ¹9 Саратова в период 2002—2005 гг. Обследовали 205 больных с ПКР — 104 женщин и 101 мужчину в возрасте от 18 до 74 лет.
Больные были разделены на две сравнимые по полу и возрасту группы — основную и группу сравнения. Основную группу составили 110 человек (56 мужчин и 54 женщины), группу сравнения — 95 (49 мужчин и 46 женщин). Кроме того, обследовали 30 здоровых лиц — группа контроля.
Всем больным проводился курс общепринятой медикаментозной терапии и физиотерапии. В основной группе дополнительно применялся мексидол по 2—4 мл 5% раствора 2 раза в день внутримышечно или внутривенно в течение 10—15 дней.
До начала лечения все больные обследовались неврологически. Клинико-лабораторное исследование включало общий анализ крови, а также биохимиче- ское исследование крови с определением сиаловых кислот, фибриногена, С-реактивного белка. Проводились также стимуляционная электронейромиография (ЭНМГ), КТ и МРТ. По окончании лечения перечисленные исследования повторяли (за исключе- нием КТ и МРТ).
Кроме того, у части пациентов определяли антитела к МПО в сыворотке крови методом иммуноферментного анализа с использованием тест-систем фирмы «Хема-медика» (Россия). В сыворотке крови определяли также аутоантитела к коллагену с помощью реакции преципитации.
Статистическая обработка полученных данных осуществлялась с использованием программ «Меди- ко-биологическая статистика» [8].
Результаты и обсуждение
Диагноз ПКР был поставлен пациентам обеих групп на основании подробного сбора анамнеза и данных тщательного неврологического обследования. Следует отметить, что в основной группе у 19 (17,3%) больных заболевание выявлялось впервые, у остальных 91 (82,7%) — повторно, в группе сравнения — у 14 (14,7%) и 81 (85,3%) соответственно.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2006 |
53 |
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Таблица 1. Интенсивность боли по ВАШ при повседневной активности у пациентов с ПКР до и после лечения, баллы (M±m)
Условие обследования |
Основная группа (n=110) |
Группа сравнения (n=95) |
|||
|
|
|
|
||
до лечения |
после лечения |
до лечения |
после лечения |
||
|
|||||
|
|
|
|
|
|
Ходьба по плоской поверхности |
5,2±0,4 |
2,2±0,5* |
4,9±0,7 |
4,2±0,9 |
|
Ходьба по лестнице |
6,4±0,6 |
3,4±0,3* |
6,7±0,2 |
6,3±0,5 |
|
Ночью в постели |
2,1±0,5 |
1,5±0,6* |
3,0±0,4 |
2,4±0,6* |
|
Положение сидя |
6,7±0,3 |
2,6±0,8* |
6,9±0,4 |
5,6±0,9* |
|
Положение стоя |
4,8±0,6 |
2,2±0,7* |
4,6±0,4 |
3,9±0,8 |
|
Уровень боли в наилучшие периоды болезни |
2,3±0,5 |
0,5±0,1* |
2,1±0,4 |
2,0±0,5 |
|
(как близко к нулю) |
|
|
|
|
|
Уровень боли в наихудшие периоды болезни |
8,6±0,7 |
5,3±0,4* |
8,7±0,2 |
8,4±0,6 |
|
(как близко к десяти) |
|
|
|
|
|
Примечание. Здесь и в табл. 3: * — достоверные различия между показателями до и после лечения (р<0,05).
Провоцирующими факторами развития ПКР явились переохлаждение — у 16 (14,6%) в основной группе и у 12 (12,6%) в группе сравнения, перенесенная вирусная инфекция — соответственно у 5 (4,5%) и 4 (4,2%), тяжелая физическая нагрузка — у 33 (30%)
è30 (31,6%); в части случаев имело место сочетание указанных факторов у 56 (50,9%) в основной группе
è49 (51,6%) в группе сравнения.
Практически всем обратившимся за стационарной помощью был проведен курс амбулаторного ле- чения, который не дал положительного результата или ожидаемый эффект был неполным. Так как пациенты обеих групп испытывали болевые ощущения той или иной степени, большое внимание уделялось оценке регресса болевого синдрома.
Известно, что наиболее простым и информативным тестом для количественной оценки восприятия боли является визуальная аналоговая шкала (ВАШ) [3]. С ее помощью мы регистрировали изменение болевых ощущений во время ходьбы по ровной поверхности и лестнице, при сидении, стоянии, в покое. Эти результаты представлены в табл. 1.
Из табл. 1 видно, что наиболее интенсивные болевые ощущения пациенты испытывали при сидении и ходьбе по лестнице. По первым пяти условиям обследования для каждого пациента при ежедневном осмотре высчитывался средний балл болевых ощущений. В группе сравнения выраженный болевой синдром (7—10 баллов) наблюдался у 29,4% пациентов, средней интенсивности (4—6 баллов)
— у 53,6%, умеренный (1—3 балла) — у 16,8% (28, 51 и 16 человек соответственно). В основной группе эти же показатели распределились следующим образом: 7—10 баллов у 29 (26,4%), 4—6 балла у 57 (51,8%) и 1—3 балла у 24 (21,8%). После завершения курса лечения при оценке болевого синдрома в основной группе снижение боли на 5 баллов и более отмечалось у 48 (43,6%) пациентов, на 1—4 балла — у 62 (56,4%). В группе сравнения снижение на 5 баллов и более было зафиксировано у 8 (8,4%) пациентов, на 1—4 балла — у 48 (50,5%), отсутствие динамики — у 38 (40%), усиление боли — у 1 (1,05%).
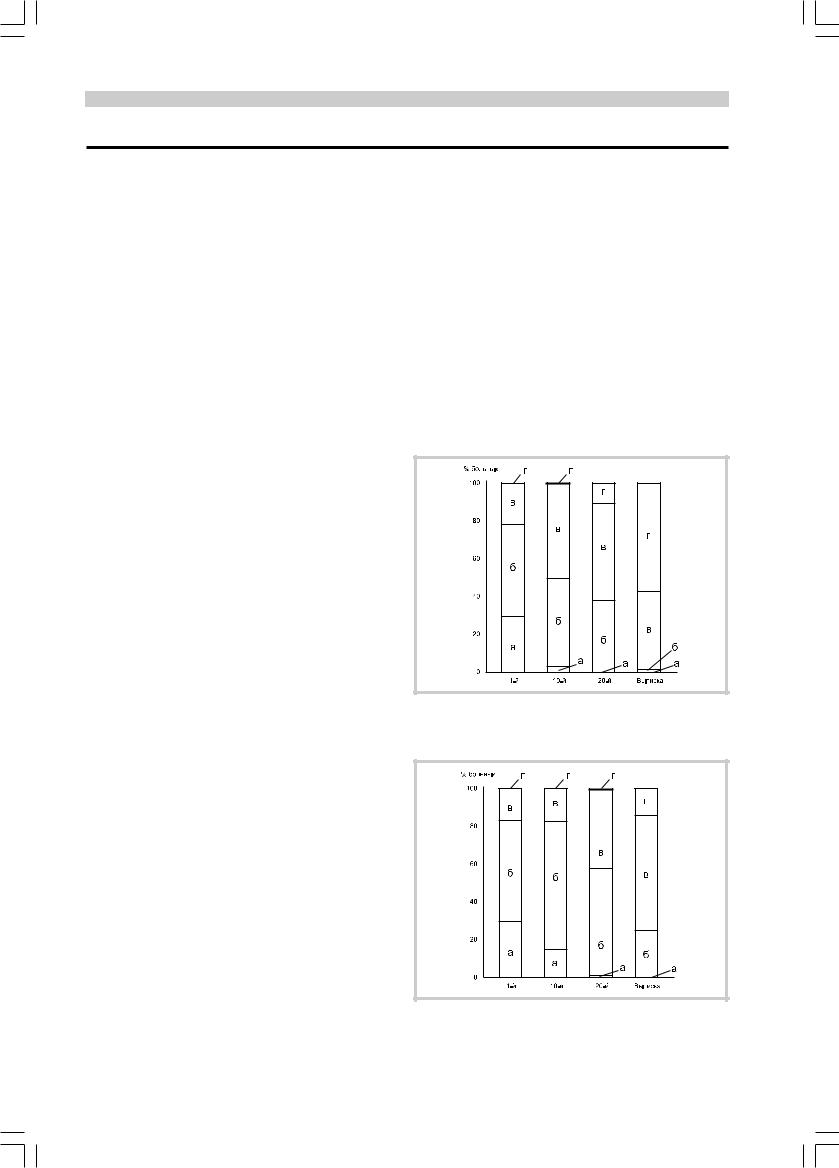
Динамика снижения интенсивности болевого синдрома в процессе лечения представлена на рис. 1 и 2.
Из рис. 1 видно, что в основной группе наибольший темп снижения боли приходится на 10—20-й день лечения, причем к моменту выписки (25—30-й день) более чем у 50% пациентов болевой синдром полно-
Рис. 1. Динамика интенсивности болевого синдрома по ВАШ в основной группе.
Здесь и на рис. 2: а — 7—10 баллов, б — 4—6 баллов, в — 1—3 балла, г — 0 баллов.
Рис. 2. Динамика интенсивности болевого синдрома по ВАШ в группе сравнения.
54 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2006 |

ЛЕЧЕНИЕ ПОЯСНИЧНО-КРЕСТЦОВОЙ РАДИКУЛОПАТИИ
Таблица 2. Динамика клинических симптомов у больных с ПКР в результате лечения
|
|
До лечения |
|
|
После лечения |
|
% улучшения |
|||
|
|
|
|
|
|
|
||||
Симптом |
основная группа |
группа сравнения |
основная группа |
группа сравнения |
основная |
группа |
||||
|
àáñ. |
% |
àáñ. |
% |
àáñ. |
% |
àáñ. |
% |
группа |
сравнения |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
Натяжения |
104 |
94,5 |
95 |
100 |
38 |
34,5 |
84 |
88,4 |
60 |
11,6 |
Нарушение |
98 |
89,1 |
89 |
93,7 |
62 |
56,4 |
76 |
80,0 |
32,7 |
13,7 |
чувствительности |
|
|
|
|
|
|
|
|
|
|
Отсутствие или |
94 |
85,5 |
86 |
90,5 |
54 |
49,1 |
72 |
75,8 |
36,4 |
14,7 |
снижение |
|
|
|
|
|
|
|
|
|
|
рефлексов |
|
|
|
|
|
|
|
|
|
|
Парезы |
23 |
20,9 |
16 |
16,8 |
18 |
16,4 |
15 |
15,8 |
4,5 |
1,0 |
Мышечно-тоничес- |
21 |
19,1 |
18 |
18,9 |
1 |
0,9 |
12 |
12,6 |
18,2 |
6,3 |
кие нарушения |
|
|
|
|
|
|
|
|
|
|
Вегетативно-трофи- |
24 |
21,8 |
19 |
20 |
20 |
18,2 |
18 |
18,9 |
3,6 |
1,1 |
ческие расстройства |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
стью купировался, у остальных становился более умеренным — нужно было лишь периодически принимать обезболивающие средства. В группе сравнения также наблюдался регресс болевого синдрома, но менее значительный. К моменту завершения курса лечения в группе сравнения преобладали больные с умеренным болевым синдромом (51,6%), однако оставалось значительным число лиц с болью средней интенсивности (25,3%), требующей постоянного приема обезболивающих средств.
Таким образом, терапия с использованием мексидола способствовала более выраженному уменьшению интенсивности болевого синдрома, чем в группе сравнения.
Напомним, что в сравниваемых группах до лече- ния выявлялись многочисленные неврологические симптомы в виде анизорефлексии, симптомов натяжения, изменения статики и динамики позвоночника, мышечно-тонический синдром, выпадение чувствительности в соответствующих дерматомах, веге- тативно-трофические расстройства, в ряде случаев отмечалось снижение силы в отдельных мышечных группах. У подавляющего большинства пациентов — 92 (83,6%) в основной группе и 88 (92,6%) в группе сравнения поражение было односторонним, соответственно у 18 (16,4%) и 7 (7,4%) человек — двусторонним. Динамика клинических симптомов в группах представлена в табл. 2. Из нее видно, что у всех пациентов основной группы, кроме одного, имело место обратное развитие мышечно-тонического синдрома, тогда как в группе сравнения такие изменения были только у 6 (33,3%) из 18. У 72 (69,2%) больных основной группы купировались симптомы натяжения, в группе сравнения — лишь у 11 (11,6%). Отмечалась также динамика в рефлекторной сфере: восстановление (полное или частичное) зарегистрировано у 40 (42,6%) больных основной группы и у 14 (16,3%) в группе сравнения. У остальных пациентов такой динамики не было отмечено. Чувствительность восстановилась у 36 (36,7%) пациентов основной группы и у 13 (14,6%) в группе сравнения, мышеч- ная сила — соответственно у 5 (21,7%) и 1 (6,3%).
Отрицательной динамики не отмечено ни у одного из пациентов.
Таким образом, более значительный регресс неврологического дефицита был достигнут в основной группе. Это касалось прежде всего мышечно-тониче- ского синдрома и симптомов натяжения, которые, как и боль, причиняют наибольшие страдания больным. Следует также отметить в этой группе более быстрое, чем в группе сравнения, восстановление рефлексов и чувствительности, что может свидетельствовать об уменьшении выраженности воспалительных и гипоксических нарушений в корешке и перифери- ческих нервах, уменьшении отека, а также о начавшихся процессах ремиелинизации. Столь незначительная динамика в обеих группах в отношении дистальных парезов и вегетативно-трофических расстройств может говорить о существенном поражении миелиновой оболочки двигательных волокон корешков и периферических нервов, для восстановления которых требуются больший 15—30-дневного курса стационарного лечения временной промежуток и поддерживающая медикаментозная и физиотерапия в амбулаторных условиях.
При субъективной оценке эффективности лече- ния в основной группе улучшение зафиксировано у 108 (98,2%) пациентов, в то время как в группе сравнения — только у 37 (38,9%).
При рентгенологическом исследовании и МРТ у больных обеих групп выявлялись признаки остеохондроза позвоночника, спондилеза и спондилоартроза, захватывающих от одного-двух позвонков до полного поражения пояснично-крестцового отдела. Были диагностированы грыжи Шморля в 9 (4,4%) случа- ях, у одного больного множественные, а также в 100% случаев межпозвонковые задние протрузии и/или грыжи: у 28 (13,7%) человек срединная, у 147 (71,7%) парамедианная, у 30 (14,6%) боковая, в том числе у 25 (12,2%) множественные. Локализация протрузий и грыж была такой: у 128 (62,4%) пациентов на уровнях L5—S1, у 71 (34,6%) — L4—L5, у 4 (1,95%) — L3—L4, по 1 (0,5%) пациенту на уровнях L2—L3 и L1—L2. В 133 (64,8%) случаях протрузии и грыжи ком-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2006 |
55 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Таблица 3. Динамика показателей ЭНМГ у больных с ПКР
|
|
Основная группа |
Группа сравнения |
Kонтроль- |
% восстановления |
|||
|
|
|
|
|
|
|
|
|
Показатель |
Точки стимуляции |
äî |
после |
äî |
после |
íàÿ |
основная |
группа |
|
|
группа |
||||||
|
|
лечения |
лечения |
лечения |
лечения |
группа |
сравнения |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
Амплитуда |
Большеберцовый |
3,75±0,44 |
4,12±0,25* |
3,71±0,4 |
3,8±0,69 |
5,78±1,2 |
8,9 |
2,6 |
М-ответа, мВ |
íåðâ |
|
|
|
|
|
|
|
|
Малоберцовый |
2,78±0,65 |
3,5±0,49* |
2,87±0,42 |
2,99±0,47 |
5,65±1,05 |
20,4 |
3,75 |
|
íåðâ |
|
|
|
|
|
|
|
Латентность |
Большеберцовый |
44,01±3,86 |
33,65±8,2* |
43,89±3,54 |
42,04±3,87 |
37,0±3,9 |
23,5 |
4,2 |
F-волны, мс |
íåðâ |
|
|
|
|
|
|
|
|
Малоберцовый |
44,14±3,93 |
37,77±5,2* |
44,2±3,85 |
41,99±3,15 |
34,8±3,1 |
14,4 |
5 |
|
íåðâ |
|
|
|
|
|
|
|
ÑÏÈ ïî äâè- |
Большеберцовый |
29,3±4,1 |
35,1±2,2* |
29,9±5,1 |
32,6±4,9 |
47,8±6,1 |
16,5 |
8,3 |
гательным |
íåðâ |
|
|
|
|
|
|
|
волокнам, м/с |
Малоберцовый |
30,1±4,8 |
36±4,1* |
31,1±4,6 |
33,05±3,9 |
42,3±5,1 |
17,1 |
5,9 |
|
||||||||
íåðâ
примировали переднюю стенку дурального мешка, в 20 (9,8%) отмечалось нарушение ликвородинамики. Поясничный стеноз был выявлен в 47 (22,9%) случа- ях. При сопоставлении клинической картины с результатами МРТ у 181 (88,3%) больного было выявлено соответствие уровня локализации и направления выпячивания уровню выявленной радикулопатии, что говорит о высокой чувствительности данного метода обследования. В остальных случаях локализация протрузии или грыжи не соответствовала стороне и уровню радикулопатии. Так, у одного из пациентов были выявлены задние срединные протрузии дисков L1—L2 и L2—L3 размером 3 и 3,5 мм без признаков компрессии дурального мешка, а клинически и по результатам ЭНМГ определялась двусторонняя радикулопатия L5, S1 cо вторичным аксонально-де- миелинизирующим поражением обоих большеберцовых нервов.
Согласно результатам ЭНМГ (табл. 3), в обеих группах до лечения отмечались достоверные (р<0,05) по сравнению с контрольной группой изменения амплитудно-скоростных показателей и увеличение латентности F-волны, что свидетельствует об аксонально-демиелинизирующем процессе как в проксимальном, так и в дистальном участке ветвей пояснично-крестцового сплетения. После проведенного лечения в основной группе зафиксировано достоверное (р<0,05), по сравнению с группой сравнения увеличение амплитуды М-ответа, уменьшение латентности F-волны, увеличение скорости проведения импульса (СПИ). Особенно заметно (в 2—4 раза чаще по сравнению с группой сравнения) восстановилась амплитуда М-ответа и уменьшилась латентность F-волны, примерно вдвое возросла СПИ по двигательным волокнам — свидетельство возможного частичного или полного восстановления аксонального транспорта и ускорения ремиелинизации поврежденных нервных волокон. Этим объясняется более быстрый регресс неврологической симптоматики в основной группе, нежели в группе сравнения. Хотя исследованные параметры и не достигли значений в контрольной груп-
пе, они соответствовали нижним границам нормы, указанным в литературе.
При мониторинге терморегуляции и дополнительных биохимических исследованиях у больных основной группы отмечено отсутствие повышения температуры тела, эритематозных кожных высыпаний, полиорганной симптоматики, повышения уровня сиаловых кислот, фибриногена, С-реактивного белка, ускорения СОЭ и воспалительных изменений в лейкоцитарной формуле. Как отмечалось выше, у 45 больных обеих групп (25 основной группы и 20 группы сравнения) проводилось исследование антител к МПО в сыворотке крови в динамике. Их титр у 15 лиц контрольной группы (практически здоровые) соответствовал 0,8±0,02 ед. опт. пл. В основной группе больных он составлял 5,5±0,28 ед. опт.пл., в группе сравнения — 5,1±0,31 ед. опт.пл. После терапии этот показатель снизился соответственно до 3,2±0,24 и 4,3±0,52 ед. опт.пл.
Хотя в основной группе и отмечалась достоверная (р<0,05) положительная динамика, данный показатель, как и в группе сравнения, не достиг значе- ний контроля. Это может свидетельствовать о продолжающемся, несмотря на значительное клиниче- ское улучшение, воздействии патогенетических иммунных механизмов, недостаточности механизмов саногенеза и как следствие о хроническом течении заболевания.
Что касается антител к коллагену, то в контрольной группе они обнаружены в титре 1:10 у 2 (13,3%) человек, у остальных результат оказался отрицательным. Титры антител к коллагену у больных представлены в табл. 4.
Из этих данных видно, что в обеих группах больных под влиянием терапии титр антител к коллагену снизился, при этом в основной группе более выраженно и они в основном определялись при небольшом разведении. В группе сравнения сохранялась их достаточно интенсивная продукция.
Обобщая результаты определения титра антител к МПО и коллагену, можно сделать заключение, что сроки наступления иммунологической ремиссии при
56 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2006 |

ЛЕЧЕНИЕ ПОЯСНИЧНО-КРЕСТЦОВОЙ РАДИКУЛОПАТИИ
Таблица 4. Распределение больных в зависимости от титра антител к коллагену
|
|
|
Основная группа (n=25) |
|
|
Группа сравнения (n=20) |
|
||
|
|
|
|
|
|
|
|
|
|
|
Òèòð |
|
àáñ. |
|
% |
|
àáñ. |
% |
|
|
|
|
|
|
|
|
|
|
|
|
äî |
после |
äî |
после |
äî |
после |
äî |
после |
|
|
|
лечения |
лечения |
лечения |
лечения |
лечения |
лечения |
лечения |
лечения |
|
|
|
|
|
|
|
|
|
|
1:10 |
1 |
4 |
4 |
16 |
1 |
1 |
5 |
5 |
|
1:20 |
7 |
10 |
28 |
40 |
4 |
4 |
20 |
20 |
|
1:40 |
1 |
3 |
4 |
12 |
2 |
3 |
10 |
15 |
|
1:80 |
1 |
2 |
4 |
8 |
0 |
2 |
0 |
10 |
|
1:160 |
4 |
2 |
16 |
8 |
2 |
2 |
10 |
10 |
|
1:320 |
2 |
2 |
8 |
8 |
3 |
1 |
15 |
5 |
|
1:640 |
5 |
2 |
20 |
8 |
4 |
4 |
20 |
20 |
|
1:1280 |
4 |
0 |
16 |
0 |
4 |
3 |
20 |
15 |
|
|
|
|
|
|
|
|
|
|
|
ПКР не соответствуют срокам клинической ремиссии — иными словами, больным требуется продолжение комплексной терапии, включающей применение мексидола (можно рекомендовать дозу по 0,5 мг 3 раза в сутки в течение 6—8 нед). Такая терапия может осуществляться амбулаторно.
Таким образом, проведенное исследование показало превосходство комплексного лечения ПКР с применением мексидола над традиционными методами терапии. Установлено положительное влияние его ци-
ЛИТЕРАТУРА
1.Антонов И.П. Вопросы классификации и формулировка диагноза вертеброгенных (спондилогенных) заболеваний нервной системы. Периферическая нервная система. Минск 1983; 6: 49— 56.
2.Бабенков Н.В., Халецкая В.А., Клачкова Л.Б., Ваулина Т.С. Применение мексидола при дискогенных радикулопатиях. Кремлевская медицина: Клин вестн 2001; 2: 59—62.
3.Белова А.Н., Щепетова О.Н. Шкалы, тесты и опросники в медицинской реабилитации. М: Антидор 2002.
4.Василенко А.М., Захарова Л.А., Метакса Е.Е., Яновский О.Г. Корреляции болевой чувствительности и гуморального иммунного ответа при термораздражении у мышей. Бюл экспер биол и мед 1995; 119: 4: 405—409.
5.Веселовский В.П., Ладыгин А.П., Кочергина О.С. Клиническая классификация вертеброневрологических синдромов. Неврол вестн 1995; 27: 3—4: 45—50.
6.Воронина Т.А., Смирнов Л.Д., Горейнова И.И. Механизм действия и обоснование применения препарата мексидол в неврологии. Научно-практическая конференция по неврологии. М 2000; 2—4.
7.Герасимова М.М. Цитомедины в комплексной терапии пояснич- но-крестцовых радикулопатий. В кн.: Кортексин — пятилетний опыт отечественной неврологии. Под ред. А.А. Скоромца, М.М. Дьяконова. Ст-Петербург: Наука 2005; 156—167.
8.Гланц С. Биомедицинская статистика. Пер. с англ. 1999; 459.
9.Дривотинов Б.В., Ходосовская В.М. Роль аутоиммунных реакций в патогенезе рецидивов и ремиссий корешкового болевого син-
топротективного антигипоксического действия на скорость ремиелинизации нервных волокон. С учетом выявленной у леченых больных продукции аутоантител к МПО и коллагену можно предполагать, что при ПКР речь идет не о локальном, а о системном патологическом процессе, затрагивающем сосудистую, ко- стно-суставную (в данном случае позвоночник) системы организма. Мексидол в этом случае, по-видимо- му, обеспечивает, помимо трофической и антиоксидантной, иммунную защиту нервных клеток.
дрома при поясничном остеохондрозе. Периферическая нервная система. Минск 1978; 1: 62—67.
10.Жулев Н.М., Бадзгарадзе Ю.Д., Жулев С.Н. Остеохондроз позвоночника: Руководство для врачей. Ст-Петербург: Лань 2001.
11.Заславский Е.С. Болевые мышечно-дистрофические синдромы (этиология, патогенез, клиника, лечение): Автореф. дис. .. д-ра мед. наук. М 1980.
12.Клюшник Т.П. Аутоантитела к фактору роста нервов при нерв- но-психических заболеваниях и нарушениях развития нервной системы: Автореф. дис. ... д-ра мед. наук. М 1997.
13.Коган О.Г. Иммунопатологические аспекты остеохондроза позвоночника и его неврологических синдромов. Проблемы аутоаллергии. Таллин 1975; 224—225.
14.Крыжановский Г.Н. Общая патофизиология нервной системы: Руководство. М: Медицина 1997.
15.Сороковиков В.А. Хирургическое лечение дискогенного пояс- нично-крестцового радикулита с иммунокоррекцией: Автореф. дис. ... канд. мед. наук. Иркутск 1995.
16.Ochoa J. Histopathology of common mononeuropathies. In: Nerve Repair and Regeneration. Eds. D.L. Jewett, H.R. McCarroll, Jr.-St. Louis, C.V. Mosby 1980; 36—52.
17.Rydevik Â., Lundborg G., Bagge U. Effects of graded compression on intraneural blood flow — an in vivo study on rabbit tibial nerve. J Hand Surg 1981; 6: 3—12.
Поступила 31.07.06
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2006 |
57 |
