
Журнал неврологии и психиатрии / 2006 / NEV_2006_10_07
.pdf
Анаболическо-катаболический баланс при депрессии: влияние коаксила
Я.А. КОЧЕТКОВ, К.В. БЕЛЬТИКОВА, Л.Н. ГОРОБЕЦ
Anabolic-catabolic balance in depression: an effect of coaxil
YA.A. KOCHETKOV, K.V. BELTIKOVA, L.N. GOROBETS
Московский НИИ психиатрии Росздрава
Изучали соотношение анаболических и катаболических процессов в рамках нейроэндокринных сдвигов при депрессии до и в процессе терапии коаксилом. Показателем катаболических процессов было содержание в крови кортизола, анаболических — дегидроэпиандростерона (дегидроэпиандростерона-сульфата — ДГЭА-С). Обследовали 39 пациентов среднего возраста, 25 из которых составили основную группу лечившихся коаксилом (37,5 мг/сут в течение 4 нед) и 14 — группу сравнения — лечившихся сертралином (50 мг/сут 4 нед). Средний уровень кортизола у всех больных депрессией был выше нормы. Терапия коаксилом и сертралином приводила к снижению среднего уровня кортизола (достоверных различий между группами не было). Обнаружена отрицательная корреляция между уровнем ДГЭА-С и выраженностью депрессии до лечения. Коаксил в отличие от сертралина вызывал повышение этого показателя у больных со сниженным содержанием ДГЭА-С. Соотношение кортизол/ДГЭА-С при лечении коаксилом и сертралином снижалось, но в первом случае более выраженно (p=0,003). Полученные данные авторы рассматривают в аспекте понятия аллостаза (allostasis) — состояния готовности организма к изменениям (стрессовой реакции).
Ключевые слова: депрессия, нейроэндокринология, анаболические и катаболические кортикостероиды, влияние антидепрессантов.
Correlation between anabolic and catabolic process in terms of neuroendocrine changes in depression has been studied before and after coaxil therapy. The index of catabolic processes was cortisol blood level and that of anabolic processes
– dehydroepiandrosterone (dehydroepiandrosterone sulfate, DHEA-S) level. The total of 39 patients of middle age were studied: 25 of the study group treated with coaxil (37,5 mg/day during 4 weeks) and 14 of the comparison group treated with sertraline (50 mg/day during 4 weeks). A mean level of cortisol was higher than normal one in patients with depression. Coaxil and sertraline decreased the mean cortisol level, no significant differences being found between these drugs. There was negative correlation between the DHEA-S level and severity of depression before the treatment. Unlike sertraline, coaxil caused an increase of this parameter in patients with decreased DHEA-S level. The ratio cortisol/ DHEA-S decreased during the treatment with either coaxil or sertraline but in the former case it was more pronounced (p=0,003). The authors considered the data obtained in the aspect of concept of allostasis — the ability of the organism to achieve changes (stress reaction).
Key words: depression, neuroendocrinology, anabolic and catabolic corticosteroids, antidepressants effect.
Известно, что патогенез депрессии рассматривается в основном в свете моноаминовых гипотез, среди которых доминируют катехоламиновая и серотониновая, в пользу чего свидетельствует эффективность соответствующих групп антидепрессантов [8, 11]. Но вместе с тем среди таких гипотез всегда значительное место занимали и нейроэндокринные [21, 39], интерес к которым усилился в последние десятилетия, о чем свидетельствует большое число посвященных этому вопросу исследований [1, 2, 4–6, 9, 12—41], в том числе и отечественных.
В большинстве работ центральная роль отводится нарушениям различных звеньев гипоталамо-гипо- физарно-надпочечниковой системы. При этом активно изучается также значение тиреоидных гормонов, половых гормонов, секреции пролактина, сомато-
© Коллектив авторов, 2006
Zh Nevrol Psikhiatr Im SS Korsakova 2006;106:10:47—51
тропного гормона, мелатонина, различных нейропептидов [17].
Установлено, что многие пациенты с депрессией имеют те или иные нарушения функции гипоталамо-гипофи- зарно-надпочечниковой системы. Это и гиперкортизолемия, и увеличение надпочечников [35], измененный суточный ритм [19, 20], отсутствие реакции на дексаметазоновый тест [5, 6, 16], уменьшение количества рецепторов кортизола в гиппокампе [31, 32]. При использовании кортиколибериндексаметазонового теста нарушения функции гипоталамо- гипофизарно-надпочечниковой системы обнаруживаются более чем у 80% пациентов с депрессией [21—23, 33].
Такие симптомы депрессии, как сниженная психомоторная активность, изменения в структуре сна, снижение либидо, сердечно-сосудистые изменения, когнитивный дефицит, частично могут быть связаны с высоким уровнем кортизола, АКТГ и кортиколиберина в крови [14, 34, 37, 39].
Длительная гиперсекреция кортизола, кроме того, может обусловливать снижение массы мышечной ткани, резистентность клеток к действию инсулина, гипергликемию, снижение иммунитета и др., т.е. нарушения, встречающиеся при депрессии с длительным повышением уровня кортизола [10, 14, 42].
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2006 |
47 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
С продолжительным воздействием высокого уровня кортизола в настоящее время связывают также изменения нейрональной пластичности гиппокампа при депрессии и такие его проявления, как нарушения структуры и функции дендритов (укорочение, уменьшение числа шипиков и синаптических контактов), гибель нервных и глиальных клеток [3, 7, 14, 18, 29, 30].
Âпоследнее время большой интерес исследователей привлекают вопросы о соотношении катаболических и анаболических процессов при депрессивных состояниях [4, 21, 26, 28, 39, 40]. Дело в том, что гиперсекреция кортизола вызывает сдвиг метаболизма в сторону катаболических процессов, т.е. процессы распада и высвобождения энергии начинают преобладать над анаболическими. Об этом косвенно свидетельствует и низкий уровень гормонов, вызывающих анаболический эффект, — гормона роста, соматомединов, андрогенов, дегидроэпиандростерона (ДГЭА) и ДГЭА-сульфата (ДГЭА-С). Все более очевидным становится тот факт, что отрицательные эффекты кортизола проявляются не сами по себе, а на фоне истощения резерва анаболических гормонов при депрессии.
Одним из важных показателей соотношения катаболи- ческих и анаболических процессов служит соотношение уровней кортизола и ДГЭА-С [4, 38, 39, 42]. ДГЭА — это стероид, являющийся ключевым звеном в синтезе многих стероидных гормонов. Основным местом его синтеза, как и для кортизола, является кора надпочечников. В крови большая часть ДГЭА находится в форме ДГЭА-С. Долго считалось, что он не оказывает собственного эндокринного действия в организме. Но в последнее время установлено, что ДГЭА и ДГЭА-С такие эффекты вызывают, особенно в ЦНС. Было обнаружено, кроме того, что ДГЭА и некоторые другие стероидные соединения синтезируются непосредственно в головном мозге. В связи с этим для обозначения этих соединений был введен термин “нейростероиды”. ДГЭА и другие нейростероиды (такие как аллопрегненолон) оказывают влияние на ЦНС, модулируя функции рецепторов моноаминергических систем — ГАМК-, серотонин-, глутаматергической и др. [10, 39].
ДГЭА и его сульфат оказывают нейропротективное и стресспротективное действие на ЦНС, защищая ее от воздействия повышенной секреции кортизола. Показано, что при депрессии уровень ДГЭА-С в крови по крайней мере у части больных снижен [26, 27, 42].
Считается, что высокий уровень кортизола и низкий уровень ДГЭА-С являются неблагоприятным прогностиче- ским признаком прогноза терапевтической динамики. В наших предыдущих исследованиях было обнаружено, что соотношение кортизол/ДГЭА-С существенно снижается при рекуррентном депрессивном расстройстве в сравнении с первичным депрессивным эпизодом [26]. Это может говорить об истощении анаболических возможностей организма по мере увеличения длительности депрессии.
Âряде работ показано, что в случае успешной терапии депрессии соотношение кортизол/ДГЭА-С уменьшается, т.е. уровень ДГЭА-С возрастает, а уровень кортизола падает. Восстановление нормального функционирования гипотала- мо-гипофизарно-надпочечниковой системы может являться маркером стойкой ремиссии, в то время как неизменный уровень гормональных показателей указывает на нестойкость достигнутого клинического улучшения и целесообразность изменения терапевтической тактики [13, 15, 16,
24, 30].
В связи со сказанным большой интерес представляет препарат коаксил (тианептин), относящийся к группе трициклических антидепрессантов, действие которого связано со стимуляцией обратного захвата серотонина нейронами коры головного мозга и гиппокампа [8]. Показано, что коаксил оказывает выраженное антистрессорное действие [11, 30, 36]. Он
восстанавливает объем гиппокампа у животных, подвергнутых стрессу, и нормализует морфометрические показатели нервных структур [7, 15]. Но следует заметить, что в работах, посвященных антистрессорному эффекту коаксила, речь идет в основном о его влиянии на уровнь кортизола и АКТГ и практически нет данных о влиянии этого антидепрессанта на содержание анаболических гормонов.
Целью настоящей работы было изучение влияния коаксила на анаболическо-катаболический баланс у пациентов с депрессией.
Материал и методы
Обследовали 39 пациентов с диагнозами депрессивный эпизод легкой (рубрика по МКБ-10 F32.0) и средней (F32.1) степени, рекуррентное депрессивное расстройство, текущий эпизод легкой (F33.0) и средней (F33.1) степени. Все они проходили амбулаторное психиатрическое лечение в психотерапевтическом кабинете поликлиники ¹149 Москвы.
Основную группу составили 25 пациентов, лечившихся коаксилом, — 17 женщин (возраст 37±4,7 года)
è8 мужчин (32±3,3 года). Коаксил фирмы «Лаборатория Сервье»(Франция) назначали в средней дозе 37,5 мг в день в течение 4 нед.
Âгруппу сравнения вошли 14 больных — 9 женщин (36±4,1 года) и 5 мужчин (34±2,8 года), которые лечились сертралином1 в средней дозе 50 мг в сутки в течение 4 нед. Группы были сопоставимы по основным демографическим показателям, а также по длительности и тяжести заболевания.
Оценка выраженности и тяжести депрессии проводилась с использованием шкалы депрессии Гамильтона и шкалы тревоги Гамильтона (НАМ-D и НАМ-А).
Кровь для определения гормонов брали дважды
— перед началом терапии антидепрессантами (фон)
èíà 3—4-й неделе приема антидепрессантов. Уровни гормонов (кортизола, ДГЭА-С и гормона роста) в сыворотке крови определяли иммуноферментным методом. Соотношение кортизол/ДГЭА выражали в относительных единицах. В качестве нормы использовали значения, полученные у 145 испытуемых без психических и эндокринных заболеваний.
Статистическую обработку данных проводили с применением программы Statistica 7.0. Использовали коэффициенты Манна—Уитни и Вилкоксона, а также коэффициент корреляции Спирмена.
Результаты
Средний фоновый (до лечения) уровень кортизола в крови у всех обследованных пациентов (как основной группы, так и группы сравнения) составил 489±214 нмоль/л, что достоверно выше нормальных значений (352±106 нмоль/л; р<0,05). Не было выявлено достоверной разницы между уровнем кортизола у мужчин и женщин (поэтому в дальнейшем при обработке результатов пол не учитывался). Но оценка индивидуальных значений показала, что у 21 (54%)
1 Сертралин (стимулотон) — антидепрессант из группы селективных ингибиторов обратного захвата серотонина.
48 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2006 |
больного уровень кортизола находился в пределах нормы (150—660 нмоль/л), у 4 (10%) — был снижен (140±31 нмоль/л), а у 14 (36%) — повышен (751±107 нмоль/л).
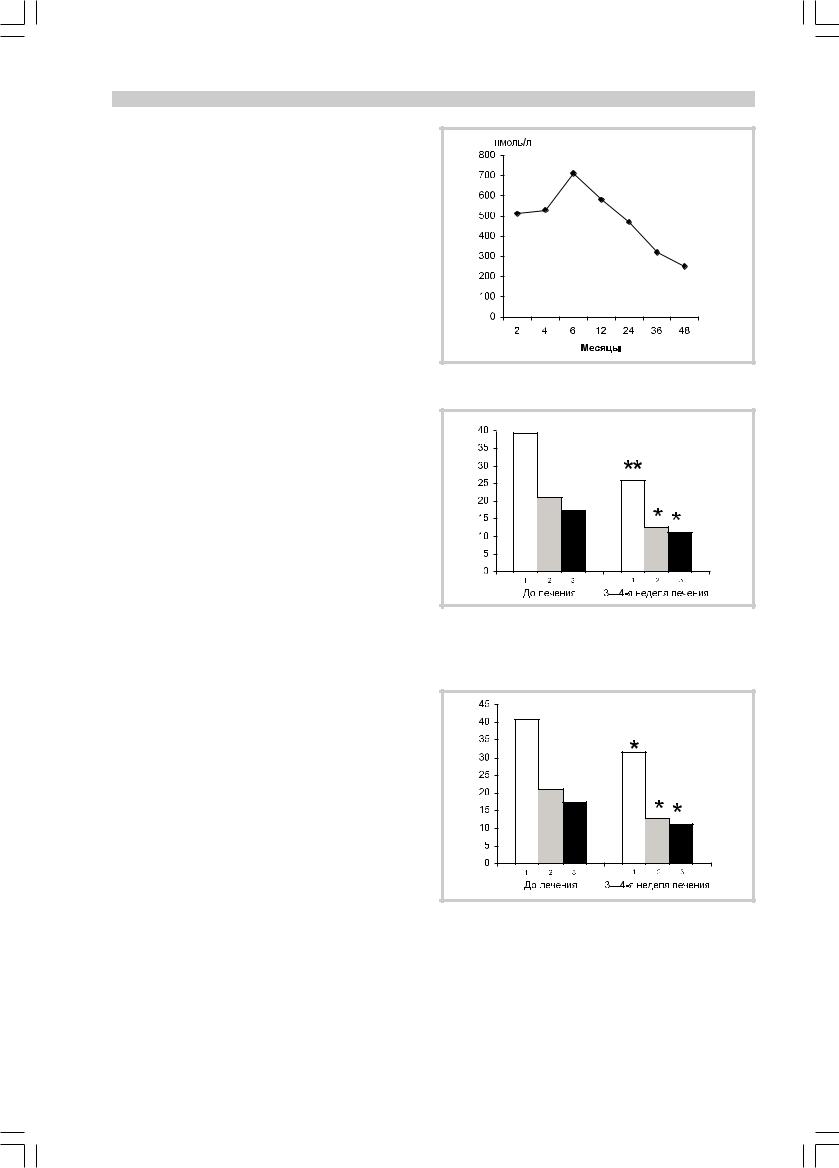
Кроме того, по результатам анализа уровня кортизола до терапии антидепрессантами была найдена слабая отрицательная корреляция между уровнем кортизола и длительностью заболевания (r=–0,37; р=0,008). У пациентов с небольшой длительностью депрессии (до 6 мес) фоновый уровень кортизола был максимальным. С увеличением длительности депрессии фоновый показатель снижался (рис. 1).
В основной группе пациентов, получавших коаксил, уровень кортизола до лечения составлял 484±37 нмоль/л, к 3—4-й неделе он снизился до 329±22 нмоль/л. В группе сравнения уровень кортизола к 3—4-й неделе снизился с 588±41 до 467±38 нмоль/л. Достоверных различий между группами выявлено не было.
Средний фоновый уровень ДГЭА-С во всей группе пацентов с депрессией составил 1,7±0,8 мкг/мл. У 11 (23%) пациентов он был значительно ниже (0,7±0,2 мкг/мл) нормы (2,5±0,9 мкг/мл; р<0,05). Была обнаружена отрицательная корреляция между уровнем ДГЭА-С и оценкой выраженности депрессии по шкале НАМ-D до лечения антидепрессантами (r=–0,47; р=0,037). Не было выявлено достоверных различий в фоновом уровне ДГЭА-С у пациентов с разной длительностью депрессии, хотя такая тенденция прослеживалась (возможно, это связано с недостаточностью выборки).
Не установлено и значимых различий в уровне ДГЭА-С между пациентами основной группы и группы сравнения. Но в группе получавших коаксил отме- чено достоверное повышение уровня ДГЭА-С у тех пациентов (п=6), у которых он был снижен (0,85±0,1 мкг/мл до терапии, 1,7±0,3 мкг/мл на 3—4-й неделе терапии; р=0,04). У пациентов с низким уровнем ДГЭА- С, получавших сертралин (п=5), к 3—4-й неделе не наблюдалось его существенного повышения.
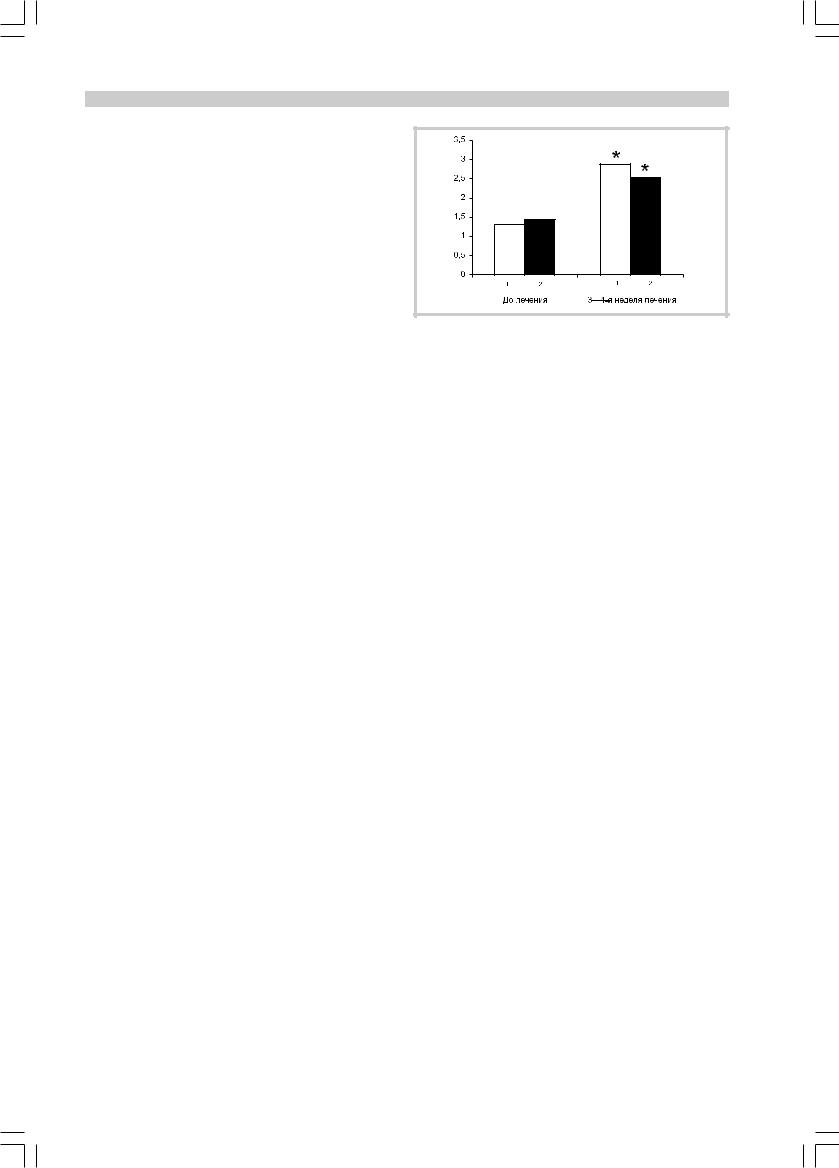
Соотношение кортизол/ДГЭА-С (рис. 2) после лечения коаксилом достоверно снизилось к 3—4-й неделе лечения (258±32) по сравнению с начальным значением (394±27; р=0,002). Эти изменения сопровождались изменениями клинической симптоматики: выраженность депрессивной симптоматики до терапии составляла 20,8±1,8 балла по НАМ-D, к 3—4-й неделе — 12,6±1,2 балла (р=0,03). Выраженность тревоги до терапии составляла 18,8±1,3 балла по НАМ- А, к 3—4-й неделе терапии тревога снизилась до 11,2±0,9 балла (р=0,03). Ввиду малочисленности выборки здесь приведены усредненные данные без уче- та реакции больных на терапию, т.е. без выделения подгрупп респондеров и нонреспондеров.
После терапии сертралином (рис. 3) также наблюдалось достоверное снижение соотношения кортизол/ ДГЭА-С: до терапии 419±21, на 3—4-й неделе терапии 339±25 (р=0,04). Выраженность депрессивной симптоматики в данной группе до терапии составила 21,7±0,8 балла по НАМ-D, на 3—4-й неделе терапии
— 13,4±1,1 балла (р=0,03). Тревога снизилась по НАМ- А с 18,8±1,6 до 12,8±1,0 балла (р=0,04).
Интересен тот факт, что, несмотря на отсутствие статистически значимых различий между препарата-
БИОХИМИЯ ДЕПРЕССИИ
Рис. 1. Фоновые значения кортизола у пациентов с разной длительностью депрессии.
Рис. 2. Изменение соотношения кортизол/ДГЭА-С и клиниче- ской симптоматики на фоне терапии коаксилом.
Здесь и на рис. 3: 1 — соотношение кортизол/ДГЭА-С, усл. ед/10; 2 — баллы по НАМ-D; 3 — баллы по НАМ-А. * — р<0,05; ** — р<0,01.
Рис. 3. Изменение соотношения кортизол/ДГЭА-С и клиниче- ской симптоматики на фоне терапии сертралином.
* — ð<0,05.
ми в действии на клиническую симптоматику, снижение соотношения кортизол/ДГЭА-С к 3—4-й неделе терапии значительно более выражено при применении коаксила по сравнению с терапией сертралином (соответственно 258±32 и 339±25; р=0,003). При
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2006 |
49 |
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
этом уменьшение значения кортизол/ДГЭА-С у пациентов, получавших коаксил, было связано не столько со снижением уровня кортизола, сколько с повышением уровня ДГЭА-С.
Уровень гормона роста (рис. 4) к 4-й неделе терапии достоверно увеличился как у получавших коаксил (2,88±0,83 нг/мл), так и у получавших сертралин (2,54±0,6 нг/мл) по сравнению со значением до терапии (соответственно 1,31±0,2 и 1,44±0,35 нг/мл; р=0,03). Различия между группами коаксила и сертралина по изменению уровня гормона роста были статистически незначимы.
Обсуждение
Полученные нами данные согласуются с широко обсуждаемой в последнее время в зарубежной биологической психиатрии концепцией аллостаза (allostasis) [28, 39]. Аллостаз — понятие, в чем-то противоположное гомеостазу. Если гомеостаз — это поддержание внутренней целостности организма и стабильного метаболизма, то аллостаз — это состояние готовности к изменениям, т.е. к стрессовому ответу (стабильность через изменения). Это состояние во многом поддерживается с помощью изменения активности гипоталамо-гипофизарно-надпочечниковой системы. При слишком длительном пребывании организма в готовности к стрессу или под воздействием длительного стрессового фактора происходит так называемая аллостатическая нагрузка или перегрузка (allostatic load). В таком состоянии происходит нарушение анаболического баланса: катаболические процессы, индуцируемые стрессовыми гормонами, начинают преобладать над анаболическими и вследствие этого происходит истощение резервов организма. Многие нейробиологические процессы, происходящие при депрессии, могут быть объяснены с точки зрения концепции “аллостатической перегрузки”.
Наше исследование показывает, что у части пациентов с депрессией наблюдается картина, типич- ная для состояния аллостатической перегрузки: высокий уровень кортизола, низкий уровень анаболи- ческих гормонов ДГЭА-С и гормона роста. Понятие аллостатической перегрузки очень близко понятию “стадии истощения” генерализованного адаптационного синдрома по Селье. Но в отличие от стрессовой реакции состояние аллостаза — скорее есть состояние готовности к этой реакции.
Важно, что у пациентов с небольшой длительностью депрессии уровень кортизола резко превышает нормальные значения, снижаясь с повторными эпизодами. Снижение уровня кортизола по мере увеличе- ния длительности депрессии подтверждает предположение, что повторяющиеся эпизоды депрессии вызывают истощение адаптационных возможностей организма. Это интересно еще и в том отношении, что в большинстве современных работ значимое внимание уделяется последствиям повышенного уровня кортизола при депрессии, но практически нет исследований, которые рассматривали бы влияние недостаточ- ности кортизола на депрессивную симптоматику.
Уровень гормона роста и соматомединов является одним из показателей анаболического баланса. В
Рис. 4. Изменение уровня гормона роста в процессе терапии антидепрессантами.
1 — коаксил; 2 — сертралин. * — р<0,05.
нашем исследовании показано, что в процессе лече- ния антидепрессантами уровень гормона роста зна- чительно увеличивается.
Важно, что антидепрессанты оказывают существенное влияние не только на нейромедиаторные системы, но и на нейроэндокринную систему, а также на содержание нейростероидов. Это влияние может реализоваться как через моноаминергические системы, так, возможно, и через непосредственное воздействие на гипоталамо-гипофизарно-надпочечнико- вую систему.
Возникает вопрос: каким образом коаксил оказывает влияние на симптомы депрессии и на ее нейробиологические механизмы? Как уже говорилось выше, было установлено стресспротективное действие этого препарата [15, 30, 36]. Известно, что серотонинергическая система оказывает стимулирующее влияние на гипоталамо-гипофизарно-надпочечнико- вую систему, увеличивая выброс кортиколиберина и соответственно АКТГ и кортизола [10]. Коаксил, уменьшая количество серотонина за счет стимуляции его обратного захвата, может частично блокировать указанную стимуляцию, ослабляя интенсивность как стрессового ответа, так и фоновой повышенной активности гипоталамо-гипофизарно-надпочечниковой оси. Можно с осторожностью предположить, что, снижая ее активность, коаксил через некоторое время парадоксальным образом может повышать активность серотонинергической системы, подавляемой высокими концентрациями кортизола. Кроме того, в ряде работ показано, что вещества, уменьшающие концентрацию серотонина в синаптической щели, оказывают сильное влияние на циркадный ритм АКТГ и кортизола [10]. Возможно, это еще один путь воздействия коаксила на депрессивную симптоматику.
Мы предполагаем, что нейропротективное действие коаксила во многом может объясняться его воздействием не только на гипоталамо-гипофизарно-над- почечниковую систему, но и на уровень нейростероидов, таких как ДГЭА и аллопрегненолон. Однако на настоящий момент неясно, каким образом коаксил, как, впрочем, и другие антидепрессанты, оказывают влияние на уровень нейростероидов.
Соотношение кортизол/ДГЭА-С является более чувствительным параметром, чем отдельная оценка
50 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2006 |

уровня кортизола и ДГЭА-С. В последнее время становится очевидным, что нормальный уровень кортизола у 70% пациентов с депрессией не означает отсутствия нарушений гипоталамо-гипофизарно-надпочеч- никовой системы. Важно отметить тот факт, что редукция депрессивной симптоматики не коррелирует с изменением соотношения кортизол/ДГЭА-С непосредственно. Это скорее фактор прогноза стабильности ремиссии. Если при выписке больного патологическое соотношение кортизол/ДГЭА-С или другие показатели активности гипоталамо-гипофизарно-надпочечни-
ковой системы не меняются, это может быть серьезным аргументом в пользу нестабильности достигнутой ремиссии. Но прогностическая роль соотношения кортизол/ДГЭА-С требует дальнейшего анализа.
Изучение вклада гипоталамо-гипофизарно-надпо- чечниковой системы в патогенез депрессии способствовало созданию препаратов антидепрессивного спектра, непосредственно влияющих на ее различ- ные звенья [25, 31, 40, 41], что открывает новые возможности изучения рассмотренной в настоящей статье проблемы.
ЛИТЕРАТУРА
1.Белкин А.И. Биологическая терапия психических заболеваний. Кишинев: Штиница 1983.
2.Бельтикова К.В., Кочетков Я.А. Особенности клинико-гормо- нальных взаимодействий при депрессивных расстройствах. В кн.: Современные проблемы психиатрической эндокринологии. М 2004.
3.Изнак А.Ф. Нейрональная пластичность и терапия аффективных расстройств. Журн психиат и психофармакотер 2003; 5: 187— 190.
4.Кочетков Я.А. Депрессия и гипоталамо-гипофизарно-надпочеч- никовая система: новые стратегии изучения. В кн.: Современные проблемы психиатрической эндокринологии. М 2004.
5.Коханенко Э.М., Краснов В.Н. Нейроэндокринная дисфункция при депрессиях. В кн.: Клиническая психоэндокринология: Сборник научных трудов МНИИ психиатрии. М 1985.
6.Краснов В.Н. Клинико-патогенетические закономерности динамики циркулярных депрессий: Дис. ...…д-ра мед. наук. М 1987.
7.Морозов П.В. Клинические эффекты коаксила и нейропластич- ность. Журн психиат и психофармакотер 2005; 2: 7: 79—84.
8.Мосолов С. Н. Основы психофармакотерапии. М 1996.
9.Нуллер Ю.Л., Михаленко И.Н. Аффективные психозы. Л: Медицина 1988.
10.Сапронов Н.С. Фармакология гипофизарно-надпочечниковой системы. Ст-Петербург 1998.
11.Узбеков М.Г. Структурно-функциональные подходы к пониманию нейрохимических механизмов действия психотропных препаратов: серотонинергические антидепрессанты. Соц и клин психиат 2004; 2: 52—58.
12.Шаляпина В.Г. Кортиколиберин в регуляции приспособительного поведения и патогенезе постстрессорной психопатологии. Основы нейроэндокринологии. Под ред. В.Г. Шабановой и П.Д. Шабанова. Ст-Петербург 2005; 84—147.
13.Barden N., Reul J.M.H.M., Holsboer F. Do antidepressants stabilize mood through actions on the hypothalamic-pituitary-adrenal system? Trend Pharmacol Sci 1995; 18: 6—11.
14.Bondy B. Pathophisiology of depression and mechanisms of treatment. Dialogues in clinical neuroscience 2002; 4: 1: 7—21.
15.Delbende C., Contesse V., Mocaer E. et al. The novel antidepressant, tianeptine, reduces stress-evoked stimulation of the hypothalamo- pituitary-adrenal axis. Eur J Pharmacol 1991; 202: 3: 391—396.
16.Dinan T.G. Glucocorticoids and the genesis of depressive illness: A psychological model. Br J Psychiat 1994; 164: 365—371.
17.Dinan T.G. Psychoneuroendocrinology of mood disorders.
18.Duman R.S. Neural plasticity: consequences of stress and actions of antidepressant treatment. Dialogues in clinical neuroscience 2004; 6: 2: 157—171.
19.Halbreich U., Asnis G.M., Shindledecker R. Cortisol secretion in endogenous depression. Arch Gen Psychiat 1985; 42: 904—908.
20.Harris T.O., Borsanyi S., Messary S. et al. Morning cortisol as a risk factor for subsequent major depressive disorder in adult women. Br J Psychiat 2000; 177: 505—510.
21.Hatzinger M. Neuropeptides and the Hypothalamic-Pituitary-Adren- ocortical (HPA) System: review of recent research strategies in depression. Wrld J Biol Psychiat 2000; 1: 105—111.
22.Heuser I., Yassouridis A., Holsboer F. The combined dexamethasone/ CRH test: A refined laboratory test for psychiatric disorders. J Psychiat Res 1994; 28: 341—356.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2006
23.Holsboer F., von Bardeleben U., Gerken A. et al. Blunted corticotropin and normal cortisol response to human corticotropin-releasing factor in depression. N Engl J Med 1884; 311: 1127.
24.Holsboer F., Barden N. Antidepressants and HPA regulation. Endocrine Rev 1996; 1: 7: 187—205.
25.Holsboer F. The rationale for corticotropin-releasing hormone receptor (CRH-R) antagonists to treat depression and anxiety. J Psychiat Res 1999; 33: 181—214.
26.Kochetkov Y.A., Beltikova K.B., Gorobets L.N. Serum DHEA-S and cortisol levels in patients with different types of depression. Materials of XIII World Congress of Psychiatry, Cairo. 2005; 626.
27.Kochetkov Y.A., Beltikova K.B., Gorobets L.N. Alteration of DHEA-S level during the tianeptine treatment. Materials of AEP congress. Munich 2005.
28.McEwen B.S. Allostasis and allostatic load: implications for neuropsychopharmacology. Neuropsychopharmacology 2000; 22: 2: 108-124.
29.McEwen B.S. Structural plasticity of the adult brain: how animal models help us understand brain changes in depression and systemic disorders related to depression. Dialogues in clinical neuroscience 2004; 6: 2: 119—135.
30.McEwen B.S., Olie J.P. Neurobiology of mood, anxiety, and emotions as revealed by studies of a unique antidepressant: tianeptine. Molecular Psychiat 2005; 1—13.
31.McQuade R., Young A.H.Y. Future therapeutic targets in mood disorders: the glucocorticoid receptor. Br J Psychiat 2000; 177: 390—395.
32.Modell S., Yassouridis A., Huber J., Holsboer F. Corticosteroid receptor function is decreased in depressed patients. Neuroendocrinology 1997; 65: 216—222.
33.Modell S., Lauer C., Schreiber W. et al. Hormonal response pattern in the combined DEX-CRH test is stable over time in subjects at high familial risk for affective disorders. Neuropsychopharmacology 1998; 18: 252—262.
34.Nemeroff C.B., Widerlov E., Bissette G. et al. Elevated concentrations of CSF corticotropin-releasing factor-like immunoreactivity in depressed patients. Science 1984; 226: 1: 342—1344.
35.Nemeroff C.B., Krishnan K.R.R., Reed D. et al. Adrenal gland enlargement in major depression. Arch Gen Psychiat 1992; 49: 384—387.
36.Nickel T., Sonntag A., Schill J. et al. Clinical and neurobiological effects of tianeptine and paroxetine in major depression. J Clin Psychopharmacol 2003; 23: 2: 155—168.
37.Reul J.M.H.M., Holsboer F. On the role of corticotropin-releasing hormone receptors in anxiety and depression. Dialogues in clinical neuroscience 2002; 4: 1: 7—21.
38.Ritsner M., Maayan R., Gibel A. et al. Elevation of the cortisol/dehydroepiandrosterone ratio in schizophrenia patients. Eur Neuropsychopharmacol 2004; 14: 4: 267—273.
39.Wolkowitz O.M., Epel E.S., Reus V.I. Stress hormone-related psychopathology: pathophysiological and treatment implications. Wrld J Biol Psychiat 2001; 2: 115—143.
40.Wolkowitz O.M., Reus V.I., Keebler A. et al. Double-blind treatment of major depression with dehydroepiandrosterone. Am J Psychiat 1999; 1: 56: 646—649.
41.Wolkowitz O.M., Reus V.I. Treatment of depression with antiglucocorticoid drugs. Psychosomatic Medicine 1999; 61: 698—711.
42.Young A.H, Gallagher P., Porter R.J. Elevation of the cortisol-dehy- droepiandrosterone ratio in drug-free depressed patients. Am J Psychiat 2002; 159: 1237—1239.
Поступила 07.07.06
51
