
Журнал неврологии и психиатрии / 2004 / NEV_2004_04_09
.pdf
Врожденный миастенический синдром, связанный с гомозиготной точковой мутацией в промоторном регионе г ена ε-субъединицы рецептора ацетилхолина
Н.И. ЩЕРБАКОВА, О.П. СИДОРОВА, Е.Ю. МЕНЕНКОВА, Г.М. ГАЛИМОВА, Ю.В. К ОНОНЕНКО, А.Г. САНАДЗЕ, В.Я. НЕРЕТИН
Congenital myasthenic syndrome related to homozygous missense mutation in promoter region of acetylcholine receptor epsilon-subunit gene
N.I. SHCHERBAKOVA, O.P. SIDOROVA, E.Yu. MENENKOVA, G.M. GALIMOVA, Yu.V. KONONENKO, A.G. SANADZE, V.Ya. NERETIN
Центр нервно-мышечной патологии человека Института общей патологии и патофизиологии РАМН, неврологическое отделение Московского областного научно-исследовательского клини ческого института им. М.Ф. Владимирского, Москва
Врожденные миастенические синдромы (ВМС)
— группа наследственных нервно-мышечных заболеваний, обусловленных нарушением проведения возбуждения с нерва на мышцу. Заболевания обусловлены генетическим дефектом белков, экспрессированных в нервно-мышечных синапсах. В зависимости от места поражения синапса ВМС делят на пресинапти- ческие, синаптические и постсинаптические [5]. Большинство ВМС являются постсинаптическими, в основе их молекулярно-генетического дефекта лежат мутации генов различных субъединиц ацетилхолиновых рецепторов — α, β, δ, ε [6]. В большинстве случа- ев эти мутации приводят к уменьшению числа функционирующих ацетилхолиновых рецепторов (АХР), другие мутации обусловливают кинетические аномалии рецепторных каналов [2, 4, 7, 8, 10]. Недавно выявлены мутации генов, кодирующих рапсин и другие белки, экспрессированные в постсинаптической мембране у больных с ВМС [14]. Клинические симптомы постсинаптических ВМС сходны с симптомами аутоиммунной миастении. Примером является приведенный нами клинический случай.
Больная Т., 41 года, обратилась с жалобами на опущение век, затруднения при глотании твердой пищи, слабость и утомляемость мышц шеи и проксимальных отделов конечностей. Считает себя больной с раннего детства: всегда была вялым ребенком, плохо ходила, быстро уставала. В возрасте 11 лет появилось опущение век, некоторое затруднение при глотании и жевании твердой пищи, увеличилась слабость в проксимальных отделах рук и ног. Течение заболевания стационарное, непрогрессирующее. Первоначально прозериновая проба была положительной, со временем при введении прозерина стала отмечаться более избирател ь- ная реакция в отдельных мышечных группах. Больная имеет дочь 12 лет, клинически здоровую.
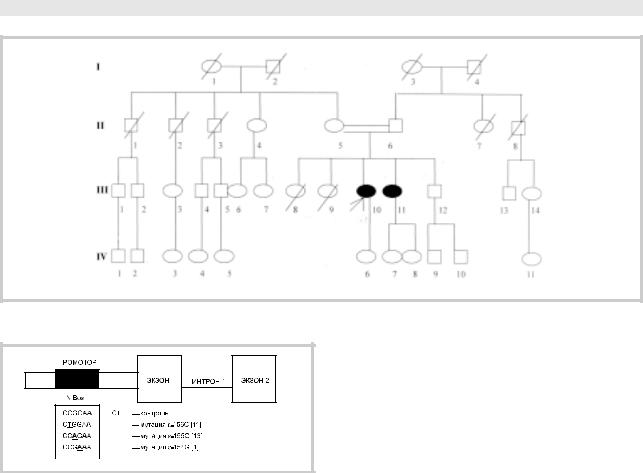
Из семейного анамнеза: родители больной являются кровными родственниками — троюродные брат и сестра (рис. 1, II—5—6). Больная (III — 10) от четвертой беременности. Две ее сестры (III — 8—9) умерли в раннем детстве от интеркуррентных инфекций в возрасте 1,5 мес (ребенок от пер-
© Коллектив авторов, 2004
вой беременности) и 2 лет (ребенок от третьей беременности — отмечались кожные аллергические реакции). Брат — ребенок от пятой беременности (III — 12), в настоящее время 39 лет, здоров. Сестра (ребенок от второй беременности), в настоящее время 47 лет, с детства имеет аналогичное заболевание (III — 11). При осмотре у нее отмечаются тяжелые бульбарные нарушения (поперхивание, гнусавость), генерализованная мышечная слабость, существенно ограничи- вающая двигательные возможности (с трудом передвигается в пределах комнаты), принимает по 8—9 таблеток калимина в сутки.
Объективно в неврологическом статусе при осмотре че- рез 6 ч после отмены калимина: зрачки симметричные, равномерные, фотореакция на свет сохранена. Отмечаются двусторонний симметричный птоз до верхнего края зрачка, не нарастающий при фиксации взора, слабость конвергенции, офтальмопарез с симметричным ограничением движений обоих глазных яблок кнаружи и вверх на 2 мм без диплопии, снижение силы мимической мускулатуры до 2 баллов. Голос глухой, тихий, без признаков утомления речи при разговоре. Мягкое небо подвижно. Умеренная слабость жевательных мышц. Сила передней группы мышц шеи снижена до 3 баллов. При исследовании силы мышц конечностей выявлена выраженная слабость в проксимальных: дельтовидной (1 балл), трехглавой и двуглавой мышцах плеча (2 балла), сгибателях кистей (3 балла), подвздошно-поясничной (2 балла). Сила мышц-разгибателей пальцев рук 4 балла, остальных мышечных групп — 5 баллов. Не выявлено слабости дыхательных мышц. Синдром патологической мышечной утомляемости отсутствует (после 10 приседаний объективного снижения мышечной силы не отмечено). Прозериновая проба положительная с частичной компенсацией отдельных мышц (в m. deltoideus cила с 1 балла увеличивается до 4 баллов, а в m. triceps — с 2 до 3 баллов). В сыворотке крови антител к рецепторам ацетилхолина не выявлено.
При электромиографическом исследовании состояния нервно-мышечной передачи во всех обследованных мышцах регистрировалась правильная — двухфазная форма М-отве- та, дополнительных повторных ответов не выявлялось. Была нормальной амплитуда негативной фазы М-ответа на одиночный супрамаксимальный стимул (1,5 мВ в m. orbicularis oculi, 4,9 мВ в m. deltoideus, 12,5 мВ в m. triceps brachii и 15,8 мВ в m. abd. dig. minimi). Во всех исследованных мышцах обнаруживались примерно одинаковые значения декремента амплитуды М-ответа при частоте стимуляции 3 Гц: в m. orbicularis oculi 22%, в m. deltoideus до 25%, в m. triceps brachii и
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2004 |
55 |
НАБЛЮДЕНИЯ ИЗ ПРАКТИКИ
Ðèñ. |
1. Родословная семьи Т. Объяснение в тексте. |
|
Ðèñ. |
2. Секвенирование промоторного региона гена |
ÀÕÐ-ε |
у больной Т. |
|
|
m. abd. dig. minimi до 20%. При проведении тетатической стимуляции (200 импульсов частотой 40 Гц) в дистальной мышце руки (m. abd. dig. minimi) отмечено прогрессирующее снижение амплитуды и площади М-ответа примерно на 70% от исходной. Процент постактивационного облегчения в разных мышцах колебался от 103 до 115. В этот период декремент амплитуды М-ответа отсутствовал. При стимуляции в период постактивационного истощения усугубления нарушений нервно-мышечной передачи по сравнению с исследованием до нагрузки не отмечалось. Введение прозерина в разной степени изменяло мышечную силу исследуемых мышц. Так, в 2 из 4 мышц — m. orbicularis oculi и m. deltoideus сила увеличилась на 1 балл, тогда как в m. abd. dig. minimi прирост силы составил 2 балла. Амплитуда М-ответа увеличи- лась главным образом в мышце с исходно более низким ее значением по сравнению с другими мышцами — m. deltoideus — 124%, в остальных мышцах амплитуда либо не менялась (m. triceps brachii, m. orbicularis oculi), либо увеличилась незначительно (m. abd. dig. minimi — 102%). Выявленное неравномерное изменение силы на фоне введения прозерина отчетливо коррелировало с динамикой декремента при разных частотах стимуляции.
При исследовании параметров потенциалов двигательных единиц (ПДЕ) отмечалось неравномерное уменьшение их средней длительности: в клинически пораженной m. deltoideus dex. на 40%, в m. tibialis anterior dex. на 25%, а в клинически интактной m. vastus lateralis dex, они находились в пределах нормы. При этом средняя амплитуда ПДЕ была повышена во всех мышцах, но более выраженно в m. vastus lateralis dec. Единичная спонтанная активность в виде потенциалов фасцикуляций (до 8) выявлялась только в мышцах ног. Выраженная полифазия (до 45%) отмечалась во всех обследованных мышцах.
Молекулярно-генетический анализ был проведен с использованием геномной ДНК больной. Все 12 экзонов, прилегающие к ним интронные области и промоторная область гена субъединицы ε ацетилхолинового рецептора (АХР-ε) были амплифицированы с помощью полимеразной цепной реакции [1]. Секвенирование выполнено прямо с использованием продуктов этой реакции. Секвенирование промоторной области гена АХР-ε показало, что больная гомозиготна в отношении точковой мутации гена с заменой гуанина на аденин (G→A) в положении нуклеотида 155: ε-155G→A (рис. 2). Для исключения дополнительных мутаций у больной провели секвенирование всей кодирующей области АХР-ε. Других мутаций выявлено не было. Мутация ε-155G→A и другие N-box мутации промоторной области АХР-ε были описаны ранее как патологические, обусловливающие врожденные миастенические синдромы [1, 11, 13].
Описанный нами случай показывает, насколько точной клинической фенокопией аутоиммунной миастении может являться врожденный нервно-мышеч- ный дефект. Возникает вопрос, возможно ли было бы только на основании клинической картины заболевания и рутинного электромиографического обследования выявить особенности, позволяющие отличить данный случай от какого-то варианта аутоиммунной миастении. По ряду клинических и электромиографических проявлений наша больная ничем не отли- чалась от больных аутоиммунной миастенией характером распределения двигательных расстройств с вовлечением экстраокулярной, мимической, бульбарной и туловищной мускулатуры, отсутствием повторного М-ответа на одиночный супрамаксимальный стимул, декрементом на низкую и высокочастотную стимуляцию, положительной реакцией на антихолинэстеразные препараты. Вместе с тем имелись и особенности: семейный анамнез, раннее начало заболевания, отсутствие ремиссий в анамнезе, симметрич- ный птоз и равномерное ограничение объема движений глазных яблок во все стороны, отсутствие диплопии. При этом характер глазодвигательного синдрома практически не менялся в течение всей жизни. Кроме того, отсутствовали динамичность птоза и синдром патологической утомляемости. При электромиографии выявлялись равномерный декремент во всех
56 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2004 |

ГЕНЕТИКА МИАСТЕНИИ
мышцах, отсутствие выраженных феноменов постактивационного облегчения и истощения, существенное снижение средней длительности ПДЕ и наличие полифазных потенциалов. Обращало на себя внимание также несоответствие степени снижения мышеч- ной силы и выраженности нарушений нервно-мышеч- ной передачи: снижение силы было значительно бульшим величины декремента. В свою очередь снижение средней длительности ПДЕ было гораздо бульшим декремента при ритмической стимуляции и она соответствовала клинической силе мышцы. Представляют интерес и избирательная реакция на электромиографию, отсутствие антител к АХР и выявленная мутация промоторного региона гена АХР-ε, которые подтвердили врожденный характер поражения.
При ВМС выявлены многочисленные мутации в кодирующих генах различных субъединиц «взрослых» АХР. У большинства больных определены мутации гена ε-субъединицы АХР [3, 9, 12]. Можно предположить, что экспрессия этой субъединицы может компенсироваться фетальной γ-субъединицей. Большинство описанных в литературе мутаций локализуется в кодирующих областях генов АХР. В противоположность этому мутации в промоторной области — ε-cубъеди- ницах АХР идентифицированы только в нескольких семьях с ВМС. Все три описанные в литературе мута-
ции промоторной области локализуются в сохраняемом регуляторном элементе N-box, который отвечает за экспрессию синаптических генов.
В заключение следует отметить, что клиническая картина с началом заболевания в раннем детстве и наличие аналогичных симптомов болезни у сестры указывают на ВМС. Электрофизиологические данные имеют ограниченное значение для дифференциальной диагностики ВМС и аутоиммунной миастении. Однако иммунологическое исследование, в котором показано отсутствие антител к АХР, и генетический анализ ε-АХР, при котором обнаружена мутация, приводящая к развитию заболевания, подтверждают диагноз ВМС. Иммунологические и генетические исследования, проводимые в дополнение к клиниче- скому и электрофизиологическому методам диагностики заболеваний с нарушением нервно-мышечной передачи, могут способствовать существенному прогрессу в диагностике и лечении больных миастенией и избежать назначения пациентам с ВМС любых схем иммуносупрессивной терапии, применяемых у больных с аутоиммунной миастенией.
Авторы благодарят H. Lochmuller и A. Abicht (Мюнхенский университет Людвига-Максимилиана — Ludwig-Maximi- lian-Universitat, Mьnchen) за проведение молекулярно-генети- ческого анализа нашей больной.
ЛИТЕРАТУРА
1.Abicht A., Stucka R., Scmidt C. et al. A new identified chromosomal microdeletion and an N-box mutation of the AchR epsilon gene a congenital myasthenic syndrome. Brain 2002;125: 1005—1013.
2.Engel A.G., Lambert E.H., Mulder D.M. et al. A newly recognized congenital myasthenic syndrome attributed to a prolonged open time of the acetylcholine-induced ion channel. Ann Neurol 1982; 11: 553—569.
3.Engel A.G., Ohno K., Bouzat C. et al. End-plate acetylcholine receptor deficiency due to nonsence mutation in the ε subunit. Ann Neurol 1996; 40: 810—817.
4.Engel A.G., Ohno K., Milone M. et al. New mutations in acetylcholine receptor subunit genes reveal heterogeneity in slow-channel congenital myasthenic syndrome. Hum Mol Genet 1996; 5: 1217—1227.
5.Engel A.G., Ohno K., Sine S.M. Congenital myasthenic syndromes. In: Engel A.G. (eds). Myasthenia gravis and myasthenic disorders. New York: Oxford University Press 1999; 251—297.
6.Engel A.G., Ohno K., Sine S.M. Congenital myasthenic syndromes: Progress over the past decade. Muscle Nerve 2003; 27: 4—25.
7.Gomez C.M., Maselli R., Gammack J. et al. A betasubunit mutation in the acetylcholine receptor gate causes severe slow-channel syndrome. Ann Neurol 1996; 39: 712—723.
8.Kaminski H.J., Ruff R.L. Insights into possible skeletal muscle nicotinic acetylcholine receptor (AChR) changes in some congenital
myasthenias from physiological studies, point mutations, and subunit substitutions of the AChR. Ann N Y Acad Sci 1993; 681: 435— 450.
9.Krawczak M., Cooper D.N. Gene deletions causing human genetic disease: mechanisms of mutagenesis and role of the local DNA sequence environment. Hum Genet 1991; 86: 425—441.
10.Milone M., Wang H.-L., Ohno K. et al. Slow-channel syndrome caused by enhanced activation, desensitization, and agonist binding affinity due to mutation in the M2 domain of the acetylcholine receptor alpha subunit. J Neurosci 1997; 17: 5651—5665.
11.Nichols P., Croxen R., Vincent A. et al. Mutation of the acetylcholine receptor epsilon-subunit promoter in congenital myasthenic syndrome. Ann Neurol 1999; 45: 439—443.
12.Ohno K., Wang H.-L., Milone M. et al. Congenital myasthenic syndrome caused by decreased agonist binding affinity due to a mutation in the acetylcholine receptor ε subunit. Neuron 1996; 17: 157— 170.
13.Ohno K., Anlar Â., Engel A.G. Congenital myasthenic syndrome caused by a mutation in the Ets-binding site of the promoter region of the acetylcholine receptor ε gene. Neuromusc Disord 1999; 9: 131—135.
14.Ohno K., Engel A.G., Shen X.M. et al. Rapsyn mutations in humans cause endplate acetylcholin4e-receptor deficiency and myasthenic syndrome. Am J Hum Genet 2002; 70: 875—885.
Поступила 04.04.03
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2004 |
57 |
