
Журнал неврологии и психиатрии / 2004 / NEV_2004_04_08
.pdf
НАБЛЮДЕНИЯ ИЗ ПРАКТИКИ
Случай лейкодистрофии Канавана—Ван Богарта—Бертранда
С.В. МИХАЙЛОВА, Е.Ю. ЗАХАРОВА, А.М. БУКИНА, Е.С. ИЛЬИНА, А.Я. ПОКРОВ СКАЯ, И.Д. ФЕДОНЮК, Р.Ц. БЕМБЕЕВА, А.С. ПЕТРУХИН
A case of Canavan—Van Bogaert—Bertrand leucodystrophy
S.V. MIKHAILOVA, E.Yu. ZAKHAROVA, A.M. BUKINA, E.S. ILYINA, A.Ya. POKROVSKAYA, I.D. FEDONYUK, R.Ts. BEMBEEVA, A.S. PETRUKHIN
Кафедра нервных болезней педиатрического факультета Ро ссийского государственного медицинского университета, Медикогенетический научный центр, Российская детская клиничес кая больница, Москва
Лейкодистрофии — довольно редкая группа на- следственно-дегенеративных заболеваний нервной системы, обусловленных дефектами различных белков, участвующих в формировании миелина. Термин «лейкодистрофия» был предложен Bielshowsky и Henneberg в 1928 г. [1, 3].
Âнастоящее время известно несколько форм лейкодистрофий, при которых первичный дефект установлен на биохимическом и/или молекулярно-гене- тическом уровне: метахроматическая лейкодистрофия, болезнь Краббе, болезнь Канавана (БК), Х-сцеплен- ная адренолейкодистрофия, болезнь Александера, болезнь Пелицеуса — Мерцбахера. Для ряда наследственных заболеваний из группы лейкодистрофий, первичный дефект пока не выявлен — это мегалэнцефалия и лейкодистрофия (болезнь Ван дер Кнаапа, или вакуолизирующая лейкодистрофия с субкортикальными кистами), синдром Коккейна, синдром Айкарди — Гутерини.
Âлитературе встречаются разные названия лейкодистрофии Канавана — Ван Богарта — Бертранда (МIM 271900): спонгиозная дегенерация мозга, инфантильная спонгиоформная дегенерация ЦНС, инфантильная спонгиозная дегенерация, аспартоацилазная недостаточность, N-ацетил- аспартиковая ацидурия [4, 29].
Первое клиническое описание основных клинических симптомов БК принадлежит Globus и Strauss (1928 г.) [29]. В 1931 г. Канаван сообщил о ребенке с прогрессирующим ростом головы, у которого при аутопсии была выявлена спонгиозная дегенерация белого вещества головного мозга; забол е- вание было определено как диффузный периаксиальный энцефалит Шильдера [29]. Позднее была выдвинута гипотеза о семейном характере заболевания [29]. В 1949 г. Ван Богарт и Бертранд определили спонгиозную дегенерацию мозга у 3 детей еврейской национальности. С тех пор описаны много- численные случаи этого заболевания [10, 15, 21, 28, 32].
Биохимический дефект при БК был идентифицирован R. Matalon и соавт. в 1988 г. [22]. Они обнаружили повышение уровня N-ацетиласпартата в моче и недостаточность аспартоацилазы в культуре клеток фибробластов у 3 пациентов с БК [22].
Â1993 г. клонирован ген аспартоацилазы (ASPA) и обнаружены мутации, приводящие к БК [20, 24].
Эпидемиология, этиология и генетика
БК наследуется по аутосомно-рецессивному типу. Частота заболевания в общей популяции не установлена ввиду
© Коллектив авторов, 2004
50
его редкости. Болезнь встречается во всех этнических груп - пах, но с наибольшей частотой среди евреев ашкенази (1 случай на 5000 новорожденных) [29].
Причиной БК являются мутации гена, кодирующего фермент аспартоацилазу. Ген картирован на 17-й хромосоме. В настоящее время в нем описано около 50 различных мутаций, в подавляющем большинстве точковые. По данным R. Matalon и соавт. [23], среди евреев ашкенази наиболее часто встречаются мутации Е285А (82,9% аллелей) и Y231X (14,8% аллелей). Среди европейцев нееврейского происхождения частой является мутация А305Е (60% аллелей) [5].
В России частота и спектр мутаций, определяющих развитие заболевания, не изучены, и сообщений о случаях БК в доступной литературе мы не нашли.
Биохимия и патогенез
БК, как уже говорилось, обусловлена недостаточностью фермента аспартоацилазы, что приводит к накоплению N- ацетиласпартата в мозге, спинномозговой жидкости, плазме крови и моче [22]. Аспартоацилаза катализирует расщепление N-ацетил-L-аспартата на L-аспартат и ацетат [4, 18, 19, 30].
N-Aцетиласпартат у человека был обнаружен в больших концентрациях только в клетках нервной ткани. Насколь - ко велика его концентрация, настолько мало известно о его роли в организме.
Согласно одной из гипотез, N-ацетиласпартат за счет высокой осмолярности представляет компонент «водного насоса» в головном мозге, а фермент аспартоацилаза участвует в гидролизе N-ацетиласпартата, регулируя содержание воды в межклеточном пространстве [18, 29].
Молекулярные механизмы патогенеза БК неясны, так как мало известно о функции N-ацетиласпартата. Остается также невыясненным, почему первые симптомы заболевания появляются в первые месяцы жизни, хотя повышение концентрации N-ацетиласпартата выявляется еще пренатально [29, 30].
На сегодняшний день достаточно ясно, что вряд ли основной причиной клинических симптомов заболевания является недостаточность продуктов блокированной реакции
— ведь существует много других источников и аспартата, и ацетата в мозге [4, 29]. Предполагается токсическое действие N-ацетиласпартата или его метаболитов на ткань мозга, что, по всей вероятности, приводит к возникновению хронического отека.
Основные патоморфологические находки локализуются в белом веществе, которые замещаются развитой сетью кистозных полостей. При морфологическом исследовании выявляется губчатая (спонгиозная) вакуолизация в нижних слоях серого вещества, в субкортикальных отделах белого вещества мозга и мозжечка. При электронной микроскопии выявляются вакуоли в «набухшей» цитоплазме и отростках
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2004

ЛЕЙКОДИСТРОФИЯ
протоплазматических астроцитов в коре, а также вакуолизация белого вещества и аномальные митохондрии в астроцитах [6, 7, 16].
Данные лабораторных и функциональных исследований
У пациентов с БК при КТ и МРТ головного мозга обнаруживают диффузную дегенерацию белого вещества с вовлечением в патологический процесс полушарий мозга, в меньшей степени поражаются мозжечок и ствол мозга [31]. В ранних стадиях патологического процесса при КТ и МРТ патология может не выявляться [11, 26]. Однако на начальных этапах БК при МРТ может определяться поражение белого вещества в перивентрикулярной области, которое часто расценивают как перивентрикулярную лейкомаляцию вследствие перинатального поражения ЦНС гипокcическиишемического генеза. По мере прогрессирования заболевания при МРТ отмечается диффузная дегенерация белого вещества в виде очагов повышенного сигнала в белом веществе в Т2-режиме [27].
Как показано в исследованиях K. Gripp и соавт. [14], отличие от других форм лейкодистрофий и демиелинизирующих заболеваний при магнитно-резонансной протонной спектроскопии у пациентов с БК отмечалось резкое повышение и уровня N-ацетиласпартата, и соотношения N-аце- тиласпартат/креатинин, что может служить важным критерием для верификации диагноза [9, 14]. При офтальмологи- ческом исследовании выявляют атрофию дисков зрительных нервов [27].
Определение концентрации N-ацетиласпартата в моче и измерение активности аспартоацилазы в культуре кожных фибробластов являются надежными биохимическими тестами при установлении диагноза БК [23]. Уровень N-ацетил- аспартата в моче, плазме, спинномозговой жидкости определяют хроматографическими методами, такими как хро- матомасс-спектрометрия и высокоэффективная жидкостная хроматография (ВЭЖХ).
Профилактика
Пренатальная диагностика БК в отягощенных семьях проводится путем определения концентрации N-ацетилас- партата в амниотической жидкости или методами ДНК-ана- лиза ворсин хориона, если генотип пробанда установлен [29].
В Российской детской клинической больнице (РДКБ) нами наблюдался пациент с БК в возрасте 5,5 лет. Было проведено тщательное клиническое обследование, включавшее клинический осмотр в динамике, клинические и биохимические анализы крови и мочи по стандартным методикам.
Из инструментальных методов использовали офтальмоскопию, ультразвуковое исследование внутренних органов. Неврологическое обследование проводилось с применением компьютерной электроэнцефалографии, КТ и МРТ головного мозга.
Спектр и концентрацию органических кислот в моче определяли методом ВЭЖХ [2, 23]. Для выявления распространенных мутаций в гене аспартоацилазы использовали стандартные методы полимеразной цепной реакции с последующим рестрикционным анализом и прямым нерадиоактивным секвенированием [23, 24, 30].
Приводим это наблюдение.
Больной Б., 5,5 лет. Наблюдается в РДКБ на протяжении 4 лет. Впервые поступил в возрасте 2 лет с жалобами на задержку психического и двигательного развития, снижение остроты зрения, генерализованные тонико-клонические судороги, увеличение окружности головы.
Из анамнеза: ребенок от молодых здоровых родителей (матери 22 года, отцу 23 года, русские), от первой беремен-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2004
ности, протекавшей физиологически. Роды в срок с родостимуляцией, масса тела при рождении 3950 г, длина 54 см, окружность головы 36 см (98 центилей).
С рождения отмечались беспокойство, нарушение сна, частые срыгивания, симптом Грефе, напряжение и пульсация большого родничка, мышечный гипертонус, преимущественно в дистальных отделах конечностей. Проводилась дегидратирующая, седативная терапия.
К 3-му месяцу жизни ребенок самостоятельно не удерживал голову, непостоянно прослеживал глазами за предметами, отмечались крупноразмашистый спонтанный и провоцируемый тремор, усиление всех безусловных рефлексов.
Â4 мec: окружность головы 47 см (99,6 центили), практически полное отсутствие эфферентных реакций, малоэмоциональность, вялость зрачковых реакций, снижение слуха, псевдобульбарный синдром, патологические синкинезии, «стартл-рефлексы» и отсутствие формирования выпрямляющих установочных реакций.
Â5 мес находился на стационарном лечении с диагнозом: последствия перинатального поражения ЦНС, спасти- ческий тетрапарез, субкомпенсированная гидроцефалия. Задержка психического и физического развития, нейросенсорная тугоухость справа II степени. Частичная атрофия зри - тельных нервов. Функциональная кардиопатия (открытое овальное окно, дополнительная трабекула в полости левого желудочка).
Â8 мес по сравнению с предыдущими осмотрами неврологический статус оставался прежним, однако отмеча- лось нарастание мышечного тонуса. В 1,5 года на фоне гипертермии впервые появились генерализованные тоникоклонические судороги. Ребенок неоднократно поступал в реанимационное отделение РДКБ по поводу нарастания дыхательной недостаточности центрального и инфекционного генеза, что сопровождалось ухудшением неврологиче- ского статуса: угнетение сознания до сопора, учащение судорог и эпизодов апноэ, нарастание мышечного тонуса до выраженного гипертонуса с последующим частичным восстановлением функций при купировании инфекционного процесса. За время наблюдения перенес деструктивную пнев - монию правого легкого, осложнившуюся абсцессом верхней доли. Проводилась курсами симптоматическая терапия (вазоактивная, ноотропная, антиэпилептическая, витамины группы В и др.) без явного положительного эффекта: сохранялись грубое нарушение психомоторного развития, редкие судороги, снижение зрения, тетрапарез спастиче- ского характера, псевдобульбарный паралич.
Данные объективного исследования
При поступлении в отделение в возрасте 5,5 лет: состояние тяжелое. Соматический статус: кожные покровы смуглые, с бронзовым оттенком, слизистые оболочки розовые. Дыхание жесткое, хрипов нет. Границы сердца соответствуют возрастной норме. На верхушке сердца во втором
— третьем межреберье слева выслушивается систолический шум. Живот мягкий, безболезненный, доступен глубокой пальпации. Печень и селезенка не увеличены. Дизурических явлений нет.
Неврологический статус: общемозговых и менингеальных симптомов нет. Форма головы — гидроцефальная с выраженными лобно-теменными буграми. Окружность головы 57 см, перкуторный звук коробочный. Большой родничок закрыт. Множественные стигмы дизэмбриогенеза: гипертелоризм, «карпий» рот, короткая уздечка языка, зубы Гет- чинсона, короткая шея, симптом двузубца на стопах. Че- репные нервы: глазные щели OD=OS, взор кратковременно фиксирует и прослеживает, зрачки OD=OS, фотореакция ослаблена, сглаженность правой носогубной складки, слух снижен, мелкоразмашистый нистагм, периодически с ротаторным компонентом, псевдобульбарный синдром.
Рефлекторно-двигательная сфера: двигательная активность резко снижена. Голову не держит, поворачивается на
51
НАБЛЮДЕНИЯ ИЗ ПРАКТИКИ
бок, не сидит, не ходит. Мышечная сила в конечностях снижена до 2—3 баллов. Мышечный тонус изменен: на фоне выраженного гипертонуса по спастическому типу периоди- чески отмечаются изменения по типу «зубчатого колеса», больше в руках. Сухожильные рефлексы высокие с расширением рефлексогенных зон, D>S. Патологические кистевые и стопные рефлексы. Дистонические атаки. Ярко выраженные «стартл-рефлексы»: неожиданный звук, прикосновение вызывают стереотипную двигательную реакцию — резкое вздрагивание.
Высшие когнитивные функции: грубое нарушение психического развития — мало интересуется окружающим, однако узнает мать, смеется, сохранен ритм сна и бодрствования, дает знать о мокрых пеленках. Речевое развитие: певуче е гуление с цепочками звуков, короткие лепетные звуки.
Данные дополнительных методов исследования
Ликворограмма: спинномозговая жидкость бесцветна, прозрачна, цитоз 1 мм3, белок 0,71 г/л.
Компьютерная ЭЭГ: грубые огранические изменения биоэлектрической активности, ирритативные общемозговые изменения биоэлектрической активности. Очаг грубой δ-вол- новой активности с проекцией в задних отделах левого полушария. По данным в динамике, нарастание представленности и амплитуды δ-колебаний, больше в левом полушарии, а также в затылочных отделах обоих полушарий, повышение ирритации в левой височной области.
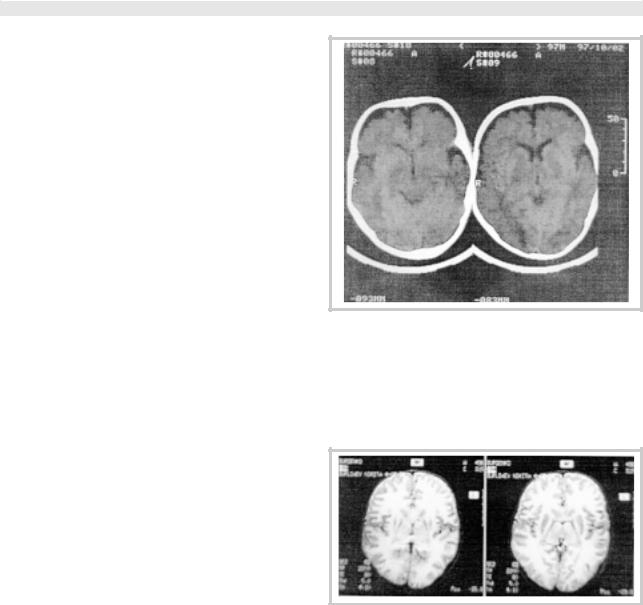
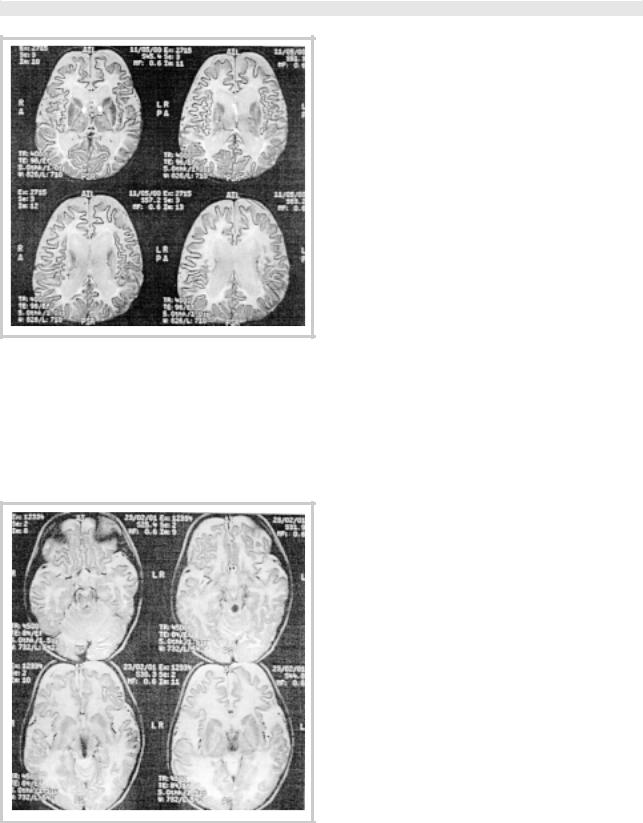
KT головного мозга: на серии сагиттальных томограмм (6 мес, 1 год 1 мес, 2,5 года, 3 года) определяется диффузное изменение рисунка белого вещества больших полушарий мозга, ствола и гемисфер мозжечка. В динамике отмеча- ется умеренное расширение III и боковых желудочков, IV желудочка, выраженное расширение конвекситальных субарахноидальных щелей в лобно-височных областях с двух сторон (рис. 1—3). В возрасте 3,5 лет на серии контрольных и аксиальных томограмм сохраняются ранее выявленные изменения, в режиме сканирования FLAIR у задних рогов боковых желудочков выявляются множественные мелкие кисты (рис. 4).
Офтальмологическое исследование: OU спокойны; нистагм; подвижность глазных яблок полная. Глазное дно: диски зрительных нервов бледные, контуры четкие, артерии узкие, вены нормального калибра. Макулярная зона и периферия без особенностей. Диагноз: частичная атрофия зрительных нервов.
Зрительные вызванные потенциалы: органические изменения OU. Патология проводящих путей OU. Острота зрения по зрительным вызванным потенциалам равна 0,02—0,04.
Стволовая аудиограмма: пороги слуховой чувствительности слева в пределах нормы, справа порог снижен и соответствует тугоухости II степени по типу нейросенсорной.
Большие трудности в работе детского невролога представляет клиническая диагностика нейродегенеративных заболеваний ввиду их редкости, а также неспецифичности и «диффузности» симптомов в ранних стадиях. Такие симптомы заболевания, как вялое сосание, нарушение фиксации взора, тремор, повышенная возбудимость, нарушение мышечного тонуса, судороги, апноэ, характерны для разных заболеваний генетической и негенетической природы [29]. Вероятнее всего, поэтому в нашем случае ребенок наблюдался в разных стационарах со следующими диагнозами: перинатальное поражение ЦНС, гипертензионный синдром, гидроцефалия, детский церебральный паралич.
Состояния, составляющие группу лейкодистрофий, относятся к дегенеративным заболеваниям нервной системы, но сопровождаются значительным нарушением процесса миелинизации. Основными кри-
Рис. 1. КТ головного мозга пациента Б. в возрасте 6 мес.
Ткань мозга мелкозернистой структуры, в скорлупе с обеих сторон определяется узкая зона снижения плотности. Дифференциа ция белого и серого вещества снижена, особенно в базальных отде лах. Желудочки симметричны, не деформированы, обычных размеро в. Субарахноидальное пространство расширено, атрофия особ енно выражена на уровне лобных долей до 6 мм. Признаков изменени я мозжечка нет.
Заключение: КТ-признаки атрофии лобных, височных, теменны х долей, дистрофических изменений мозга.
Рис. 2. МРТ головного мозга того же пациента в возрасте 1 года 1 мес.
Диффузное изменение рисунка белого вещества больших пол ушарий головного мозга, ствола и медиальных отделов мозжечка . Желудочковая система не расширена и не деформирована, умеренн о расширены конвекситальные субарахноидальные щели в лобных областях с двух сторон. Таким образом, по сравнению с предыду щими исследованиями рентгенологической динамики не выявл яется.
териями, позволяющими заподозрить лейкодистрофию, являются: дебют в определенном возрасте, наличие периода нормального развития, преимущественное поражение двигательных отделов нервной системы (пирамидные, экстрапирамидные, мозжечковые расстройства), нарушение поведения, деменция, а также признаки демиелинизации при КТ и МРТ головного мозга [24]. Неврологическая симптоматика имеет симметричный и прогредиентный характер. На глазном дне обычно обнаруживается атрофия зрительных нервов. Характерна белково-клеточная диссоциация в спинномозговой жидкости. МРТ высокочувствительна к дисмиелогенным нарушениям, но не очень специфична в плане дифференциальной диагностики. При всех этих патологических состояниях на Т2-взве- шенных томограммах и томограммах, отражающих
52 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2004 |
ЛЕЙКОДИСТРОФИЯ
Рис. 3. MРТ головного мозга того же пациента в возрасте 3 лет.
Сохраняется диффузное изменение рисунка белого веществ а больших полушарий с двух сторон, ствола головного мозга и геми сфер мозжечка. По сравнению с предыдущими исследованиями отме ча- ется умеренное гидроцефальное расширение III и боковых жел у- дочков, IV желудочка, выраженное расширение конвекситальн ых субарахноидальных щелей в лобно-височных областях с двух сторон. Таким образом, происходит нарастание наружной и внутренн ей водянки как проявление атрофического процесса.
Рис. 4. MPT головного мозга того же пациента в возрасте 3,5 лет.
На серии контрольных сагиттальных и аксиальных томограм м, как и в предыдущем исследовании, на фоне диффузного расширени я конвекситальных субарахноидальных пространств с двух с торон, сильвиевых щелей, вентрикуломегалии без признаков окклю зии определяется диффузное повышение сигнала от белого вещест ва больших полушарий симметрично с двух сторон, в режиме сканиро вания FLAIR у задних рогов боковых желудочков выявляются множественные мелкие кисты.
протонную плотность, видны гиперинтенсивные поля в белом веществе. МРТ-признаки плохо коррелируют с тяжестью клинического течения заболевания. Роль этого исследования заключается не в установлении высокоспецифичного диагноза или оценке тяжести процесса, а в дифференциальной диагностике с заболеваниями, имеющими сходную симптоматику [5].
В то же время имеются определенные клиниче- ские особенности и биохимические показатели, которые позволяют заподозрить определенную форму лейкодистрофий: наследственный анамнез, фенотип, дебют заболевания, особенности его клиники и тече- ния, вовлечение других органов и систем [8]. Основную роль в дифференциальной диагностике лейкодистрофий играют биохимические и молекулярно-гене- тические методы.
М. Adachi и соавт. описали три клинические формы БК в зависимости от возраста дебюта: врожденную, инфантильную и ювенильную [6, 7, 12, 29].
Наиболее хорошо изучена клинически инфантильная форма заболевания. На первом месяце у детей часто отмечаются нарушение фиксации взора, повышенная возбудимость, вялое сосание, слабый зрительный контакт «глаза в глаза», судороги, диффузная мышечная гипотония [29]. Основные клинические признаки БК становятся очевидными к 3 мес жизни. Важнейшими из них являются выраженная мышеч- ная гипотония, неспособность удерживать голову в вертикальном положении, в дальнейшем трансформация диффузной мышечной гипотонии в спастич- ность. Макроцефалия является характерным симптомом заболевания, но в раннем возрасте окружность головы может оставаться в пределах нормы. Патологический прирост окружности головы сохраняется после 6 мес жизни и может сочетаться с задержкой закрытия большого родничка [25]. B возрасте 1 года окружность головы может превышать 90 центилей. По данным G. Gascon и соавт. [13], мышечная гипотония, сопровождающаяся снижением двигательной активности, в последующем сменяется спастическим гипертонусом, что указывает на вовлечение в патологический процесс пирамидной системы. Наблюдается повышение сухожильных рефлексов, появляются патологические кистевые и стопные рефлексы, и по мере прогрессирования болезни развивается децеребрационная или декортикационная ригидность. Часто наблюдаются высокие «стартл-рефлексы». По мере развития заболевания нарастает нарушение психомоторного развития и, кроме того, у 50% больных присоединяются генерализованные тонико-клонические судороги. Судороги и атрофия зрительных нервов обычно развиваются на втором году жизни, к этому же возрасту увеличение окружности головы достигает плато [27]. Пациенты с БК могут быть легко возбудимы или, наоборот, повышенно сонливы.
Прогрессирование заболевания приводит к нарушениям работы желудочно-кишечного тракта, обусловливающим трудности вскармливания и гипотрофию. Большинство пациентов умирают в первой декаде жизни. При более поздних сроках манифестации заболевания продолжительность жизни увеличивается [13, 25, 27].
На основании сочетания в клинической картине заболевания макроцефалии, задержки психомоторно-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2004 |
53 |

НАБЛЮДЕНИЯ ИЗ ПРАКТИКИ
го развития, генерализованных тонических судорог, высоких «стартл-рефлексов», спастического тетрапареза, прогрессирующего характера течения процесса, а также выявления очагов демиелинизации при КТ и МРТ у нашего пациента было заподозрено дегенеративное заболевание нервной системы. Дифференциальная диагностика проводилась со следующими заболеваниями: болезнью Краббе (глобоидно-кле- точная лейкодистрофия), GM2 ганглиозидозы (тип 1 и 2), болезнью Александера, мегалэнцефалией и лейкодистрофией (болезнь Ван дер Кнаапа, или вакуолизирующая лейкоэнцефалопатия), синдромом Сотоса.
Сочетание у нашего пациента описанных выше симптомов позволило предположить БК или болезнь Александера. На уровне клинического осмотра разли- чить эти заболевания достаточно сложно. Сроки дебюта заболеваний и его основные симптомы сходны, однако применение методов нейровизуализации позволило с наибольшей вероятностью установить правильный диагноз.
При проведении МРТ головного мозга в динамике нами была обнаружена прогредиентность выявленных при первичном исследовании изменений в белом веществе головного мозга. Гиподенсные по данным КТ и гиперинтенсивные на T2-взвeшенныx МР-
изображениях зоны увеличились: если при начальном исследовании они занимали незначительные регионы перивентрикулярных отделов, то при последнем достигали степени субтотального поражения белого вещества конечного мозга.
Для точной верификации диагноза мы определили концентрацию N-ацетиласпартата в моче методом ВЭЖХ. Было выявлено значительное повышение его уровня: 2700 ммоль/моль креатинина (норма — до 700 ммоль/моль креатинина). На основании результатов этого биохимического исследования был установлен диагноз БК.
При проведении ДНК-диагностики в 6-м экзоне гена (ASPA) аспартоацилазы была обнаружена мутация А305Е в гетерозиготном состоянии. В настоящее время проводится поиск второй мутации для разработки метода прямой ДНК-диагностики в данной семье.
Таким образом, на основании ведущего клини- ческого синдрома, длительного наблюдения за ребенком, результатов КТ и МРТ в динамике, данных биохимических исследований (повышение экскреции N- ацетиласпартата в моче), обнаружения мутации гена нами был установлен диагноз болезни Канавана.
Впервые в России этот диагноз подтвержден на биохимическом и молекулярно-генетическом уровне.
ЛИТЕРАТУРА
1.Бадалян Л.О., Таболин В.А., Вельтищев Ю.Е. Наследственные болезни у детей. М: Медицина 1971; 90—97.
2.Покровская А.Я., Краснопольская К.Д., Моргунова М.В. и др. Идентификация 4-сульфаминобутановой кислоты в моче больной некетотической гиперглицинемией. Известия Академии нау к. Серия химическая 1996; 5: 1313—1315.
3.Таболин В.А. Наследственная и приобретенная патология обмена веществ у детей. Серия педиатрия. М: Медицина 1973; 14: 4: 260—265.
4.Темин П.А., Казанцева Л.З. Наследственные нарушения нервнопсихического развития у детей. М: Медицина 2001; 209—215.
5.Холин А.В. Магнитно-резонансная томография при заболеваниях центральной нервной системы. Ст-Петербург: Гиппократ 2000; 64—66.
6.Adachi Ì., Volk B.W. Protracted form of spongy degeneration of central nervous system (van Bogaert — Bertrand type). Neurology 1968; 18: 1084.
7.Adachi M., Schneck L.,Cazara J., Volk B.W. Spongy degeneration of the central nervous system (van Bogaert — Bertrand „ type; Canavan's Disease). Human Pathol 1973; 4: 331.
8.Aicardi J. The inherited Leukodystrophies: A clinical overview. J Inner Metab Dis 1993; 16: 733—743.
9.Aydinli N., Caliskan M., Calay M., Ozmen M. Use of localization proton nuclear magnetic resonance spectroscopy in Canavan’s disease. Turk J Pediat 1998; 40: 4: 549—570.
10.Banker B.Q., Victor M. Spongy degeneration of infancy. In: Genetic Diseases Among Ashkenazi Jews. R.M. Goodman, A.G. Motulsky (eds). New York: Raven Press 1979; 201.
11.Brismar J., Brismar G., Gascon G., Ozand P. Canavan disease: CT and MR imaging of the brain. Am J Neuroradiol 1990; 11: 805.
12.De Coo I.F.M., Bakkeren J.A.J.M., Gabreels F.J.M. Canavan disease: Value of N-acetylaspartic aciduria? Neuropediatrics 1991; 22.
13.Gascon G.G. et al. Infantile CNS spongy degeneration: 14 cases; clinical update. Neurology 1990; 40: 1876.
14.Gripp K.W., Zimmerman R.A.,Wang Z.J. et al. Imaging Studies in a Unique Familial Dysmyelinating Disorder Imaging Studies in a Unique Familial Dysmyelinating Disorder. Am J Neuroradiol 1998; 19: 1368—1372.
15.Hamaguchi H., Nihei Ê., Nakamoto N. et al. A case of Canavan's disease: The first biochemically proven case in Japanese girl. Brain Dev 1993; 15: 367.
16.Jellinger K., Seitelberger F. Juvenile form of spongy degeneration of the CNS. Acta Neuropathol 1969; 13: 276.
54
17.Jonson R.T., Griffen J.W. Current therapy in neurologic disease 1997; 343.
18.Kaul R.K., Casanova J., Johnson A. et al. Purfication, characterization and localization of aspartoacylase from bovine brain. J Neurochem 1991; 56: 129.
19.Kaul R., Michals K., Casanova J., Matalon R. The role of N-acety- laspartic acid in brain metabolism and the pathogenesis in Canavan disease. Int Pediat 1991; 6: 40.
20.Kaul R., Gao G.P., Balamurugan K., Matalon R. Cloning of the human aspartoacylase ñ DNA and common missence mutation in canavan disease. Nat Genet 1993; 5: 118.
21.Kobayashi K., Tsujino S., Ezoe T. et al. Missense mutation (1143 Ò) in Japanese patient with Canavan disease. Hum Mutat 1998; Suppl 1: 308.
22.Matalon R., Michals K., Sebasta D. et al. Aspartoacylase deficiency and N-acetylaspartic aciduria in patients with Canavan disease. Am J Med Genet 1988; 29: 463.
23.Matalon R., Kaul R.K., Casanova J. et al. Aspartoacylase deficiency: The enzyme defect in Canavan disease. J Inherit Metab Dis 1989;
12:329.
24.Matalon R., Kaul R.K., Michals K. Canavan Disease: Biochemical and Molecular Studies. J Inher Metab Dis 1993; 16: 744—752.
25.Matalon R., Kaul R.K., Michals K. Spongy degeneration of the brain: Canavan’s Disease. In: Pediatric Neuropathology Ducrett Serge. M.D. 1995; 625—628.
26.Mejaski-Bosnjak V., Besenski N., Brockmann-Pouwels P.J.W. et al.
Cystic leukoencephalopathy in a megaloencephalic child: Clinical and magnetic resonance imaging/magnetic resonance spectroscopy. Pediat Neurol 1997; 16: 347.
27.Menkes J.H. Textbook of Child Neurology, 3nd. Ed. Philadelphia: Lea and Febiger 1985.
28.Ozand P.T., Gascon G.G., Dhalla M. Aspartatacylase deficiency and Canavan disease in Saudi-Arabia. Am J Med Genet 1990; 35: 266.
29.Scriver C.R., Beaudet A.L., Sly W.S., Valle D. The metabolic and molecular bases of Inherited disease, 8nd. New York 2001; 28: 5799—5807.
30.Tallan H.H., Moore S., Stein W.N. N-acetyl-L-aspartic acid in brain. J Biol Chem 1956; 219: 257.
31.Traeger B.C., Rapin I. The clinical course of Canavan disease. Pediat Neurol 1997; 18: 207.
32.Ungar M., Goodman R.M. Spongy degeneration of the brain in Israel: A retrospective study. Clin Genet 1983; 23: 23.
Поступила 20.01.03
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2004
