
Журнал неврологии и психиатрии / 2004 / NEV_2004_09_03
.pdf
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Клинико-нейрофизиологическое и экспериментальное изучение особенностей применения сульфата адамантана при болезни Паркинсона
Г.Н. АВАКЯН, Т.А. ВОРОНИНА, Е.А. ВАЛЬДМАН, Л.Н. НЕРОБКОВА, Е.А. КАТУНИНА, Е.В. САМОЙЛОВА
Clinico-neurophysiologic and experimental study of the peculiarities of adamantansulphate treatment in Parkinson’s disease
G.N. AVAKYAN, T.A. VORONINA, E.A. VALDMAN, L.N. NEROBKOVA, E.A. KATUNINA, E.V. SAMOILOVA
Кафедра неврологии и нейрохирургии с курсом факультета усовершенствования врачей Российского государственного медицинского университета, лаборатория психофармакологии Государственного учреждения НИИ фармакологии РАМН, Москва
Провели экспериментальное исследование паркинсонизма у крыс, а также обследование больных с начальными формами болезни Паркинсона. Использовали методы электромиографии, электронейромиографии. Были выявлены нейрофизиологические проявления реорганизации периферического нейромоторного аппарата и критерии для оценки эффективности лечения. Полученные экспериментальные и клинические результаты позволят положительно оценить адекватность терапии адамантан-сульфатом при болезни Паркинсона.
Ключевые слова: болезнь Паркинсона, электромиография, электронейромиография, адамантан-сульфат, метил-4- фенил-1,2,3,6-тетрагидропиридин (МФТП).
An experimental investigation of parkinsonism in rats and patients with initial forms of Parkinson’s disease was performed by using methods of electromyography and electroneuromyography. Neurophysiologic peculiarities of reorganization of peripheral neuromotor apparatus and criteria for treatment efficacy were detected. The results obtained in the study allowed evaluating of an adequacy of adamantan-sulphate therapy either in the animal experiments and in patients with Parkinson’s disease.
Key words: Parkinson’s disease, electromyography, electroneuromyography, adamantan-sulphate, methyl-4-phenyl- 1,2,3,6-tetrahydropyridine (MPTP), oxotremorine.
Zh Nevrol Psikhiatr Im SS Korsakova 2004;104: 9: 18—22
Открытие в начале 60-х годов прошедшего столе- |
курентным антагонистом NMDA-рецепторов [10, 12]. |
|
тия дофаминергической природы болезни Паркин- |
Это означает, что он может блокировать эффекты глу- |
|
сона и внедрение в практику препаратов леводопы |
тамата, которые усиливаются при снижении ингиби- |
|
дало надежду тысячам таких больных и позволило |
рующего воздействия нигростриарной дофаминерги- |
|
значительно улучшить качество их жизни. Вместе с |
ческой системы, что обусловливает функциональный |
|
тем токсичность ДОФА-содержащих препаратов, боль- |
дофаминергический эффект препаратов данной груп- |
|
шое количество побочных эффектов, необходимость |
ïû [2, 9, 11]. |
|
постепенного увеличения дозы значительно ограни- |
В настоящее время в клинической практике для |
|
чивают возможность их применения [3, 4, 7]. Поиск |
лечения болезни Паркинсона используются аманта- |
|
новых лекарственных средств, эффективных и при |
дина гидрохлорид (мидантан, вирегит, симметрел) и |
|
этом вызывающих минимальное количество побоч- |
амантадина сульфат (ПК-Мерц) [6]. Последний вы- |
|
ных явлений, постоянно продолжается. В последние |
годно отличается наличием инфузионной и таблети- |
|
годы возрос интерес к производным адамантана |
рованной форм, что позволяет использовать его при |
|
(амантадину и мемантину) в связи с открытием но- |
резком ухудшении состояния больных — акинетиче- |
|
вых механизмов их терапевтического действия при |
ских кризах, бульбарных нарушениях. |
|
болезни Паркинсона. Экспериментально установле- |
На кафедре неврологии и нейрохирургии с кур- |
|
но, что амантадин является не только непрямым аго- |
сом факультета усовершенствования врачей РГМУ |
|
нистом дофаминергических рецепторов, но и некон- |
совместно с ГУ НИИ фармакологии РАМН была |
|
|
проведена экспериментально-клиническая работа, |
|
|
целью которой явилось изучение эффективности пре- |
|
© Коллектив авторов, 2004 |
||
|
||
18 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2004 |

ЛЕЧЕНИЕ БОЛЕЗНИ ПАРКИНСОНА
парата ПК-Мерц с использованием электромиографии и электронейромиографии (ЭНМГ).
Первым этапом исследования была нейрофизиологическая оценка препарата на экспериментальных моделях паркинсонизма, индуцированного введением метил-4-фенил-1,2,3,6-тетрагидропиридина (МФТП) и оксотреморина. Внутрибрюшинное введение этих препаратов вызывает у крыс все основные двигательные симптомы паркинсонизма — олигокинезию, ригидность, тремор, выраженность и продолжительность которых носят дозозависимый характер [1, 2, 4].
Для исследования отбирались 15 беспородных белых крыс-самцов в возрасте 6—10 мес массой 350—450 г. МФТП вводили внутрибрюшинно в дозе 40 мг/кг в течение 3 дней, оксотреморин — также внутрибрюшинно, но однократно в дозе 0,2 мг/кг. Нейромиографическое исследование проводили через 30 мин после введения МФТП и непосредственно после введения оксотреморина. ПК-Мерц вводили в растворенной в воде таблетированной форме в дозе 50 мг/кг. Контрольная группа включала 10 крыс и соответствовала основной группе по массе и возрасту животных.
МФТП изменял структуру кривой ЭМГ: она становилась уреженной, появлялись неритмичные потенциалы фасцикуляций (рис. 1), что позволяло отнести ее ко II типу по классификации Ю.С. Юсевич (денервационный тип) [8]. У крыс контрольной группы регистрировалась интерференционная кривая (I тип по той же классификации) с амплитудой 389,5±50,6 мкВ в мышцах передних и 470,5±44,3 мкВ
— задних конечностей.
Регистрация мышечной активности в состоянии покоя не выявила существенных различий в амплитудных характеристиках с контрольной группой, но и здесь отмечалось урежение кривой. Проведение спек- трально-частотного анализа по методу Берг — Фурье выявило смещение частотного спектра кривых влево с преобладанием частот в диапазоне от 40 до 70 Гц (норма 80—120 Гц), что подтверждает визуально определяемое урежение кривых. Подобные изменения структуры кривой, по-видимому, обусловлены умень-
шением количества функционирующих двигательных единиц на сегментарном уровне и синфазной работой сохранных двигательных единиц.
При введении оксотреморина ведущим симптомом являлся тремор, что нашло отражение в структуре кривой ЭМГ. В покое и при мышечном напряжении регистрировались ритмичные залпы осцилляций с частотой 13 Гц. Средняя амплитуда залпов при максимальном мышечном усилии в мышцах передних конечностей составила 527,91±30,6 мкВ, задних конечностей — 587,4±38,9 мкВ (рис. 2).
Изменения показателей ЭНМГ при введении МФТП и оксотреморина имели однонаправленный характер. Отмечалось достоверное увеличение скорости проведения импульса (СПИ) по двигательным волокнам n. medianus и n. peroneus с двух сторон. При введении МФТП СПИ по n. medianus, составила 30,4±2,7 м/с (p<0,05), по n. peroneus — 32,5±2,4 м/с (p<0,05), при введении оксотреморина — соответственно 31,98±2,3 м/с (р<0,01) и 44,19±3,1 м/с (р<0,01), в контроле — 24,04±2,4 и 26,01±2,15 м/с (табл. 1). При этом наибольшие значения отмечались у наиболее «старых» крыс (возраст более 9 мес), у которых симптомы паркинсонизма были более выраженными.
Увеличение СПИ по периферическим нервам, вероятнее всего, объясняется растормаживанием сег- ментарно-периферического аппарата в связи с уменьшением тормозных надсегментарных влияний по нисходящим ретикулоспинальным и кортико-спиналь- ным трактам. Изменением функционального состояния пула спинальных мотонейронов вследствие уменьшения центральных тормозных механизмов объясняется также снижение порога вызывания рефлекса Гоффманна (Н-рефлекс) с увеличением амплитуды Н-рефлекса. Так, увеличение амплитуды Н-ответа после трехдневного введения МФТП составило 1,35±0,6 мВ, а в группе наиболее «старых» крыс — 1,79±0,4 мВ (50,9% от контрольных значений). Амплитуда М-ответа в мышцах дистальных отделов передних и задних конечностей менялась разнонаправлен-
Рис. 1. Спонтанная мышечная активность с m. extensor digitorum communis у крыс после введения МФТП.
Рис. 2. Спонтанная мышечная активность с m. extensor digitorum communis у крыс после введения оксотреморина.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2004 |
19 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Таблица 1. Параметры ЭНМГ у животных с индуцированной болезнью Паркинсона
Группа животных |
Латентный период |
Длительность |
Амплитуда |
ÑÏÈ, ì/ñ |
|
М-ответа, мс |
М-ответа, мс |
М-ответа, мВ |
|||
|
|
||||
|
|
|
|
||
|
|
Срединный нерв |
|
||
Kонтрольная |
1,5±0,2 |
3±0,3 |
3,45±0,3 |
24,04±2,4 |
|
ÌÔÒÏ |
2,1±0,15 |
3,5±0,2 |
2,34±0,4* |
30,4±2,7* |
|
Оксотреморин |
1,52±0,3 |
2,19±0,1** |
2,51±0,3* |
31,98±2,3** |
|
|
|
Большеберцовый нерв |
|
||
Kонтрольная |
2,9±0,1 |
3,5±0,15 |
4,7±0,2 |
26,01±2,15 |
|
ÌÔÒÏ |
3,2±0,2 |
3,9±0,2 |
6,9±0,3** |
32,5±2,4* |
|
Оксотреморин |
1,92±0,1 |
3,73±0,3 |
8,06±0,4** |
44,19±3,1** |
|
|
|
|
|
|
|
Примечание. Достоверные различия с контролем: * — p<0,05; ** — p<0,01.
но. В мышцах кисти отмечалось ее снижение с 3,45±0,3 мВ в фоновом исследовании до 2,34±0,4 мВ (р<0,05) при введении МФТП и до 2,51±0,3 мВ (р<0,05) при введении оксотреморина. В мышцах стопы амплитуда достоверно увеличивалась: ее прирост составил 2,17±0,3 мВ (р<0,01) при введении МФТП и 3,34±0,4 мВ (р<0,01) при введении оксотреморина (см. табл. 1). Подобные изменения объясняются, по-видимому, более выраженными изменениями мотонейронов поясничного утолщения и большей функциональной значимостью задних конечностей.
Введение ПК-Мерца оказывало наиболее выраженное воздействие на нейрофизиологические характеристики при использовании модели паркинсонизма, вызванного оксотреморином. Уже через 30 мин после однократного применения ПК-Мерца нормализовалась структура кривой ЭМГ, уменьшались амплитуда и частота залпов осцилляций при максимальном мышечном усилии. СПИ по двигательным волокнам n. medianus снизилась с 31,98±2,3 до 26,08±2,1 м/с (p<0,05), по n. peroneus — с 44,19±3,1 до 34,7±2,8 м/с (p<0,01). Почти вдвое (с 3,21±0,4 до 1,79±0,3 мВ) уменьшилась амплитуда Н-рефлекса.
Однократное введение ПК-Мерца крысам с МФТП-индуцированным синдромом вызывало аналогичные изменения. Снижалась СПИ по двигательным волокнам n. medianus с 30,37±2,7 до 20,28±2,1 м/с (p<0,01), по n. peroneus с 32,5±2,4 до 22,3±2,3 м/с (p<0,01). Менялся характер записи кривой ЭМГ при мышечном усилии — амплитудно-частотные характеристики приближались к таковым при интерференционной записи кривой.
На втором этапе исследования проводилась клиническая и нейрофизиологическая оценка эффективности ПК-Мерца у больных с начальными формами болезни Паркинсона (I—II стадия по классификации M. Hoehn и M. Yahr, 1967). Обследовали 30 больных (21 мужчина и 9 женщин, возраст 42—68 лет). У 18 была преимущественно акинетико-ригидная форма болезни, у 12 — дрожательная.
ПК-Мерц вводили ежедневно внутривенно капельно по 500 мл (0,2 г) в течение 7 дней. Клиниконейрофизиологические исследования проводили до и по окончании курса введения препарата. После внутривенных инъекций больным рекомендовался прием
препарата в таблетированной форме по 0,1 г 3 раза в сутки.
Для клинической оценки симптомов болезни Паркинсона использовали шкалу повседневной активности R. Schwab и A. England (1969), унифицированную рейтинговую шкалу тяжести паркинсонизма (UPDRS— C.Fahn и соавт., 1987), с помощью которой определяли суммарный балл, суммарный балл II (повседневная активность) и III (двигательные нарушения) разделов.
Электромиографическое исследование включало запись ЭМГ с помощью поверхностных электродов в состоянии покоя и максимального мышечного напряжения с анализом амплитудно-частотных характеристик кривых с m. thenar и m. peroneus longus. При ЭНМГ определяли амплитуду, латентность, длительность M- и H-ответов, СПИ по двигательным волокнам n. me-
dianus è n. peroneus.
При проведении фоновой электромиографии у больных с дрожательной формой болезни Паркинсона в мышцах кисти и голени регистрировался III тип кривой ЭМГ с ритмичными залпами осцилляций частотой 6—7 Гц и амплитудой 2297±253 мкВ. При аки- нетико-ригидной форме определялась редуцированная кривая с амплитудой 2446±310 мкВ. В большинстве случаев при сочетании тремора, ригидности и элементов акинезии выявлялась уреженная кривая, на фоне которой регистрировались залпы осцилляций (рис. 3). Анализ амплитудных параметров кривой максимального мышечного напряжения выявил асимметрию показателей с увеличением амплитуды на стороне двигательных нарушений с последующим ее снижением по мере прогрессирования заболевания.
При ЭНМГ отмечались повышенные значения СПИ по двигательным волокнам периферических нервов, превышавшие возрастную норму. На стороне неврологических нарушений СПИ была достоверно выше, что согласуется с результатами экспериментальных исследований на моделях паркинсонизма у крыс. Так, средние значения СПИ по двигательным волокнам n. medianus и n. peroneus у больных на стороне преимущественных двигательных нарушений составили соответственно 56,2±3,5 и 47,4±2,9 м/с, в контрольной группе — 48,1±4,8 и 37,5±3,7 м/с. Наибольшая асимметрия показателей наблюдалась у боль-
20 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2004 |

ЛЕЧЕНИЕ БОЛЕЗНИ ПАРКИНСОНА
Рис. 3. Спонтанная мышечная активность у больного 54 лет с дрожательно-ригидной формой при преобладании левосторонних двигательных нарушений.
1 — ЭМГ с m. opponens policis dex. в покое; 2 — то же при мышечном усилии; 3 — ЭМГ с m. opponens policis sin. в покое; 4 — то же при мышечном усилии.
ных с односторонними двигательными нарушениями, по мере появления двусторонних неврологиче- ских нарушений эти различия становились менее зна- чимыми. Амплитуда М-ответа в мышцах кистей и стоп на стороне двигательных нарушений превышала зна- чения клинически «интактной» стороны, особенно в мышцах кистей. По мере прогрессирования заболевания эта асимметрия становилась более значимой.
Исследование Н-рефлекса в икроножных мышцах выявило асимметрию амплитуд Н-ответов с увеличением амплитуды на стороне преимущественно двигательных нарушений, что привело к повышению величины соотношения амплитуд Н- и М-ответов в процентах (максимальная амплитуда Н-ответа/макси- мальная амплитуда М-ответа·100%) на той же стороне. На стороне преимущественных двигательных нарушений соотношение Н/М составило 25,1±2,4%, на противоположной — 15,1±2,7%. Анализ нейромиографических показателей у больных с дрожательной и с ригидной формой заболевания не выявил существенных отличий. Повышение амплитуды М- и Н-отве- тов, по-видимому, объясняется уменьшением нисходящих тормозных влияний нигроспинального тракта на интернейроны тонического рефлекса растяжения и повышением возбудимости спинальных мотонейронов. Растормаживание сегментарно-периферическо- го аппарата приводит к снижению порога возбуждения наиболее быстро проводящих волокон, что обусловливает повышение СПИ по двигательным волокнам периферических нервов на стороне преимущественных двигательных нарушений. Эти данные согласуются с результатами транскраниальной магнитной стимуляции, когда также было выявлено увеличение амплитуды центрального мышечного потенциала и укорочение времени центрального моторного проведения по пирамидному тракту [5].
Проведенное у 10 больных с сосудистыми формами паркинсонизма нейромиографическое исследование не обнаружило acиммeтpии показателей амплитуды ЭМГ и М-ответа в мышцах кистей и стоп. Зна- чения СПИ были одинаковыми с двух сторон и достоверно ниже показателей при болезни Паркинсона.
Уже после 1—2 инфузий ПК-Мерца отмечалось улучшение самочувствия больных — повышение двига-
тельной активности, подвижности, инициативности. После 7 инфузий улучшалось выполнение проб на моторику, снижался мышечный тонус, становилась более уверенной походка, уменьшались саливация, нарушения чувствительности, у части больных уменьшался тремор. Статистический балльный анализ с использованием шкалы UPDRS выявил уменьшение суммарного балла, преимущественно за счет III раздела (табл. 2), а также повышение повседневной активности по шкале Schwab и England на 9,2%.
Наиболее выраженным эффект был у больных с акинетико-ригидной формой заболевания, меньшим при дрожательных формах, однако и в этом случае отмечалось уменьшение амплитуды и постоянства тремора.
Улучшение самочувствия сохранялось 2—3 мес после отмены инфузионной формы препарата и перевода на таблетированную форму его применения
— по 0,1 г 3 раза в день. Стабильный эффект отмечался на протяжении от 5—7 мес до 3 лет, при этом не требовалось увеличения дозы и присоединения препаратов других групп.
У 10 больных (7 мужчин и 3 женщины, возраст 58—69 лет) ПК-Мерц применяли на фоне приема ДОФА-содержащих препаратов (наком, мадопар). Длительность заболевания в этой группе составляла от 4 до 10 лет, стадия болезни по шкале Hoehn и Yahr соответствовала III—IV, суточная доза ДОФАсодержащих препаратов в среднем колебалась от 250 до 750 мг. Согласно результатам анализа, в этой группе эффект препарата не зависел от дозы ДОФА-со- держащего препарата, но определялся формой заболевания: более значимым он был у больных с акине- тико-ригидной формой, меньшим при дрожательной.
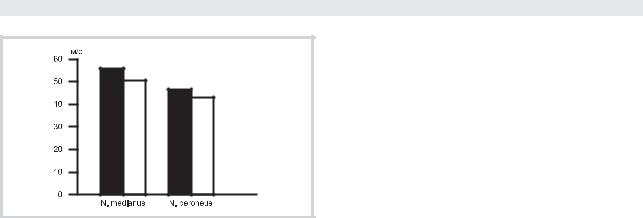
Благоприятное клиническое действие ПК-Мерца подтверждалось его нормализующим влиянием на функциональное состояние сегментарно-перифериче- ского аппарата. Регрессу двигательных нарушений сопутствовали повышение средней амплитуды кривой максимального мышечного сокращения и нормализация ее структуры. Так, у больных с дрожательной формой болезни уменьшалось количество экстрапирамидных залпов, снижалась дисперсность частотных значений. У больных с акинетико-ригидной формой также происходила нормализация частотно-амплитуд- ных характеристик, уменьшалось число неритмичных фасцикуляций, кривая по структуре приближалась к I типу кривой ЭМГ. К концу курса инфузионной терапии ПК-Мерцом отмечалось снижение СПИ на стороне двигательных нарушений и приближение к показателям контрольной группы (рис. 4).
Таблица 2. Динамика показателей по шкале UPDRS
Раздел, шкалы |
До введения |
После введения |
UPDRS |
ПK-Мерца |
ПK-Мерца |
|
|
|
III — повседневная |
38±3,4 |
51,32±2,5 |
активность |
|
|
II+III — двигательные |
32,78±2,9* |
46,11±2,7* |
нарушения+повседнев- |
|
|
ная активность |
|
|
|
|
|
Примечание. * — достоверные различия между группами на уровне p<0,05.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2004 |
21 |
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Рис. 4. СПИ по n. medianus и n. peroneus у пациентов с болезнью Паркинсона до (темные столбцы) и на фоне применения (светлые столбцы) ПК-Мерца (р<0,05).
У больных со стойким клиническим эффектом на стороне поражения происходило снижение амплитуды М-ответа в мышцах кистей и стоп. У 5 больных (3 с дрожательной, 2 со смешанной формой болезни Паркинсона) значимой динамики на фоне лечения не было обнаружено: по окончании курса лечения ПКМерцом определялась тенденция к возрастанию амплитуды М-ответа в мышцах кистей и стоп, СПИ по двигательным волокнам периферических нервов не изменилась или незначительно возросла. При отведении накожными электродами структура кривой у этих больных оставалась прежней.
Препарат продемонстрировал хорошую переносимость. Из побочных эффектов у одного больного отмечалась мраморность кожных покровов нижних конечностей, у 2 на фоне введения раствора ПКМерца наблюдалось легкое головокружение несистемного характера. Только у одного больного с отягощенным аллергологическим анамнезом, длительно страдающего бронхиальной астмой, препарат пришлось отменить через 1,5 нед после перехода на таблетированную форму, причиной чего явилось учащение приступов удушья, что больной связывал с приемом ПК-Мерца.
Таким образом, данные клинического и нейромиографического исследования свидетельствуют о значительном повышении под влиянием ПК-Мер- ца у больных с начальными формами болезни Паркинсона двигательной активности, уменьшении выраженности основных двигательных симптомов — брадикинезии, ригидности, тремора, что подтверждено результатами использования нейромиографи- ческих методик. Применение электромиографии и ЭНМГ помогло уточнить особенности перестройки сегментарно-периферического аппарата на фоне дисбаланса тормозных и активирующих влияний, характерных для этой болезни, что определяет предпосылки для использования этих методов с целью динамического наблюдения и оценки эффективности применяемой при болезни Паркинсона терапии.
ЛИТЕРАТУРА
1.Атаджанов М.А. Экспериментальное моделирование паркин- 7. Федорова Н.В., Ким И.П. Лечение болезни Паркинсона. Журн
сонического синдрома и его патогенетическая терапия: Дис. ...
ä-ðà ìåä. íàóê. Ì 1989.
2.Вальдман Е.А. Разработка фармакологического средства патогенетической терапии паркинсонизма на основе анализа механизмов действия производных аминоадамантана: Дис. ... ä-ðà ìåä. íàóê. Ì 2001.
3.Голубев В.Л., Левин Я.И., Вейн А.М. Болезнь Паркинсона и синдром паркинсонизма. М: МЕДпресс 1999.
4.Голубев В.Л. Лечение нервных болезней 2001; 3: 5: 3—11.
5.Гусев Е.И., Гехт А.Б., Селихова М.В., Серкин Г.В. Магнитная стимуляция головного мозга в оценке эффективности лечения и реабилитации болезни Паркинсона. Материалы научно-прак- тической конференции «Болезнь Паркинсона». М 1999.
неврол и психиат 2002; 102: 2: 68—72.
8.Юсевич Ю.С. Электромиография в клинике нервных болезней. М: Медгиз 1958.
9.Jackish R., Link Ò., Neufang Â., Koch R. Studies on the mechanism of the antiparkinsonian drugs memantine and amantadine: no evidence for direct dopaminomimetic or antimuscarinic properties. Arch Int Pharmacodyn Ther 1992; 320: 21—42.
10.Kornhuber J., Weller H., Schoppnieyer K., Riederer P. Amantadine and memantine as NMDA receptor antagonists with neuroprotective properties. J Neural Transm 1994; 43: 91—104.
11.Kornhuber J., Weller M. Psychotogenicity and N-methyl-D-aspartate receptor antagonism: implications for neuroprotective pharmacotherapy. Biol Psychiat 1997; 41: 135—144.
6.Неробкова Л.Н., Вальдман Е.А., Воронина Т.А. и др. Противопар12. Weller M., Finielsmarlier F., Paul S.M. NMDA receptor-mediated
кинсоническая активность нового производного адамантана. Экспериментальная и клиническая фармакология 2000; 63: 2: 3—6.
glutamate toxicity of cultured cerebellar, cortical and mesencephalic neurons — neuroprotective properties of amantadine and memantine. Brain Res 1993; 613: 143—148.
Поступила 15.07.03
22 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2004 |
