
Журнал неврологии и психиатрии / 2007 / NEV_2007_06_13
.pdf
Мелатонин и депрессия
Я.А. КОЧЕТКОВ
Melatonin and depression
YA.A. KOCHETKOV
Московский НИИ психиатрии Минсоцздрава России
Одной из быстро развивающихся областей исследований в рамках проблемы аффективных расстройств является психонейроэндокринология. Работы в этой области затрагивают различные звенья эндокринной системы, но в центре внимания многие годы остается гипоталамо-гипофизарно- надпочечниковая система (ГГНC). По отношению к ней нарушения в гипоталамо-гипофизарно-тиреоидной, гипо- таламо-гипофизарно-гонадной и других системах многие исследователи [6, 14, 17, 32] считают вторичными.
В настоящее время наиболее адекватным подходом к изучению биологических механизмов возникновения и те- чения аффективных расстройств является функциональносистемный подход [9], т.е. не нарушение секреции отдельных нейромедиаторов, гормонов и других биологически активных веществ, а оценка дисфункции определенных функциональных систем. Так, при рассмотрении роли ГГНС в патогенезе депрессии принимается во внимание функция всей системы адаптации и реакции на стресс с учетом функциональных последствий.
Еще одним важным подходом к изучению нейробиологии аффективных расстройств является изучение системы хронобиологической регуляции, в частности внутренней десинхронизации циркадных и сезонных ритмов. Это связано во многом с тем, что аффективные расстройства зачастую цикличны по своей природе и некоторые из них, например сезонное аффективное расстройство, напрямую связаны с сезонными ритмами [31]. Известно, что одним из главных звеньев, отвечающих за хронобиологическую регуляцию, наряду с супрахиазматическими ядрами гипоталамуса являются эпифиз и его основной гормон мелатонин [11].
Cинтезируемый эпифизом (пинеальной железой) мелатонин (N-ацетил-5-метокситриптамин) представляет собой филогенетически древний гормон, практически повсеместно присутствующий в мире животных, включая и некоторые одноклеточные организмы. Он синтезируется в эпифизе из триптофана, через промежуточный синтез серотонина [23]. Экстрапинеальный мелатонин синтезируется в сетчатке, в некоторых клетках кишечника, костном мозге. Однако определяемый в крови мелатонин целиком эпифизарного происхождения [26].
Синтез мелатонина в пинеалоцитах эпифиза контролируется сигналами, поступающими от супрахиазматических ядер гипоталамуса, которые выступают в качестве пейсмейкера (водителя ритма). Управление эпифизом осуществляется непосредственно при помощи вегетативной нервной системы. Зрительная информация от сетчатки через ответвление зрительного нерва попадает в супрахиазматические ядра. Затем эти сигналы через гипоталамус по проводящим путям вдоль ствола головного мозга нисходят вниз, в шейный отдел спинного мозга, откуда по симпатическим нер-
© Я.А. Кочетков, 2007
Zh Nevrol Psikhiatr Im SS Korsakova 2007;107:6:79—83
вам проникают обратно в головной мозг и достигают эпифиза [5].
Наступление темноты является внешнесредовым сигналом, запускающим синтез и секрецию мелатонина из эпифиза. Мелатонин всегда продуцируется ночью, независимо от того, бодрствует человек или спит. Днем уровень мелатонина в крови очень низкий, а ночью наблюдается его повышенное содержание с максимумом в крови около 2 ч ночи. Обычно концентрация мелатонина начинает возрастать за два часа до привычного для данного человека времени отхода ко сну. Быстрый рост уровня мелатонина наблюдается сразу после выключения света, достигая 100—300 пг/мл (против 1—3 пг/мл днем) [5, 23].
Секреция мелатонина всегда сопутствует темноте [10, 11], но необязательно сну. Например, ночные животные активны ночью, несмотря на высокий уровень мелатонина
âкрови. В природе секреция мелатонина подавляется на рассвете и в сумерки; в результате продолжительность его секреции варьирует в зависимости от сезонных колебаний длительности светового дня. Мелатонин принято считать гормональным сигналом наступления ночной темноты; этот сигнал может использоваться разными видами животных всевозможными способами. Когда в организм мелатонин вводится извне, он может имитировать эффект короткого дня и длинной ночи, характерных для зимнего времени. Влияние мелатонина на биологию размножения специфич- но для каждого вида животных и определяется длительностью светового дня [26]. У хомяков короткий день понижает гонадную активность, у овец — повышает.
Âсвязи с четким суточным ритмом секреции и зависимостью ее от длительности фотопериода мелатонин считают координатором циркадного и сезонного ритмов [2].
Мелатонин вовлечен в контроль множества физиологических функций, таких как репродукция, регуляция сна, иммунные процессы, подавление роста опухолей, регуляция кровяного давления, контроль настроения и поведения. Одной из его функций также считается защита организма от свободных радикалов [27]. Что касается влияния мелатонина на нейроэндокринную сферу, то в основном это влияние ингибирующее. В частности, повышение секреции мелатонина зимой снижает гонадную активность. Особенно важным в контексте данной статьи является его ингибирующее влияние на ГГНС [1].
Действие мелатонина осуществляется через два вида мембранных рецепторов — МТ1 и МТ2. Кроме того, ранее были выделены также рецепторы MT3, но позже было установлено, что на самом деле они являются ферментом хи- нонредуктазой-2. Мелатонин оказывает также свое действие
âклетке, связываясь с внутриядерными рецепторами и непосредственно с кальмодулином и цитоскелетными протеинами [23].
Физиология циркадных ритмов
Слово «циркадные» происходит от греческих корней — circa (находящийся в движении) и dies (в течение дня). Цир-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2007 |
79 |

ОБЗОРЫ
кадные биоритмы имеют длительность периода от 20 до 28 ч и синхронизированы с вращением Земли вокруг своей оси, сменой дня и ночи. Прежде всего это ритмы «сон — бодрствование», а также суточные колебания различных физиологических параметров. Такие ритмы наиболее устойчивы и сохраняются в течение жизни организма.
Циркадные ритмы (ЦР) — это не просто пассивная реакция организма на изменения окружающей среды. Они управляются активным внутренним «водителем ритма» (пейсмейкером), обеспечивающим синхронность с циклом день — ночь. Циркадная система обеспечивает функционирование механизма предварительной адаптации к предсказуемым изменениям окружающей среды. Например, внутренняя температура тела повышается во второй половине ночи, вероятно, подготавливая таким образом индивида к активности при утреннем пробуждении.
У млекопитающих, как уже было сказано, основными структурами, отвечающими за синхронизацию эндогенных ритмов с факторами внешней среды, являются супрахиазматические ядра (СХЯ) гипоталамуса и эпифиз. СХЯ контролируют временную регуляцию большинства ЦР, вклю- чая секрецию мелатонина, желание уснуть, внутреннюю температуру тела и выделение кортизола. Если эта область мозга при эксперименте у лабораторных животных разрушается, то ЦР, обеспечивающие регуляцию внутренней температуры тела и гормональной секреции, утрачиваются, и сон наступает на очень короткие промежутки времени, одинаковые на протяжении 24 ч.
Процесс регулировки с ориентацией на сигналы времени из окружающей среды называется подгонкой биологи- ческих часов к суточному ритму. Первичным сигналом времени в природе является солнечный цикл день — ночь, хотя и другие сигналы могут играть здесь свою роль. СХЯ стимулирует секрецию мелатонина эпифизом в ночные часы. Функциональная система обратной связи между эпифизом и СХЯ обеспечивается посредством мелатониновых рецепторов, содержащихся в СХЯ [3, 26].
Эпифиз обеспечивает координацию различных биологических ритмов. В случае изменения факторов окружающей среды, работа этой эндокринной железы позволяет провести «подгонку» биоритмов организма к новым условиям. Дефекты в работе эпифиза приводят к десинхронизации биоритмов организма.
Мелатонин и депрессия
Âпоследние десятилетия проводились многочисленные исследования, в которых были выявлены нарушения секреции эпифизарного мелатонина при депрессии. В большинстве из них [2, 8, 10, 24, 26, 27] было установлено, что у пациентов с депрессией отмечается понижение содержания мелатонина в плазме крови в ночные часы с соответствующим снижением экскреции его метаболитов. Некоторые исследователи [4] считают, что низкий уровень мелатонина у пациентов с депрессией, являясь признаком уменьшения уровня норадреналина и серотонина в головном мозге, может быть использован как маркер баланса этих нейромедиаторов на мозговом уровне.
Âрезультате интенсивного изучения секреции мелатонина при аффективных расстройствах была создана концепция «синдрома низкого мелатонина» [29]. Согласно этой концепции, низкая секреция мелатонина может быть биологическим маркером предрасположенности к депрессии. Но более поздние исследования показали, что нарушения продукции мелатонина при депрессии сложнее, чем просто его дефицит, и более того — число работ, в которых было констатировано повышение уровня мелатонина при депрессии, оказалось также значительным. Например, R. Rubin и соавт.
[24]обнаружили, что как у мужчин, так и у женщин с диагнозом «большое депрессивное расстройство» ночная секреция мелатонина была значительно выше по сравнению со здоровыми. При этом авторы не выявили связи между уров-
нем мелатонина и выраженностью депрессии. В другом исследовании, выполненном A. Wirz-Justice и соавт. [31], было установлено, что у пациентов с депрессией повышено как дневное, так и ночное содержание мелатонина.
В рассматриваемом аспекте большой интерес представляет работа A. Szymanska и соавт. [28], которые определяли степень выраженности депрессивной симптоматики. Они обследовали 2 группы пациентов — с умеренной депрессией (20—29 баллов по шкале депрессии Гамильтона) и с тяжелой депрессией (30—40 баллов). Оказалось, что в группе с тяжелой депрессией содержание дневного мелатонина было значительно выше, чем в группе с умеренно выраженной симптоматикой. Что касается ночной секреции мелатонина, то она была повышена в обеих группах по сравнению со здоровыми. Лечение больных кломипрамином в течение 8 нед привело к существенному снижению среднего уровня мелатонина у пациентов обеих групп, хотя даже при полной ремиссии этот уровень оставался выше по сравнению с таковым у здоровых.
Полученные достаточно противоречивые результаты, по мнению некоторых авторов [2, 30], могут быть объяснены существованием биохимически разных подгрупп депрессии. Поскольку падение или повышение уровня мелатонина происходит параллельно с изменениями уровня серотонина, то по мнению L. Wetterberg [29, 30], это может указывать на два биохимических типа депрессии: первый с низким уровнем только дофамина, второй с понижением уровня дофамина и серотонина. Последний является более тяжелым и пациенты с данным типом депрессии имеют значительно больший суицидальный риск, чем пациенты первого типа. Упомянутый автор подчеркивает, что идентификация этих типов депрессии очень важна для дифференцированной фармакотерапии.
Есть основания предполагать, что в общей популяции пациентов с депрессией существует подгруппа пациентов, имеющих генерализованный дефект эндокринной сферы, центральным нарушением в котором, по-видимому, является дисфункция ГГНС. Нарушения функции эпифиза в этом случае вторичны, хотя нельзя исключать возможность существования пациентов с аффективными расстройствами, обусловленными первичными нарушениями эпифизарных функций. Но генерализованный дефект эндокринной сферы может выражаться нарушениями функций щитовидной железы и гонадной системы [2, 6, 7].
Другим объяснением противоречивости данных о секреции мелатонина у пациентов с депрессией является то, что при этом расстройстве изменяется не столько амплитуда секреции мелатонина, сколько суточный ритм этой секреции.
Анализу ритма секреции мелатонина при депрессии было также посвящено немало исследований. В исследовании Beck (цит. по [27]) было показано, что у больных с депрессией и типичным для таких случаев отсутствием реакции на дексаметазоновый тест наблюдалась тенденция к значительно более раннему пику секреции мелатонина по сравнению с пациентами с нормальной реакцией на указанный тест и со здоровыми. Судя по всему, сдвиг фазы секреции мелатонина является характерной особенностью пациентов с депрессией. Но направленность этого сдвига может быть разной. Так, R. Rubin и соавт. [24] в своем исследовании отмечали тенденцию к задержке пика секреции мелатонина у пациентов с депрессией (максимальная концентрация мелатонина приходилась на время от 3 до 5 ч ночи, тогда как у здоровых испытуемых пик концентрации мелатонина приходится примерно на 2 ч ночи). Но в этой работе было также показано, что у пациентов с депрессией секреция мелатонина начинается раньше, чем у здоровых испытуемых в этих же условиях. Интересно, что у пациентов с биполярным аффективным расстройством в маниакальной фазе наблюдается опережение фазы ритма секреции мелатонина [27].
80 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2007 |

Следует заметить, что изучение нарушений функции эпифиза и хронобиологии депрессивных расстройств длительное время осуществлялось параллельно. Помимо упоминавшихся выше различных нарушений циркадных ритмов и сезонной цикличности аффективных расстройств при депрессии были установлены существенные нарушения суточных ритмов температуры тела, частоты сердцебиений, секреции гормонов (особенно важным является нарушение секреции гормонов ГГНС) [3].
Обобщая результаты проведенных исследований, можно сказать, что одним из основных путей участия мелатонина в возникновении и течении депрессии является его роль во внутренней десинхронизации биоритмов организма. Низкая продукция мелатонина и сдвиг фазы его секреции приводят к рассогласованию циркадных ритмов. Большую роль в этом играет обратная связь эпифиза с СХЯ — недостаточное воздействие мелатонина приводит к укорочению периода ритмоводителя и приводит к десинхронизации.
Вопрос о причинах недостаточности продукции мелатонина у пациентов с депрессией пока остается неясным. Многие исследователи [27, 29, 30] считают, что такая недостаточность может определяться генетической предрасположенностью. Но при этом нужно учитывать, что гипофункция эпифиза может быть вторичной по отношению к гиперфункции ГГНС. Поэтому остановимся на их связи более подробно.
Мелатонин и ГГНС
Выше уже говорилось о том, что взаимодействие мелатонина и ГГНС очень важно для понимания роли первого в патогенезе депрессии. Напомним, что при депрессии имеют место гиперкортизолемия и увеличение надпочечников, измененный суточный ритм, отсутствие реакции на дексаметазоновый тест, уменьшение количества рецепторов кортизола в гиппокампе. При использовании кортиколибериндексаметазонового теста было установлено, что нарушения функции ГГНС отмечаются более чем у 80% пациентов с депрессией. Сказанному соответствует так называемая рецепторная гипотеза, согласно которой нарушение функции ГГНС связано с уменьшением количества тормозных глюкокортикоидных рецепторов в гиппокампе [14].
Âголовном мозге существуют два типа рецепторов к гормонам надпочечников — глюкокортикоидные рецепторы (ГР) и минералокортикоидные рецепторы (МР). Отрицательная обратная связь глюкокортикоидов и ГГНC осуществляется с помощью ГР, расположенных в гипоталамусе и в гипофизе, и координированной работы МР и ГР
âгиппокампе. МР обладают высоким сродством к кортизолу и контролируют как базальную, так и обусловленную стрессом активность ГГНC, тогда как ГР, чье сродство к глюкокортикоидам в 10 раз ниже, чем у МР, должны, как предполагается, быть ответственными за ступенчатость и завершение реакции на стресс, т.е. они тормозят работу ГГНC. Соответственно, при уменьшении количества ГР ингибиторная активность гиппокампа ослабевает, что приводит к нарушению обратной связи и гиперсекреции кортизола [7].
Существуют несколько групп факторов, ответственных за дисбаланс рецепторов к кортизолу. Первая группа — это генетические факторы, ко второй относят факторы, связанные с влиянием длительных стрессовых воздействий, перенесенных в раннем возрасте, т.е. в том периоде развития организма, когда формируются центральные механизмы регуляции деятельности ГГНС. В качестве стрессовых воздействий исследователи выделяют раннюю материнскую депривацию, сексуальное и физическое насилие.
Âуказанный период воздействие высоких концентраций кортизола может приводить к стойкому уменьшению количества глюкокортикоидных рецепторов (ГР), что является фактором риска для возникновения депрессии у взрослых лиц. Таким образом, рецепторная гипотеза сближает
МЕЛАТОНИН И ДЕПРЕССИЯ
биологические и психологические модели возникновения депрессивных расстройств [7].
Э.Б. Арушанян [1] подчеркивает, что у здоровых в спокойном состоянии между эпифизом и корой надпочечников складываются непрочные функциональные связи. При патологическом усилении адренокортикальной активности, которое наблюдается, в частности, при депрессивных расстройствах, эпифизарные влияния приобретают устойчивый сдерживающий характер. Мелатонин в условиях патологии ГГНC начинает ограничивать секрецию глюкокортикоидов, ликвидируя среди прочего поведенческие нарушения.
Таким образом, недостаток секреции мелатонина может быть добавочным звеном к выходу ГГНC из-под контроля при депрессии. Некоторые авторы [4] считают также, что соотношение мелатонин/кортизол может быть использовано для диагностики депрессии — у пациентов с депрессией это соотношение резко снижено.
В то же время нельзя забывать о влиянии гиперактивности ГГНC на эпифиз. Как известно, высокие концентрации кортизола вызывают понижение активности серотонинергической системы и выработки серотонина, что вторич- но приводит к снижению секреции мелатонина. Таким образом, вопрос о том, что первично в патогенезе депрессии
— патология ГГНС или гипофункция эпифиза, остается спорным.
Мелатонин и антидепрессанты и мелатонин как антидепрессант
Значительную роль мелатонина в развитии депрессии подтверждает тот факт, что при терапии антидепрессантами происходят изменения его секреции. Например, было показано, что лечение дезимипрамином в течение 3 нед и имипрамином в течение 2 нед повышает количество и амплитуду секреции мелатонина [27]. R. Sack и A. Lewy [25] выявили значительное повышение уровня 6-сульфатокси- мелатонина (метаболита мелатонина) у депрессивных пациентов. Однако некоторые авторы [27] действия антидепрессантов на секрецию мелатонина не обнаружили.
Как показывают исследования, недостаток норадреналина в синаптической щели в постганглионарных симпати- ческих нервных волокнах, берущих начало в шейном краниальном ганглии, приводит к уменьшению продукции мелатонина в эпифизе. Таким образом, уровень секреции мелатонина может быть важным показателем норадренергической активности до терапии и ее восстановления после терапии антидепрессантами [4, 23]. Следует заметить, что антидепрессанты оказывают выраженное влияние на различные биоритмические процессы, в частности на суточ- ные колебания содержания нейромедиаторов, увеличивают латентный период REM-стадии сна и уменьшают его общую продолжительность. Можно предположить, что этот эффект антидепрессантов связан с их прямым воздействием на эпифиз через модуляцию активности пинеальных β-адренорецепторов. В целом влияние антидепрессантов на функции эпифиза можно охарактеризовать как активирующее [3].
Неоднократно осуществлялись попытки использовать мелатонин в качестве антидепрессанта или корректора нарушений сна при депрессии [8, 12, 13, 15, 18]. Часть из этих работ представлена в таблице. Из нее видно, что такие ожидания не вполне оправдались. Мелатонин либо не оказывал никакого влияния на депрессивную симптоматику, либо его влияние было весьма незначительным, а в одном из исследований было даже отмечено утяжеление симптоматики [12]. Правда, важно отметить, что в этом исследовании мелатонин использовался в дозах, в сотни раз превосходящих физиологические уровни мелатонина в организме. Тем не менее в ряде исследований мелатонин оказывал положительное влияние на нарушения сна [15, 26]. При интерпретации этих данных следует учитывать, что мелатонин как фармакологическое средство может проявлять свою
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2007 |
81 |
ОБЗОРЫ
Плацебо-контролируемые рандомизированные исследования эффективности мелатонина при лечении депрессии
Источник литературы |
Доза мелатонина |
Диагноз по DSM-IV |
Эффект |
|
|
|
|
[12] |
150—1150 ìã/äåíü |
MDD |
Усиление дисфории |
[31] |
5 ìã/äåíü |
SAD |
Отсутствие влияния на симптомы |
|
|
|
депрессии; нарушения сна |
[18] |
10 ìã/äåíü |
Биполярное aффективное |
Эффект не обнаружен |
|
|
расстройство |
|
[15] |
5—10 ìã/äåíü |
MDD |
Улучшение сна; отсутствие влияния |
|
|
|
на симптомы депрессии |
[13] |
5—10 ìã/äåíü |
MDD |
Уменьшение бессонницы на 36%; |
|
|
|
снижение оценок по шкале |
|
|
|
Гамильтона на 20% |
|
|
|
|
Примечание. MDD — большое депрессивное расстройство, SAD — сезонное аффективное расстройство.
эффективность при устранении некоторых других нарушений, например синдрома резкой смены часовых поясов [26].
Возможно, что слабая эффективность терапии мелатонином у пациентов с депрессией может быть связана с тем, что его использование в качестве антидепрессанта требует дифференцированного подхода. Ожидать эффекта от его применения можно с большей вероятностью у тех пациентов, у которых выявляется недостаточность ноч- ной секреции мелатонина, что, естественно, требует предварительной лабораторной диагностики соответствующих сдвигов.
К сказанному выше следует добавить, что использование мелатонина в качестве фармакологического средства связано с рядом серьезных проблем. Во-первых, эффект мелатонина, как никакого другого вещества, варьирует в зависимости от времени его употребления. Во-вторых, мелатонин, являясь гормонально-активным веществом, при длительном употреблении может оказывать неблагоприятное воздействие на состояние эндокринных функций. Поэтому вызывает большие сомнения его использование в ка- честве пищевой добавки, широко практикуемое, например, в США. В связи с этим больший интерес представляет использование не самого мелатонина, а его агонистов. Некоторые из них оказывают более отчетливое антидепрессивное действие, чем мелатонин. Таким агонистом является агомелатин, способный действовать на мелатонинергические рецепторы.
Агомелатин — это новый препарат с уникальным фармакологическим профилем. Это первый антидепрессант, воздействующий на рецепторы мелатонина как агонист (МТ1 и МТ2), обладающий к тому же антагонизмом к 5-НТ2C рецепторам [22].
Воздействие на 5-HT2C рецепторы является очень важным звеном в антидепрессивном эффекте агомелатина. Известно, что 5-HT2C рецепторы встречаются в лобной коре, гиппокампе, базальных ганглиях и других структурах, связанных с аффективным, моторным и когнитивным дефицитом. Многие антидепрессанты, такие как миансерин, миртазапин и амитриптилин, действуют как антагонисты 5-HT2C рецепторов, тогда как ингибиторы обратного захвата серотонина действуют как даун-регуляторы этих рецепторов. В отличие от 5-HT2A è 5-HT2B рецепторов, активация 5-HT2Ñ рецепторов оказывает тоническое ингибирующее влияние на дофаминергические и адренергические пути, активность которых подавлена при депрессии [16, 21]. Кроме того, считается, что 5-НТ2Ñ рецепторы вовлече- ны в формирование тревожной симптоматики как при депрессивных, так и при других психических расстройствах. Это позволяет агомелатину оказывать значительный анксиолитический эффект [16].
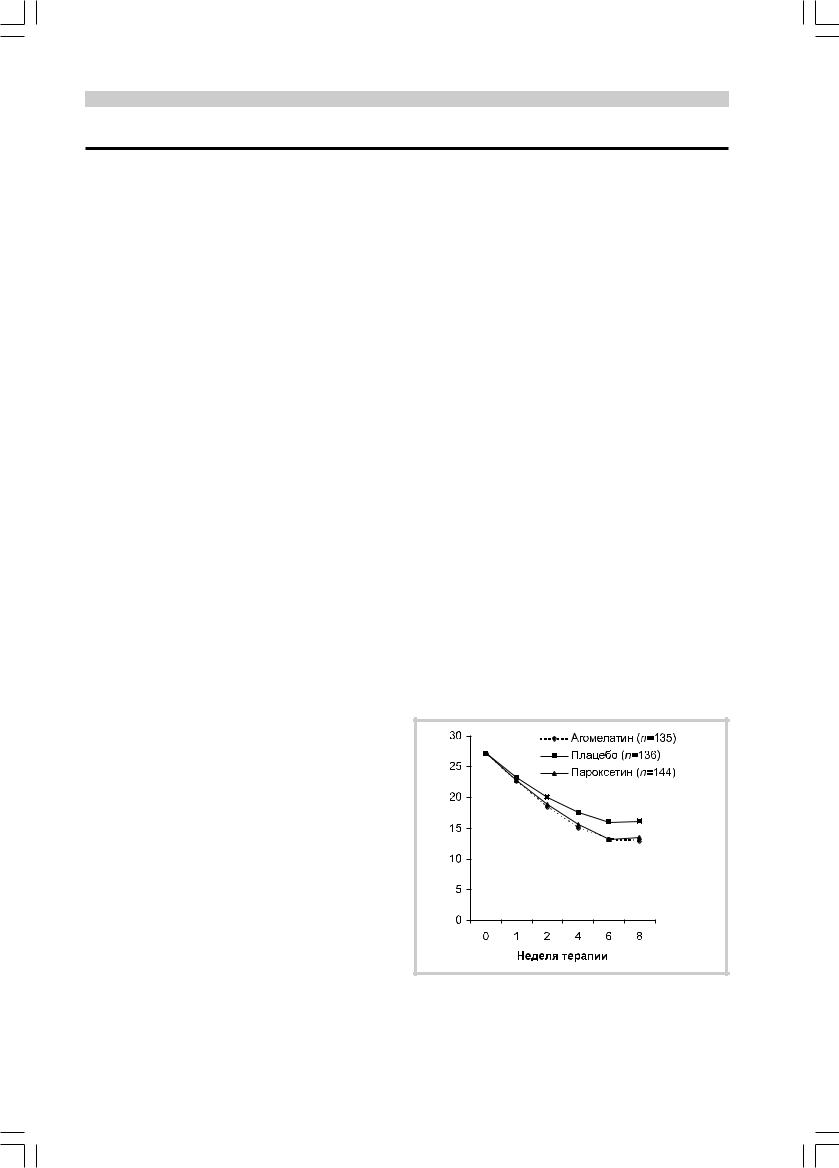
В настоящее время эффективность и безопасность агомелатина активно изучаются. На рисунке приведены данные, полученные в одном из исследований [20].
Эффективность терапии агомелатином в дозе 25 мг в сутки при лечении депрессии была установлена и в других плацебо-контролируемых исследованиях [19, 21].
При терапии агомелатином была обнаружена значительная редукция симптоматики по сравнению с плацебо не только по шкале депрессии Гамильтона, но и шкале общего клинического впечатления (СGI) и шкале депрессии Монт- гомери—Айсберга. Агомелатин также оказывал значительное влияние на тревогу. Интересно, что агомелатин оказался высокоэффективным даже у пациентов с тяжелой депрессией, резистентной к большинству других антидепрессантов [20]. Возможно, что эффективность агомелатина во многом объясняется его двойным воздействием на биологиче- ские механизмы депрессии. Действие агомелатина как агониста к рецепторам мелатонина позволяет оказывать влияние на хронобиологические нарушения, тогда как антагонизм к 5-HT2C рецепторам позволяет активировать нейромедиаторные системы.
Анализ cущeствующей литературы показывает, что мелатонин играет существенную роль в патогенезе депрессии и, возможно, имеет отношение и к этиологии этого рас-
Результаты плацебо-контролируемого исследования эффективности агомелатина (сравнение агомелатина с плацебо и пароксетином) при оценке выраженности депрессии по шкале Гамильтона (баллы по оси ординат).
82 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2007 |

МЕЛАТОНИН И ДЕПРЕССИЯ
стройства. Мелатонин можно считать своего рода маркером хронобиологического дефекта при депрессии. Но такой дефект, равно как и нарушения секреции мелатонина, наблюдается далеко не у всех пациентов и это оправдывает выделение подгруппы пациентов с депрессией, состояние которых характеризуется гормональным дисбалансом, в первую очередь в ГГНС.
Можно условно выделить два основных механизма воздействия мелатонина на настроение и поведение человека. Первый — это регуляция сезонных и циркадных ритмов организма, подразумевающая модуляцию активности и возбудимости ЦНС и уровня обмена нейромедиаторов. Второй
— ингибирование мелатонином ГГНС в условиях ее гиперактивности. Нарушения в этих механизмах могут стать при-
чиной патологических изменений в эмоциональной и поведенческой сферах.
Несмотря на некоторые неудачи и разочарования в попытках применения мелатонина как антидепрессанта, воздействие на его секрецию может стать важным механизмом фармакотерапии депрессии. Это подтверждается применением агомелатина — селективного агониста рецепторов мелатонина и антагониста 5-НТ2Ñ рецепторов. Но тем не менее возможность использования препаратов, влияющих на секрецию мелатонина, оставляет много вопросов, часть из которых определяется зависимостью их эффектов от времени применения.
Âзаключение следует подчеркнуть, что рассмотренная
âнастоящем обзоре проблема требует дальнейшего интенсивного изучения.
ЛИТЕРАТУРА
1.Арушанян Э.Б., Арушанян Л.Г., Эльбекян К.С. Место эпифизарноадренокортикальных отношений в поправочной регуляции поведения. Успехи физиологических наук 1993; 24: 4: 12—29.
2.Арушанян Э.Б. Эпифиз и депрессия. Журн невропатол и психиат 1991; 91: 6: 108—112.
3.Арушанян Э.Б., Чудновский В.С. Депрессия и нарушения суточ- ного ритма. Журн невропатол и психиат 1988; 88: 4: 126—131.
4.Белкин А.И., Лакуста В.И. Биологическая терапия психических заболеваний. Кишинев: Штиица 1983.
5.Ковальзон В.М. Мелатонин без чудес. Природа 2004; 2:
6.Кочетков Я.А., Бельтикова К.В., Горобец Л.Н. Анаболическо-ка- таболический баланс при депрессии: влияние коаксила. Журн невропатол и психиат 2006; 106: 10: 47—52.
7.Кочетков Я.А. Депрессия и гипоталамо-гипофизарно-надпочеч- никовая система: новые стратегии изучения. Современные проблемы психиатрической эндокринологии. М 2004; 161—175.
8.Подвигин С.Н. Клинико-экспериментальные исследования влияния эпифизарного гормона мелатонина на состояние высших психических функций больных невротической депрессией и здоровых лиц. Новые направления в психиатрической эндокринологии. М 1999; 86—90.
9.Судаков К.В. Функциональные системы организма. М: Медицина 1987.
10.Arendt J. Melatonin: a new probe in psychiatric investigation? Br J Psychiat 1989; 155: 585—590.
11.Arendt J. Melatonin, circadian rhytms and sleep. New Engl J Med 2000; 343: 1114—1116.
12.Carman J.S., Post R.S., Buswell R., Goodwin F.K. Negative effects of melatonin on depression. Am J Psychiat 1976; 133: 1181—1186.
13.Dalton E.J., Rotondi D., Levitan R.D. et al. Use of slow-release melatonin in treatment-resistant depression. J Psychiat Neurosci 2000;
25:48—52.
14.Dinan T.G. Glucocorticoids and the genesis of depressive illness: a psychological model. Br J Psychiat 1994; 164: 365—371.
15.Dolberg O.T., Hirschmann S., Grunhaus L. Melatonin for the treatment of sleep disturbances in major depressive disorder. Am J Psychiat 1998; 155: 1119—1121.
16.Jenck F., Bos M., Wichmann J. et al. The role of 5-HT2C receptors in affective disorders. Expert Opin Investig Drugs 1998; 7: 10: 1587— 1599.
17.Hatzinger M. Neuropeptides and the Hypothalamic-Pituitary-Adreno- cortical (HPA) System: review of recent research strategies in depression.World J Biol Psychiat 2000; 1: 105—111.
18.Leibenluft E., Feldman-Naim S., Turner E.H. et al. Effects of exogenous melatonin administration on and withdrawal in five patients
winh rapid-cycling bipolar disorder. J Clin Psychiat 1997; 58: 383 —388.
19.Loo H., Hale A., D’haenen H. Determination of the dose of agomela-
tine, a melatoninergic agonist and selective 5-HT2C antagonist, in the treatment of major depressive disorder: a placebo controlled study. Int Clin Psychopharmacol 2002; 17: 239—249.
20.Loo H., Dalery J., Macher J.P., Payen A. Clinical efficacy of agomelatine in depression: the evidence. Int Clin Psychopharmacol 2006;
21:Suppl 1: S21—24.
21.Martin J.R., Bos M., Jenck F. et al. 5-HT2C receptor agonists: pharmacological characteristics and therapeutic potential. J Pharmacol Exp Ther 1998; 286: 2: 913—924.
22.Millan M.J., Gobert A., Lejeune F. et al. The Novel Melatonin Agonist
Agomelatine (S20098) Is an Antagonist at 5-Hydroxytryptamine2C Receptors, Blockade of Which Enhances the Activity of Frontocortical Dopaminergic and Adrenergic Pathways. J Pharmacol Experim Therapeutics 2003; 15.
23.Pevet P. Melatonin. Dialogues in clinical neuroscience 2002; 4: 1: 57—73.
24.Rubin R.T., Heist E.K., McGeoy S.S. et al. Neuroendocrine aspects of primary endogenous depression. XI. Serum melatonin measures in patients and matched control subjects. Arch Gen Psychiat 1992; 49: 558—569.
25.Sack R.L., Lewy A.J. Desmethylimipramine treatment increases melatonin production in humans. Biol Psychiat 1986; 21: 406—410.
26.Sack R.L., Lewy A.J., Rittenbaum M., Hughes R.J. Chronobiology and melatonin. Psychoneuroendocrinology. In: The scientific basis of clinical practice. O.M. Wolkowitz, A.J. Rothschild (eds.). 2003; 83—107.
27.Srinivasan V., Smits M., Spence W. et al. Melatonin in mood disorders. World J Biol Psychiat 2006; 7: 3: 138—152.
28.Szymanska A., Rabe-Jablonska J., Karasek M. Diurnal profile of melatonin concentrations in patients with major depression: relationship to the clinical manifestation and antidepressant treatment. Neuroendocrinol Lett 2001; 22: 192—198.
29.Wetterberg L. Clinical importance of melatonin. Prog Brain Res 1979;
52:539—547.
30.Wetterberg L. Melatonin and application. Reproduction Nutrition Development 1999; 39: 367—382.
31.Wirz-Justice A., Graw P., Krauchi K. et al. Morning or night-time melatonin is ineffective in seasonal affective disorder. J Psychiat Res 1990; 24: 129—137.
32.Wolkowitz O.M., Epel E.S., Reus V.I. Stress hormone-related psychopathology: pathophysiological and treatment implications. World J Biol Psychiat 2001; 2: 115—143.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2007 |
83 |
