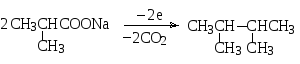- •Краткий курс
- •Карбоновые кислоты и их производные
- •1. Способы получения карбоновых кислот
- •1.1. Реакции окисления
- •1.2. Синтез карбоновых кислот из галогенопроизводных
- •1.2.1.Синтез карбоновых кислот через нитрилы
- •1.2.2. Синтез карбоновых кислот реакцией Гриньяра
- •1.3. Гидролиз производных карбоновых кислот
- •2. Химические свойства карбоновых кислот
- •2.1. Кислотно-основные свойства
- •2.2. Декарбоксилирование карбоновых кислот
- •2.3. Галогенирование карбоновых кислот
- •3. Производные карбоновых кислот
- •3.1. Реакции нуклеофильного замещения: механизм и реакционная способность
- •3.2. Сложные эфиры
- •3.1.1. Способы получения
- •3.1.2. Химические свойства
- •3.3. Галогенангидриды
- •3.4. Ангидриды
- •3.5. Амиды
- •3.5.1. Способы получения
- •3.5.2. Химические свойства
- •3.6. Нитрилы
- •4. Α,β-Ненасыщенные карбоновые кислоты
- •4.1. Способы получения
- •4.2. Химические свойства
- •5. Дикарбоновые кислоты
- •5.1. Способы получения
- •5.2. Свойства дикарбоновых кислот
- •5.3. Малоновый эфир
- •6. Задачи и упражнения
- •1. Способы получения
- •1.1. Восстановление азотсодержащих соединений
- •1.2. Алкилирование аммиака и аминов
- •2. Химические свойства
- •2.1. Основность аминов
- •2.2. Амины как нуклеофилы
- •2.2.1. Алкилирование и ацилирование аминов
- •2.2.2. Взаимодействие первичных и вторичных аминов с альдегидами и кетонами
- •2.2.3. Взаимодействие аминов с азотистой кислотой
- •2.3. Особенности химического поведения ароматических аминов
- •2.3.1. Реакции электрофильного замещения
- •2.3.2. Превращения первичных ароматических аминов через соли арилдиазония
- •3. Задачи и упражнения
2. Химические свойства карбоновых кислот
2.1. Кислотно-основные свойства
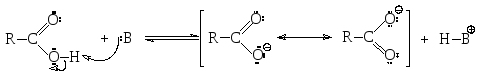
Строение карбоксильной группы предполагает наличие у карбоновых кислот сильных кислотных и слабых основных свойств. Кислотностькарбоновых кислот как О-Н-кислот значительно выше, чем кислотность спиртов. Это объясняется бóльшей устойчивостью соответствующих им сопряженных оснований (карбоксилат-анионов) по сравнению с сопряженными основаниями спиртов (алкоксид-анионов), поскольку карбоксилат-анионы представляют собой частицы, в которых в результате p-π-сопряжения происходит делокализация отрицательного заряда, в то время как в обычных алкоксид-анионах стабилизация за счет сопряжения отсутствует. Поэтому кислотно-основное равновесие карбоновых кислот как О-Н-кислот сильнее сдвинуто вправо по сравнению со спиртами.
p-π-сопряжение в карбоксилат-анионе
Сила карбоновых кислот зависит от степени стабилизации сопряженного основания. Чем больше электронодонорный характер остатка, соединенного с карбоксильной группой, тем менее стабильно сопряженное кислоте основание и тем слабее кислота. Электроноакцепторные заместители уменьшают заряд на атоме кислорода, делая анион более энергетически устойчивым, что приводит к усилению кислотных свойств. Так, например, хлоруксусная кислота является более сильной, чем уксусная кислота. Ниже (табл. 2) приведены значения рКадля некоторых карбоновых кислот, которые иллюстрируют эту зависимость.
ТАБЛИЦА 2
Значения рКa некоторых карбоновых кислот
|
Кислота
|
рКа |
Кислота |
рКа |
|
НСООН |
3,75 |
IСН2СООН |
3,16 |
|
СН3СООН |
4,76 |
BrСН2СООН |
2,90 |
|
СН3СН2СООН |
4,87 |
ClСН2СООН |
2,85 |
|
|
4,17 |
Cl2СНСООН |
1,25 |
|
Cl3ССООН |
0,66 |
В реакциях с основаниями карбоновые кислоты образуют соли, причем как достаточно сильные кислоты они могут реагировать и с сильными, и с относительно слабыми основаниями. В отличие от спиртов карбоновые кислоты реагируют с водными растворами щелочей и с карбонатами металлов. Последняя реакция может являться качественной, поскольку при этом выделяется углекислый газ.
![]()
пропионовая кислота пропионат натрия
![]()
уксусная кислота ацетат натрия
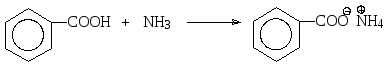
бензойная кислота бензоат аммония
Как достаточно сильные кислоты карбоновые кислоты реагируют с образованием солей и с активными металлами, например, со щелочными и щелочноземельными, а также и с другими металлами, например:
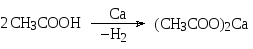
ацетат кальция
Как основания карбоновые кислоты могут реагировать только с очень сильными кислотами, например, с серной кислотой, при этом происходит протонирование по самому оснóвному атому кислорода:

2.2. Декарбоксилирование карбоновых кислот
Декарбоксилированиеозначает деструкцию карбоновой кислоты с удалением карбоксильной группы в виде диоксида углерода.

Наиболее легко протекает декарбоксилирование в тех случаях, когда облегчен гетеролитический разрыв связи R-С, причем карбоксильный атом углерода должен отдать связанные электроны остатку R. Поэтому наличие сильных электроноакцепторных заместителей в остатке R предполагает легкость декарбоксилирования. Действительно, карбоновые кислоты с сильными электроноакцепторными заместителями в α-положении к карбоксильной группе при нагревании до более или менее высокой температуры подвергаются декарбоксилированию. Так, например, при нагревании нитроуксусной кислоты образуется нитрометан, а из пропандиовой (малоновой) кислоты – уксусная кислота.
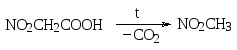
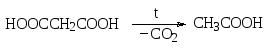
Следует еще упомянуть о рассмотренном ранее декарбоксилировании натриевых солей карбоновых кислот при сплавлении с едким натром, в результате которого образуются алканы. Так, например, при нагревании ацетата натрия с едким натром выделяется метан.
![]()
Кроме того, как способ получения алканов известен электрохимический синтез Кольбе, при котором также происходит декарбоксилирование солей карбоновых кислот при электролизе их растворов или расплавов. Из натриевой соли изомасляной кислоты, например, на аноде получается 2,3-диметилбутан.