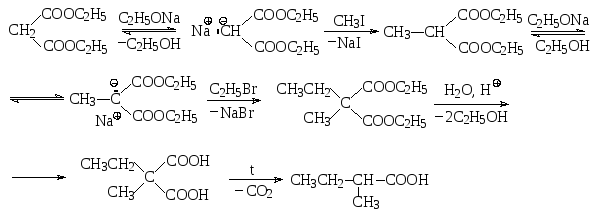- •Краткий курс
- •Карбоновые кислоты и их производные
- •1. Способы получения карбоновых кислот
- •1.1. Реакции окисления
- •1.2. Синтез карбоновых кислот из галогенопроизводных
- •1.2.1.Синтез карбоновых кислот через нитрилы
- •1.2.2. Синтез карбоновых кислот реакцией Гриньяра
- •1.3. Гидролиз производных карбоновых кислот
- •2. Химические свойства карбоновых кислот
- •2.1. Кислотно-основные свойства
- •2.2. Декарбоксилирование карбоновых кислот
- •2.3. Галогенирование карбоновых кислот
- •3. Производные карбоновых кислот
- •3.1. Реакции нуклеофильного замещения: механизм и реакционная способность
- •3.2. Сложные эфиры
- •3.1.1. Способы получения
- •3.1.2. Химические свойства
- •3.3. Галогенангидриды
- •3.4. Ангидриды
- •3.5. Амиды
- •3.5.1. Способы получения
- •3.5.2. Химические свойства
- •3.6. Нитрилы
- •4. Α,β-Ненасыщенные карбоновые кислоты
- •4.1. Способы получения
- •4.2. Химические свойства
- •5. Дикарбоновые кислоты
- •5.1. Способы получения
- •5.2. Свойства дикарбоновых кислот
- •5.3. Малоновый эфир
- •6. Задачи и упражнения
- •1. Способы получения
- •1.1. Восстановление азотсодержащих соединений
- •1.2. Алкилирование аммиака и аминов
- •2. Химические свойства
- •2.1. Основность аминов
- •2.2. Амины как нуклеофилы
- •2.2.1. Алкилирование и ацилирование аминов
- •2.2.2. Взаимодействие первичных и вторичных аминов с альдегидами и кетонами
- •2.2.3. Взаимодействие аминов с азотистой кислотой
- •2.3. Особенности химического поведения ароматических аминов
- •2.3.1. Реакции электрофильного замещения
- •2.3.2. Превращения первичных ароматических аминов через соли арилдиазония
- •3. Задачи и упражнения
5.2. Свойства дикарбоновых кислот
По химическим свойствам дикарбоновые кислоты очень похожи на монокарбоновые кислоты. Однако наличие двух карбоксильных групп придает некоторую специфику этому классу.
Дикарбоновые кислоты, в которых карбоксильные группы расположены достаточно близко друг к другу, проявляют более сильные кислотные свойства, чем монокарбоновые кислоты, за счет электроноакцепторного воздействия карбоксильных групп друг на друга. Так, например, рКащавелевой кислоты составляет 1,27, малоновой – 2,86, янтарной и глутаровой кислот – 4,21 и 4,34, соответственно.
Дикарбоновые кислоты в зависимости от расстояния между карбоксильными группами по-разному ведут себя при нагревании. Щавелевая и малоновая кислоты подвергаются декарбоксилированию с образованием муравьиной и уксусной кислот, соответственно.
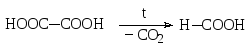

При более отдаленном расположении карбоксильных групп для соответствующих дикарбоновых кислот возникает возможность внутримолекулярной дегидратации с образованием циклических ангидридов. Это происходит, однако, только тогда, когда образующийся цикл является устойчивым. Поэтому такое поведение при нагревании характерно для таких дикарбоновых кислот, ангидриды которых являются пяти- или шестичленными циклическими соединениями, например, для янтарной и глутаровой кислот.

янтарный ангидрид
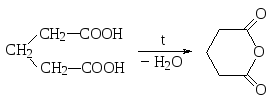
глутаровый ангидрид
По отношению к нагреванию можно различить изомерные малеиновую и фумаровую кислоты. Первая при нагревании отщепляет воду и превращается в малеиновый ангидрид, а вторая из-за транс-расположения карбоксильных групп не способна к такой дегидратации, и с ней при нагревании не происходит никакого химического превращения.
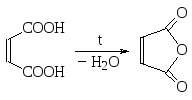
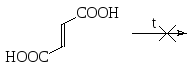
малеиновая малеиновый фумаровая кислота
кислота ангидрид
Из бензолдикарбоновых кислот только фталевая кислота подвергается дегидратации при нагревании.
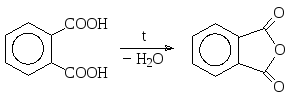
фталевый ангидрид
5.3. Малоновый эфир
Из производных дикарбоновых кислот особое значение имеет диэтиловый эфир малоновой кислоты, который часто называют просто малоновым эфиром. Малоновый эфир получают реакцией этерификации малоновой кислоты с этиловым спиртом.

Малоновый эфир применяют в синтезе многих органических соединений, в том числе и карбоновых кислот, используя при этом его С-Н-кислотные свойства, а также способность малоновой кислоты к декарбоксилированию.
Малоновый эфир является достаточно сильной С-Н-кислотой, поскольку сопряженное ему основание стабилизировано двумя сложноэфирными группами, проявляющими –М-эффект. Депротонировать малоновый эфир можно различными основаниями, например, этилат натрия превращает его в так называемый натрмалоновый эфир.

Натрмалоновый эфир представляет собой С-нуклеофил, который может быть подвергнут алкилированию с помощью алкилгалогенида по механизму SN2 с образованием алкилзамещенного малонового эфира. Этот эфир кислотным гидролизом переводят в алкилзамещенную малоновую кислоту, при нагревании которой в результате декарбоксилирования образуется карбоновая кислота, которую можно рассматривать как алкилзамещенную уксусную кислоту.
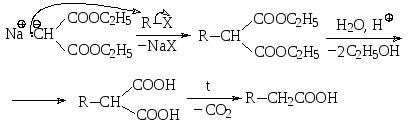
Поскольку алкизамещенный малоновый эфир содержит еще один подвижный атом водорода, то процесс алкилирования можно повторить и получить диалкилзамещенный малоновый эфир. При этом алкилировать можно как тем же алкилгалогенидом, так и другим. В результате после гидролиза и декарбоксилирования можно получить дизамещенную уксусную кислоту. Например, 2-метилбутановую кислоту можно получить из малонового эфира, проалкилировав его дважды – сначала метилгалогенидом, а потом этилгалогенидом.