
- •Краткий курс
- •Карбоновые кислоты и их производные
- •1. Способы получения карбоновых кислот
- •1.1. Реакции окисления
- •1.2. Синтез карбоновых кислот из галогенопроизводных
- •1.2.1.Синтез карбоновых кислот через нитрилы
- •1.2.2. Синтез карбоновых кислот реакцией Гриньяра
- •1.3. Гидролиз производных карбоновых кислот
- •2. Химические свойства карбоновых кислот
- •2.1. Кислотно-основные свойства
- •2.2. Декарбоксилирование карбоновых кислот
- •2.3. Галогенирование карбоновых кислот
- •3. Производные карбоновых кислот
- •3.1. Реакции нуклеофильного замещения: механизм и реакционная способность
- •3.2. Сложные эфиры
- •3.1.1. Способы получения
- •3.1.2. Химические свойства
- •3.3. Галогенангидриды
- •3.4. Ангидриды
- •3.5. Амиды
- •3.5.1. Способы получения
- •3.5.2. Химические свойства
- •3.6. Нитрилы
- •4. Α,β-Ненасыщенные карбоновые кислоты
- •4.1. Способы получения
- •4.2. Химические свойства
- •5. Дикарбоновые кислоты
- •5.1. Способы получения
- •5.2. Свойства дикарбоновых кислот
- •5.3. Малоновый эфир
- •6. Задачи и упражнения
- •1. Способы получения
- •1.1. Восстановление азотсодержащих соединений
- •1.2. Алкилирование аммиака и аминов
- •2. Химические свойства
- •2.1. Основность аминов
- •2.2. Амины как нуклеофилы
- •2.2.1. Алкилирование и ацилирование аминов
- •2.2.2. Взаимодействие первичных и вторичных аминов с альдегидами и кетонами
- •2.2.3. Взаимодействие аминов с азотистой кислотой
- •2.3. Особенности химического поведения ароматических аминов
- •2.3.1. Реакции электрофильного замещения
- •2.3.2. Превращения первичных ароматических аминов через соли арилдиазония
- •3. Задачи и упражнения
1. Способы получения
1.1. Восстановление азотсодержащих соединений
Как алифатические, так и ароматические нитросоединенияможно восстановить до соответствующихпервичныхаминов:
![]()
В качестве восстановителей могут быть использованы самые разнообразные вещества. Так, классический способ получения анилина по Зинину – это восстановление нитробензола сульфидом натрия. В настоящее время в промышленности анилин получают каталитическим гидрированием нитробензола:
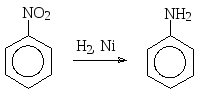
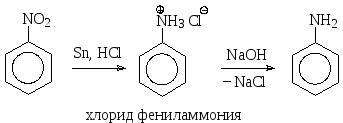
В лабораторных условиях удобнее восстанавливать нитросоединения водородом в момент выделения, т.е. использовать в качестве восстановительной системы достаточно активный металл в кислой среде. Например, анилин получают действием на нитробензол олова в соляной кислоте. Образующийся при восстановлении анилин в кислой реакционной среде существует в виде солянокислой соли, которую по завершении реакции переводят в анилин действием щелочи.
Кроме нитросоединений первичные амины могут быть получены восстановлением таких производных альдегидов и кетонов, как оксимы, гидразоны и имины.

Альдегидыикетонымогут быть превращены в первичные амины в одну стадиювосстановительнымаминированием– действием аммиака и водорода на никелевом катализаторе.
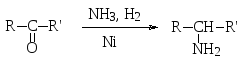
Нитрилыкарбоновых кислот восстанавливаются в условиях каталитического гидрирования до первичных аминов.
![]()
Амидыкарбоновых кислот восстанавливаются алюмогидридом лития до соответствующих аминов (первичных,вторичных,третичных):

1.2. Алкилирование аммиака и аминов
Первичныеамины могут быть получены алкилированием аммиака как нуклеофила. В качестве алкилирующих реагентов обычно используются галогенопроизводные. При взаимодействии алкилгалогенида с аммиаком образуется галогенид алкиламмония, который в избытке аммиака депротонируется до свободного амина.
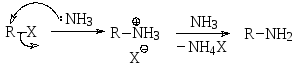
Вторичныеамины синтезируют алкилированием первичных аминов галогенопроизводными. Так, например, N-метиланилин можно получить действием на анилин метилиодида с последующей обработкой образующегося иодида метилфениламмония едким натром.

Т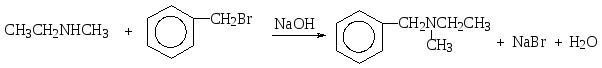 ретичныеамины можно получить аналогичным образом
из вторичных аминов, например:
ретичныеамины можно получить аналогичным образом
из вторичных аминов, например:
метилэтиламин N-метил-N-этилбензиламин
2. Химические свойства
2.1. Основность аминов
Как и аммиак, амины проявляют основные свойства благодаря тому, что на атоме азота имеется необходимая для присоединения протона неподеленная пара электронов.

Электроотрицательность атома азота не столь высока, как у атома кислорода, поэтому основность аминов выше по сравнению со спиртами или фенолами.
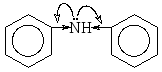
Основность аминов зависит от электронной плотности на атоме азота. Алифатические амины проявляют более сильные основные свойства, чем аммиак, поскольку алкильные группы являются более сильными донорами электронов по сравнению с атомом водорода. По этой же причине вторичные амины более основны, чем первичные. Ароматические амины как основания являются более слабыми, чем алифатические амины, из-за сопряжения неподеленной пары электронов атома азота с π-электронной системой ароматического кольца. Так, основность анилина ниже, чем основность циклогексиламина, а дифениламин уступает по основности анилину, поскольку в этом случае наблюдается сопряжение неподеленной пары электронов атома азота уже с двумя бензольными остатками.

< <
Заместители в ароматическом кольце влияют на основность ароматического амина. Электронодонорные заместители повышают основность, так как через бензольное ядро увеличивают электронную плотность на атоме азота. Электроноакцепторные заместители, наоборот, понижают основные свойства ароматических аминов. Так, в ряду пара-толуидин, анилин,пара-нитроанилин основность уменьшается, поскольку метильная группа впара-толуидине является электронодонорным заместителем (+I-эффект), а нитрогруппа – электроноакцепторным заместителем (–I- и –М-эффекты).

> >
При взаимодействии аминов с сильными кислотами образуются аммониевые соли. Так, анилин, который плохо растворяется в воде, растворяется в соляной кислоте, поскольку при этом он превращается в хлорид фениламмония (или солянокислый фениламмоний), хорошо растворимый в воде, как и многие ионные соединения.
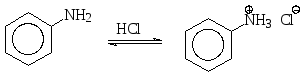
хлорид фениламмония
