
- •176 Программа блока гетерофункциональные углеводороды.
- •Конспект лекций гетерофункциональные углеводороды
- •Углеводы
- •1.1 Моноуглеводы
- •Химическое строение моносахаридов
- •1. Реакции карбонильных форм моносахаридов
- •2.2 Реакции с участием всех гидроксильных групп
- •Олигосахариды
- •1.2.1 Дисахариды
- •1.2.3 Несахароподобные полисахариды
- •1.2.3.1 Гомополисахариды
- •1.2.3.2 Гетерополисахариды
- •2. Аминокислоты
- •(Nh2)m r(cooh)n,
- •2. Получение β-аминокислот
- •3.2.Перегруппировка оксимов (перегруппировка Бекмана):
- •1,1-Амидные группы
- •Оксикислоты
- •7. Синтез из альдегидов
- •1.3 Реакции нуклеофильного замещения α-галогенкарбоновых кислот.
- •4. Гетероциклические соединения
- •4.1 Пятичленные гетероциклы с одним гетероатомом
- •6. Реакция диенового синтеза с малеиновым ангидридом
- •2. Пиролизом:
- •1. Сухой перегонкой аммонийной соли слизевой кислоты или действием аммиака на фуран в присутствии оксида алюминия:
- •3. Получают при пропускании аммиака и паров бутиндиола-1,4 над катализатором при 300с:
- •4. При перегонке сукцинимида с цинковой пылью:
- •5. Восстановление смеси кетона с изонитрозокетона даёт гомологи или замещенные пирролы:
- •3. Реакция электрофильного замещения (механизм и ориентация замещения):
- •1. Индол обладает слабоосновными свойствами и в то же время слабокислыми, образует металлические производные – индол-калий, индол-натрий:
- •4.2 Пятичленные гетероциклы с несколькими гетероатомами
- •4.3 Шестичленные гетероциклы с одним гетероатомом
- •4.4 Шестичленные гетероциклы с несколькими гетероатомами
- •1. Основные свойства:
- •2. Свойства, обусловленные функциональными группами, в том числе групповые реакции:
- •4.4 Шестичленные гетероциклы с двумя разными гетероатомами
- •Нобелевские премии по органической химии
1. Реакции карбонильных форм моносахаридов
1.1 Окисление. Реакции окисления используют в структурных исследованиях и биохимических анализах для обнаружения моносахаридов. Монозы легко окисляются, причем в зависимости от условий окисления образуются различные продукты. Окисление альдоз без деструкции (разрушения) углеродного скелета проводят в нейтральной или кислой среде и получают различные кислоты.
1.1.1 При использовании мягких окислителей типа бромной воды, гипохлоритов, разбавленной азотной кислоты окисляется только альдегидная группа и образуются гликоновые (альдоновые) кислоты:

1.1.2 С помощью сильного окислителя– концентрированной азотной кислоты – концевые группы альдоз (альдегидная и первичноспиртовая) одновременно окисляются в карбоксильные группы, образуя гликаровые кислоты (называемые также сахарными):

Получающаяся из D-галактозы галактаровая (слизевая) кислота трудно растворима в воде, что используется для обнаружения галактозы методом окисления ее азотной кислотой.
1.1.3 Избирательное окисление первичной спиртовой группы, если предварительно защитить склонную к окислению альдегидную группу (например, превращением альдозы в гликозид), то становится возможным избирательное окисление первичной спиртовой группы и образуются гликуроновые (уроновые) кислоты:
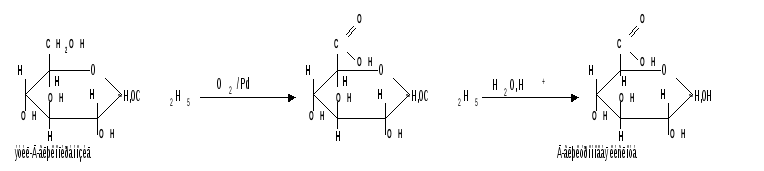
Уроновые кислоты при нагревании их солей с металлами (никель, магний) подвергаются декарбоксилированию. При этом из гексуроновых кислот образуются пентозы. В организме за счет ферментативной реакции декарбоксилирования D-глюкуроновой кислоты получается D-ксилоза:
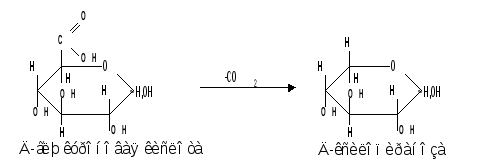
Приведенная реакция показывает генетическую связь пентоз с гексозами, являющимися продуктами фотосинтеза. Пектиновые вещества плодов и ягод представляют собой продукты поликонденсации D-галактуроновой кислоты. Уроновые кислоты выполняют в организме важную функцию – они образуют с лекарственными веществами, их метаболитами, токсичными веществами водорастворимые гликозиды и выводят их из организма.
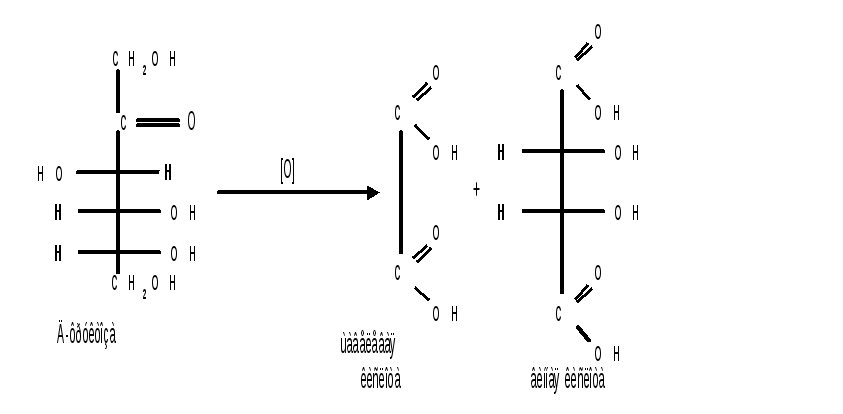
1.1.4 Окисление кетоз. Кетозы не окисляются слабыми окислителями. При действии сильных окислителей происходит расщепление молекул. Так, например, при окислении фруктозы получаются винная и щавелевая кислоты:
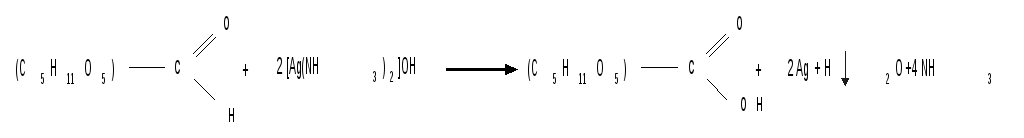
1.1.5 Реакция Толленса. Слабые окислители в щелочной среде (аммиачный раствор оксида серебра, соединения Сu2+) превращают монозы в сложную смесь продуктов окисления и служат для качественного и количественного определения альдоз и кетоз. Подобно обычным альдегидам, альдозы легко дают реакцию “серебряного зеркала” с аммиачным раствором оксида серебра (реактив Толленса):
1.1.6 Окисление реактивом Фелинга. При нагревании реактива Фелинга (смесь равных обьемов водного раствора сульфата меди и щелочного раствора натрий-калиевой соли винной кислоты) в присутствии альдозы выпадает красный осадок Сu2О. Реакцию используют для количественного определения сахаров:

Кетозы тоже способны восстанавливать катионы металлов, так как они в щелочной среде изомеризуются в альдозы.
1.2 Восстановление. При восстановлении моноз образуются многоатомные спирты, называемые альдитами (глицитами). Эти кристаллические, легко растворимые в воде вещества обладают сладким вкусом и часто используются как заменители сахара (ксилит, сорбит):
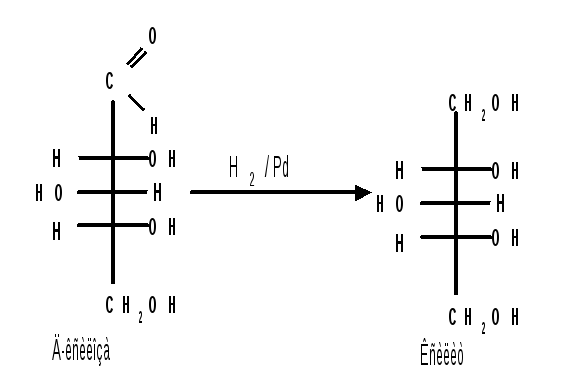
Восстановление моносахаридов проводят водородом в присутствии металлических катализаторов (Pd, Ni). Шестиатомные спирты – глюцит (сорбит), дульцит и маннит – получаются при восстановлении соответственно глюкозы, галактозы и маннозы. Восстановление глюкозы в сорбит является одной из стадий промышленного синтеза аскорбиновой кислоты. При восстановлении альдоз получается лишь один полиол, кетоз – смесь двух полиолов. Например, при восстановлении D-фруктозы борогидридом натрия NaBН4 образуются D-глюцит (сорбит) и D-маннит:
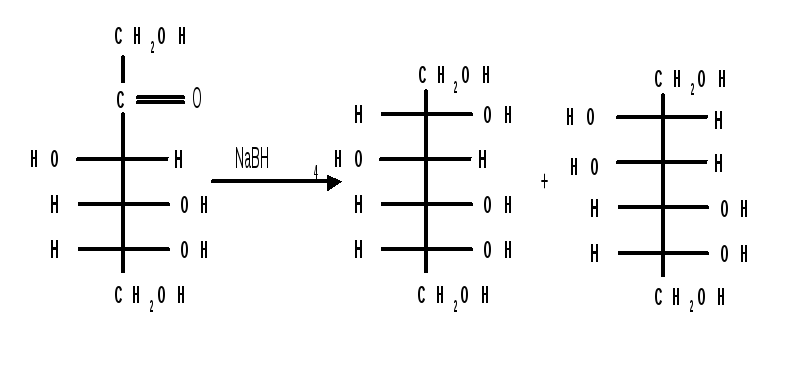
-
D-фруктоза
D-глюцит
D-маннит
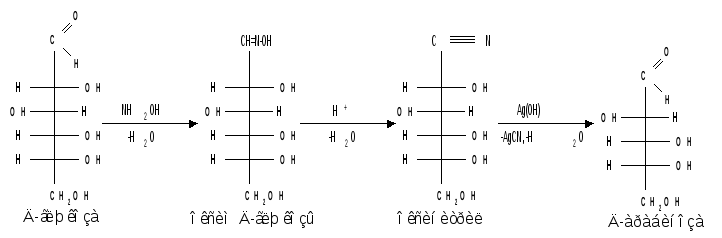
1.3 Присоединение синильной кислоты. Монозы присоединяют синильную кислоту, образуя нитрилы высших глюконовых кислот (Килиани, 1887):
![]()
Этим методом можно удлинять углеродную цепь и переходить от низших моносахаридов к высшим (см. способы получения моноз).
1.4 Действие гидроксиламина. Реакция с гидроксиламином используется для установления строения сахаров и для перехода от высших моносахаридов к низшим:
1.5 Действие фенилгидразина. Одной из наиболее важных реакций, которая позволяет выделять в чистом виде отдельные монозы, а также устанавливать тождество моноз различного происхождения, является взаимодействие моноз с фенилгидразином. Сначала фенилгидразин действует на монозы так же, как на простейшие альдегиды и кетоны, т. е. с выделением воды и образованием фенилгидразона:
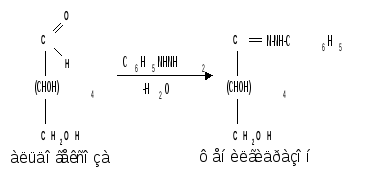
Затем при нагревании полученного гидразона с фенилгидразином соседняя с карбонильной группой первичная или вторичная спиртовая группа окисляется в карбонильную, причем фенилгидразин восстанав-ливается до анилина и аммиака. Вновь образовавшаяся карбонильная группа (для кетоз – альдегидная, а для альдоз – кетонная) вступает в реакцию с третьей молекулой фенилгидразина и получается озазон монозы:
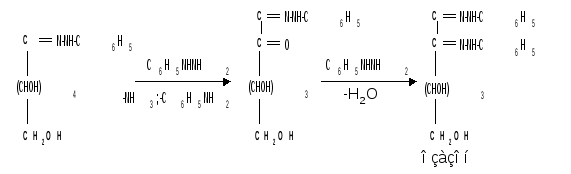
Из альдоз и кетоз могут получиться озазоны одинакового строения. Поскольку реакция образования озазона затрагивает только углероды С1 и С2 моносахаридов, то, следовательно, эпимерные альдозы и изомерные им кетозы дают один и тот же озазон. Озазоны представляют собой кристаллические вещества, трудно растворимые в воде, благодаря чему их легко выделить в кристаллическом виде из водных растворов моноз:
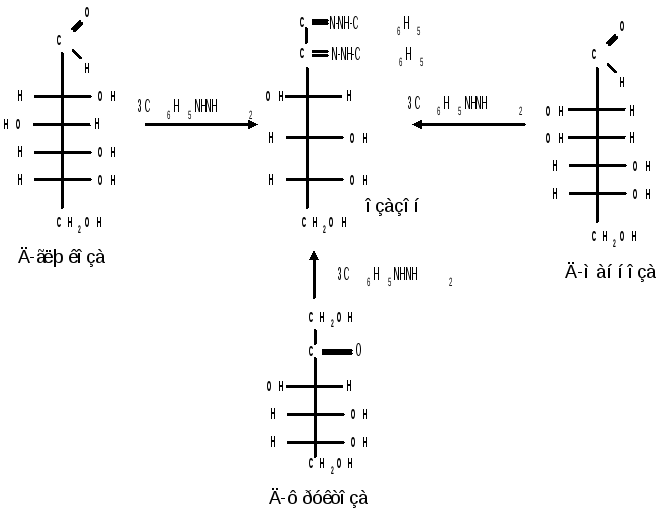
Озазоны при действии кислот гидролизуются в озоны:
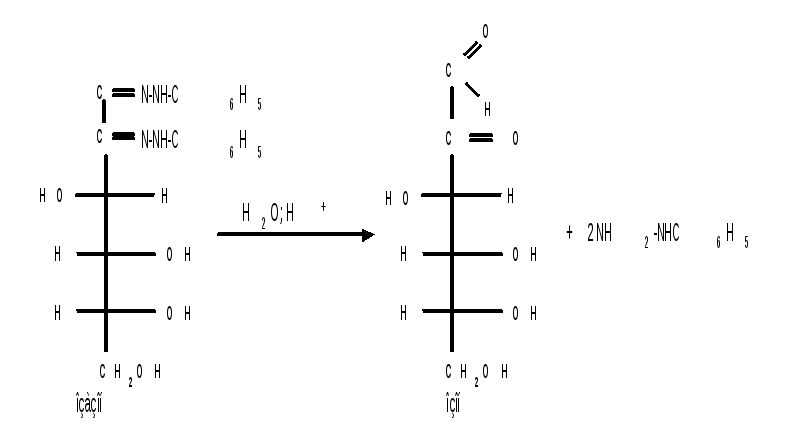
При восстановлении озонов амальгамой натрия в слабокислой среде происходит избирательное восстановление альдегидной группы до первичной спиртовой группы. Этим методом можно осуществлять переход от альдоз к кетозам через озазоны и озоны:
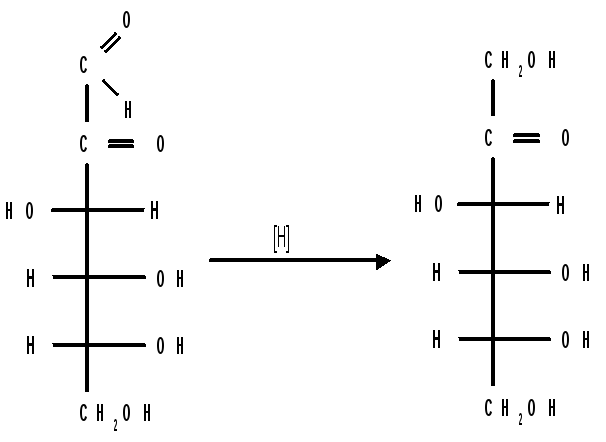
-
озон
кетогексоза
1.6 Действие щелочей. В разбавленных растворах щелочей при комнатной температуре происходит изомеризация моносахаридов, т. е. получение из одного моносахарида равновесной смеси моноз, отличающихся конфигурацией первого и второго атомов углерода. Процесс изомеризации проходит через стадию образования промежуточного продукта – ендиола, который для глюкозы, маннозы и фруктозы является общим:
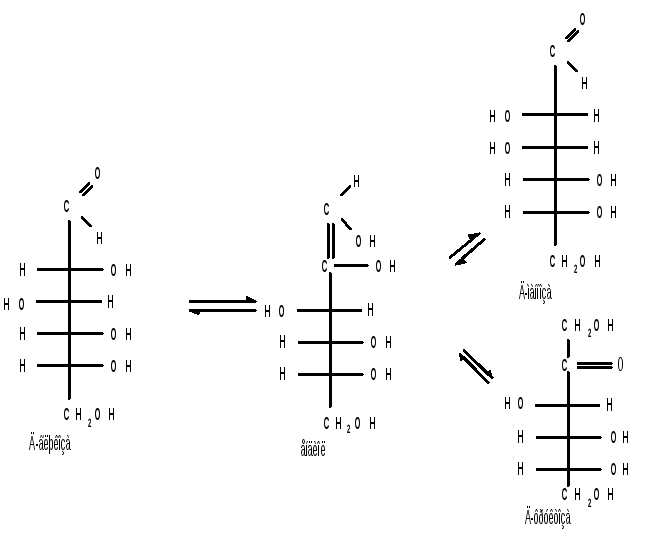
Происходящие при этих превращениях изменения конфигурации у второго углеродного атома альдоз носит название эпимеризации, а альдозы, отличающиеся лишь конфигурацией второго углеродного атома, называются эпимерами.
Способностью альдоз и кетоз к взаимному переходу друг в друга в слабощелочной среде обьясняются некоторые необычные свойства фруктозы, в частности – способность к положительным реакциям с реактивом Толленса и фелинговой жидкостью.
Превращение 6-фосфата-D-глюкопиранозы в 6-фосфат-D-фруктозы протекает в организме под действием фермента фосфоглюкоизомеразы и является одной из стадий катаболизма глюкозы.
2. Реакции с участием гидроксильных групп. Гидроксильные группы имеются в открытых и циклических формах моноз, но содержание циклических форм значительно выше, поэтому реакции идут в циклических ( полуацетальных ) формах:
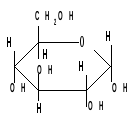
Гидроксилы отличаются по реакционной способности: при С1 –гликозидный (наиболее реакционноспособный); при С6 – первичный; при С2-С4 – вторичные.
2.1 Реакции с участием гликозидного гидроксила. При взаимодействии моносахаридов с гидроксилсодержащими соединениями (спиртами, фенолами и др.) в условиях кислотного катализа образуются производные только по гликозидной ОН-группе – циклические ацетали, называемые гликозидами. Cпиртовые гидроксилы моноз в этих условиях не реагируют.
В зависимости от размера оксидного цикла гликозиды делятся на пиранозиды и фуранозиды. Ацетали глюкозы называют глюкозидами, рибозы – рибозидами, фруктозы – фруктозидами и т.п. (окончание «оза» монозы заменяется на «озид»). Растворы гликозидов не мутаротируют.
Удобным способом получения гликозидов является пропускание газообразного хлороводорода ( катализатор ) через раствор моносахарида в спиртах, например, этаноле, метаноле и т. д. При этом соответственно получаются этил- или метилгликозиды. В названии гликозидов указываются сначала наименования введенного радикала, затем конфигурация аномерного центра и название углеводного остатка с суффиксом «озид».
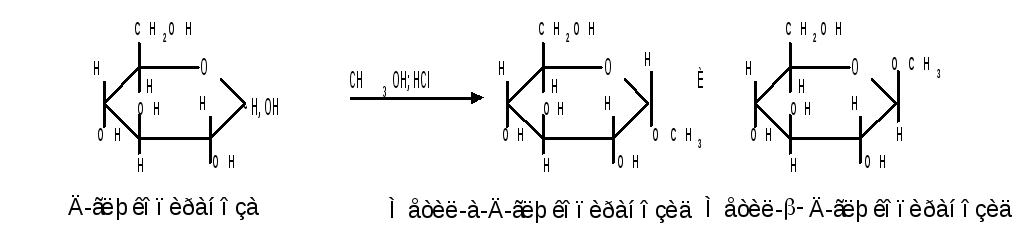
Вследствие таутомерии и обратимости реакции образования гликозида в растворе в равновесии в общем случае могут находиться таутомерные формы исходного моносахарида и соответственно 4 диастереомерных гликозида (-и-аномеры фуранозидов и пиранозидов).
Гликозиды легко гидрализуются разбавленными кислотами, но проявляют устойчивость к гидролизу в слабощелочной среде. Более напряженные пятичленные циклы фуранозидов расщепляются гидролитическим путем быстрее пиранозидов. Гидролиз гликозидов в кислой среде приводит к соответствующим спиртам и моносахаридам и представляет собой реакцию, обратную их образованию.
Для гидролитического расщепления гликозидов широко применяется ферментативный гидролиз, преимущество которого заключается в его специфичности. Например, фермент -глюкозидаза из дрожжей расщепляет только -глюкозидную связь. На этом основании ферментативный гидролиз часто применяется в целях установления конфигурации аномерного атома углерода. Гидролиз гликозидов лежит в основе гидролитического расщепления полисахаридов, осуществляемого в организме, а также используется во многих промышленных процессах.
Молекулу гликозида формально можно представить состоящей из двух частей – углеводной и агликоновой. В роли гидроксилсодержащих агликонов могут выступать и сами моносахариды. Гликозиды, образованные с ОН- содержащими агликонами, называют О-гликозидами. В свою очередь гликозиды, образованные с NH-содержащими соединениями (например, аминами), называют N-гликозидами. К ним принадлежат нуклеозиды, имеющие важное значение в химии нуклеиновых кислот.
