- •176 Программа блока гетерофункциональные углеводороды.
- •Конспект лекций гетерофункциональные углеводороды
- •Углеводы
- •1.1 Моноуглеводы
- •Химическое строение моносахаридов
- •1. Реакции карбонильных форм моносахаридов
- •2.2 Реакции с участием всех гидроксильных групп
- •Олигосахариды
- •1.2.1 Дисахариды
- •1.2.3 Несахароподобные полисахариды
- •1.2.3.1 Гомополисахариды
- •1.2.3.2 Гетерополисахариды
- •2. Аминокислоты
- •(Nh2)m r(cooh)n,
- •2. Получение β-аминокислот
- •3.2.Перегруппировка оксимов (перегруппировка Бекмана):
- •1,1-Амидные группы
- •Оксикислоты
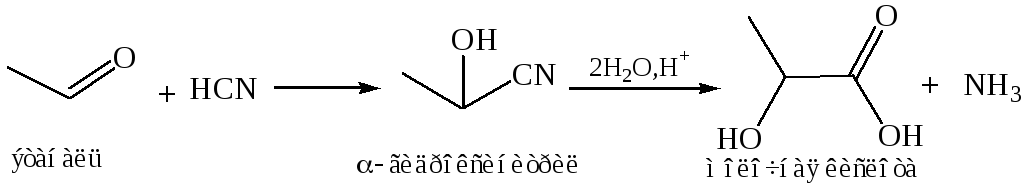
- •7. Синтез из альдегидов
- •1.3 Реакции нуклеофильного замещения α-галогенкарбоновых кислот.
- •4. Гетероциклические соединения
- •4.1 Пятичленные гетероциклы с одним гетероатомом
- •6. Реакция диенового синтеза с малеиновым ангидридом
- •2. Пиролизом:
- •1. Сухой перегонкой аммонийной соли слизевой кислоты или действием аммиака на фуран в присутствии оксида алюминия:
- •3. Получают при пропускании аммиака и паров бутиндиола-1,4 над катализатором при 300с:
- •4. При перегонке сукцинимида с цинковой пылью:
- •5. Восстановление смеси кетона с изонитрозокетона даёт гомологи или замещенные пирролы:
- •3. Реакция электрофильного замещения (механизм и ориентация замещения):
- •1. Индол обладает слабоосновными свойствами и в то же время слабокислыми, образует металлические производные – индол-калий, индол-натрий:
- •4.2 Пятичленные гетероциклы с несколькими гетероатомами
- •4.3 Шестичленные гетероциклы с одним гетероатомом
- •4.4 Шестичленные гетероциклы с несколькими гетероатомами
- •1. Основные свойства:
- •2. Свойства, обусловленные функциональными группами, в том числе групповые реакции:
- •4.4 Шестичленные гетероциклы с двумя разными гетероатомами
- •Нобелевские премии по органической химии
Оксикислоты
Оксикислотами называются карбоновые кислоты, в которых на ряду с карбонильной группой содержится гидроксильная группа.
Классификация оксикислот, как и других бифункциональных соединений, основана:
на взаимном расположении функциональных групп;
природе углеводородного радикала;
количестве функциональных групп.
Номенклатура оксикислот.
тривиальная;
полутривиальная;
систематическая
Изомерия оксикислот
Структурная:
скелетная;
изомерия взаимного положения;
метамерия.
Пространственная:
оптическая.
Способы получения оксикарбоновых кислот.
Гидролиз α-галогенкарбоновых кислот
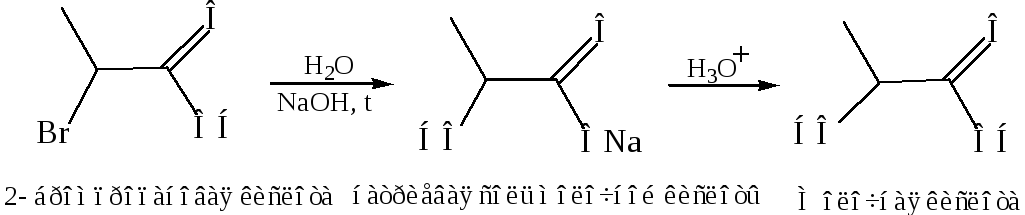
Реакции присоединения к α, β-ненасыщенным кислотам:

Циангидринный синтез. Из кетонов и альдегидов α-гидроксикислоты получают с промежуточным образованием циангидринов:
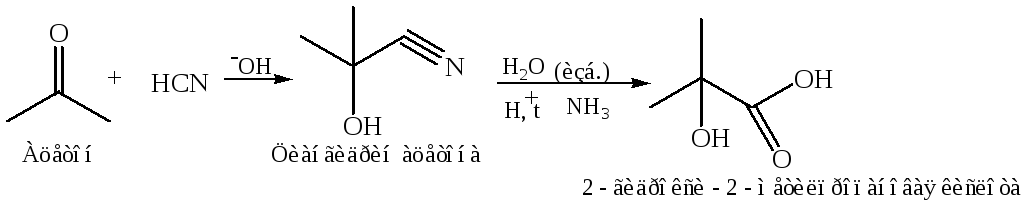
Реакция Реформатского (1887 г.). в своей первоначальной форме заключалась во взаимодействии цинка с эфиром α-галогенкарбоновой кислоты и карбонильным соединением, приводящем к соответствующему эфиру α-гидроксикислоты или продукту его дегидратации. Последний обычно является эфиром ненасыщенной кислоты, хотя иногда образуются и некоторые количества ненасыщенного изомера.
Полагают, что во всех этих реакциях первоначально образуются промежуточные галогенцинкорганические соединения (Br, Zn, CH2, CО2) в оригинальном варианте реакции Реформатского, которые затем присоединяются к карбонилу или подобной группе аналогично реактиву Гриньяра. Действительно, цинкорганпческне промежуточные соединения, образующиеся при реакции цинка с эфирами α-бромкислот, были выделены, однако строение их не было доказано. Имеются доказательства, что соединения этого типа могут существовать преимущественно в форме фенолятов, особенно в слабосольватирующей среде, хотя они почти исключительно реагируют как соединения со связью углерод-цинк. Известны, однако, и исключения из этого правила.
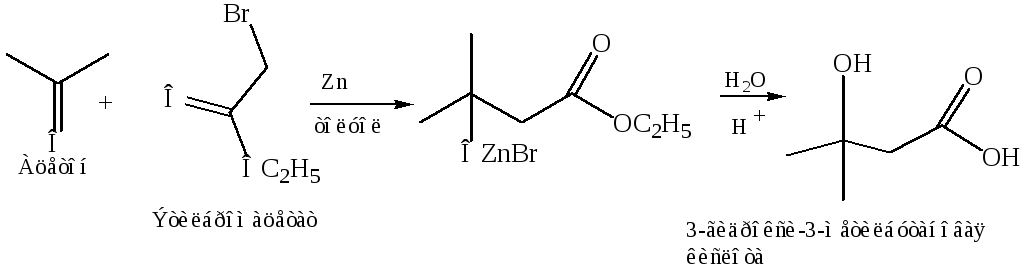
В ходе реакции образуются цинкорганическое соединение, которое, будучи сильным нуклеофилом, присоединяется по карбонильной группе кетона.
Окисление непредельных кислот по Вагнеру
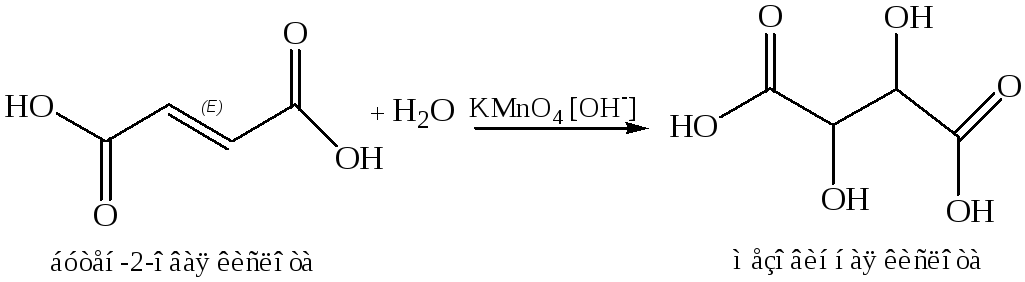
Брожение сахаров
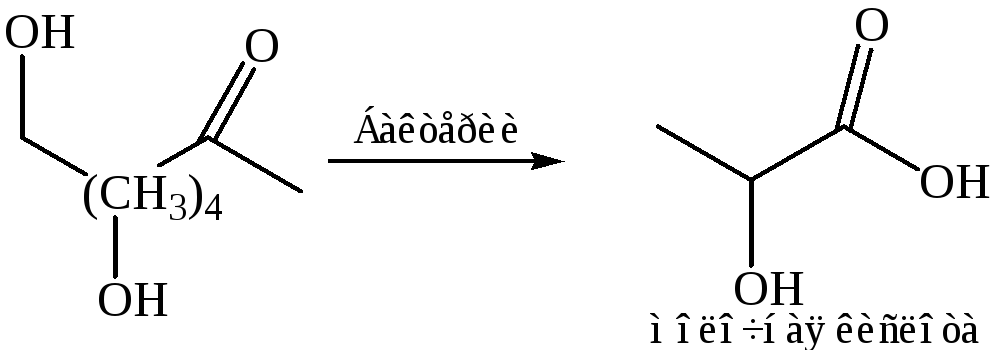
7. Синтез из альдегидов
Cинтез из ненасыщенных кислот.
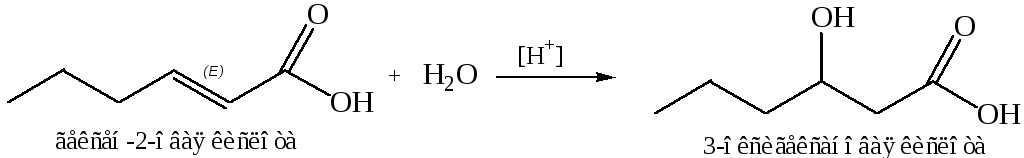
Дегидратация (образование лактона). Для оксикислот разных типов дегидратация протекает различным образом: характер образующегося из данной кислоты продукта зависит от положения ОН-группы относительно СООН-группы.
Выше уже говорилось о том, что β-оксикислоты ( подобно β-оксиальдегидам или β-оксикетонам) легко отщепляют воду, давая непредельные соединения. Дегидратация может происходить при нагревании с кислотой; многие соединения теряют воду спонтанно, при перегонке:
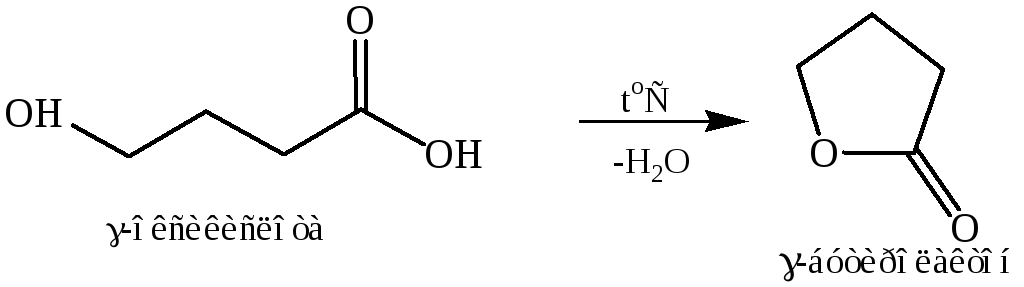
Основным продуктом обычно является α, β-непридельное соединение, получается также значительное количество β, g-непридельного соединения. Чистые α, β- непридельные кислоты лучше получать дегидрогалогенированием α-галогенкислот.
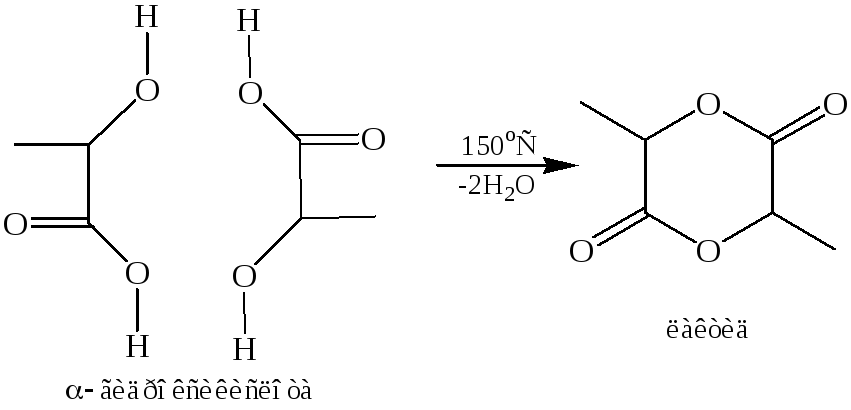
Реакция этерификации α-оксикислот. При нагревании α-оксикислоты она отщепляет воду и вступает в реакцию этерификации, которая осуществляется таким образом, что образуется шестичленное кольцо. Получающийся продукт называют лактидом:
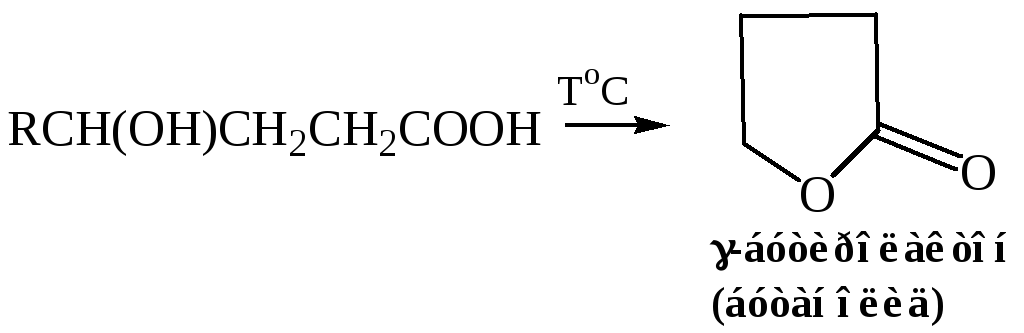
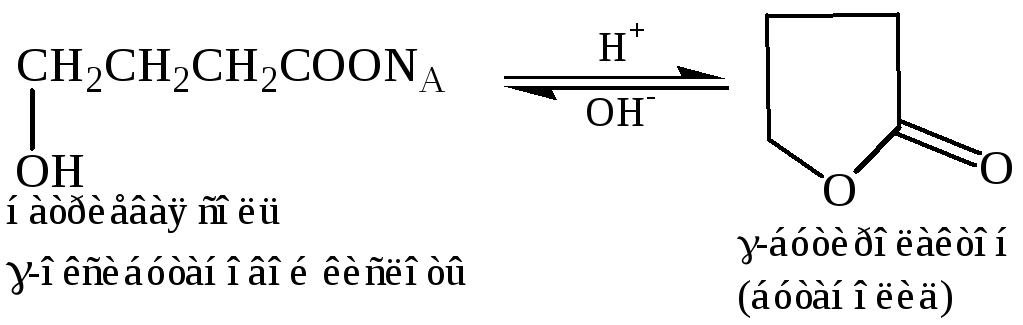
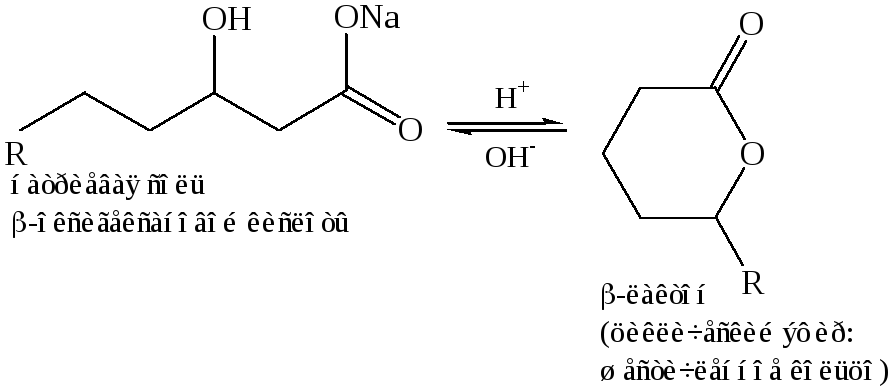
Реакция этерификации γ, δ-оксикислот, реакция происходит внутримолекулярно и дает циклический эфир, известный под названием лактона. В этом случае ход реакции так же определяется тенденцией к образованию пяти- или шестичленных циклов. Лактонизация происходит спонтанно, и образуется равновесная смесь, состоящая в основном из лактона: при обработке этой смеси основанием лактонное кольцо раскрывается с образованием ациклической соли:
Получение фенилкарбоновых кислот (метод Кольбе):
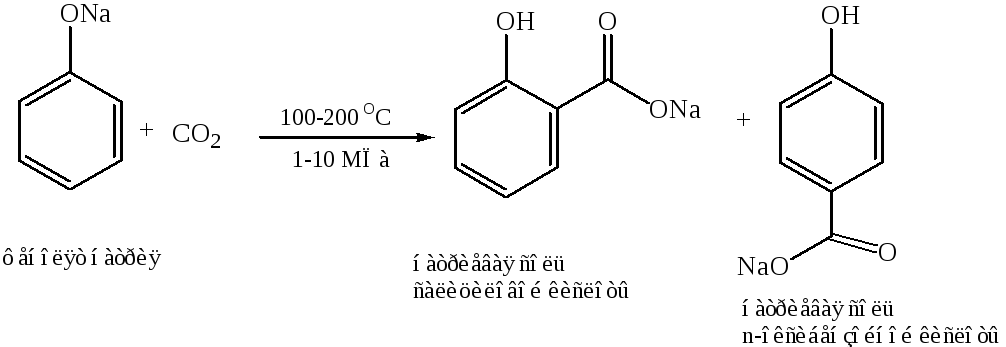

Получение дикарбоновых кислот:

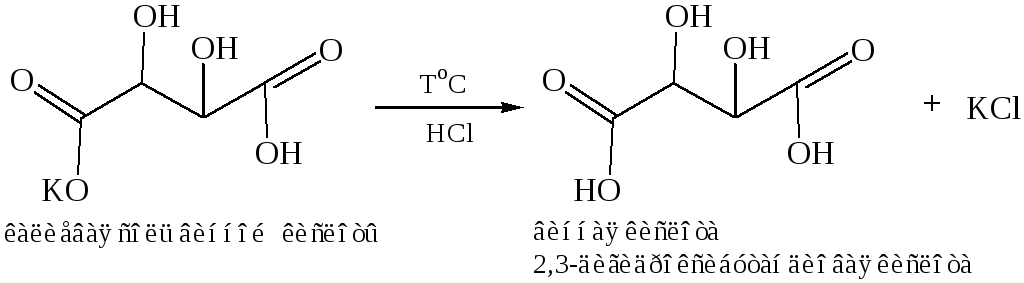
Получение диоксикарбоновых кислот, винная кислота была выделена из “винного камня” – осадка, выпадающего в бочках при изготовлении виноградного вина.
Физические свойства оксикислот
Таблица – 1. Основные свойства оксикислот
-
Название кислоты
Ткип, ⁰С
Кдис в воде при 25 ⁰С
Гликолевая
63
1,48×10-4
D, L-молочная
18
1,39×10-4
D-молочная
26
8,4×10-4
L-молочная
–
–
Оксипропионовая
–
–
Тартронная
158
5×10-3
D, L-яблочная
130–131
3,9×10-4
D-яблочная
98–99
–
L-яблочная
–
–
виноградная
204–206
1,04×10-3
D-винная
170
1,1×10-3
L-винная
–
–
мезовинная
140
6,0×10-4
лимонная
153
8,3×10-4
D-глюконовая
125–126
–
Химические свойства оксикарбоновых кислот.
Оксикислоты, благодаря наличию спиртовой группы, реагируют не только, как кислоты, но и как спирты; гидроксильная группа в этих соединениях может быть замещена галогеном или ацилирована. Некоторые реакции этих кислот характерны для определенного положения гидроксильной группы по отношению к карбоксилу. Если OН находится близко к СООН, то кислотные свойства усиливаются, и на оборот, чем ОН дальше от группы СООН, тем больше усиливаются основные свойства и ослабевают кислотные.
α-Оксикислоты
1. Нагревание α-оксикислот c разбавленными растворами серной или соляной кислот. α-Оксикислоты расщепляются с образованием кислоты и соответствующего альдегида
![]()
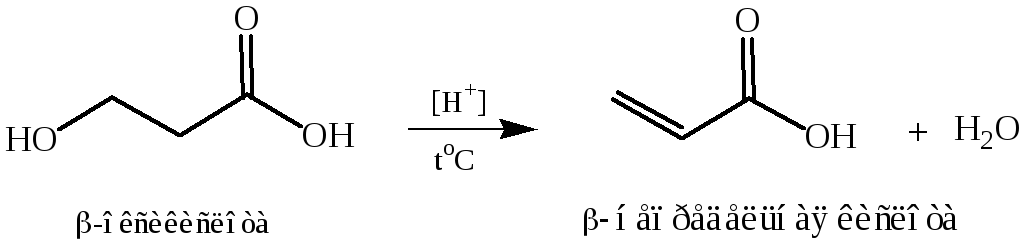
β – Оксикислоты
Характерным
отличием β-оксикислот
от ![]() -оксикислот
является легкость, с которой они теряют
элементы воды, превращаясь при этом в
ненасыщенные кислоты. Так, например,
β-оксимасляная
кислота при перегонке с 50 % серной
кислотой превращается в кротоновую
кислоту, а β-оксивалериановая
кислота при перегонке или при нагревании
в щелочном растворе образует смесь
ненасыщенных кислот. β-Оксикислоты
не способны к образованию лактонов.
-оксикислот
является легкость, с которой они теряют
элементы воды, превращаясь при этом в
ненасыщенные кислоты. Так, например,
β-оксимасляная
кислота при перегонке с 50 % серной
кислотой превращается в кротоновую
кислоту, а β-оксивалериановая
кислота при перегонке или при нагревании
в щелочном растворе образует смесь
ненасыщенных кислот. β-Оксикислоты
не способны к образованию лактонов.
1. Нагревание β-оксикислот c разбавленными растворами серной или соляной кислот:
γ-Оксикислоты
3.1 Образование лактонов. При выделении свободных γ-оксикислот из их солей, они более или менее легко превращаются в соответственные лактоны: