
- •176 Программа блока гетерофункциональные углеводороды.
- •Конспект лекций гетерофункциональные углеводороды
- •Углеводы
- •1.1 Моноуглеводы
- •Химическое строение моносахаридов
- •1. Реакции карбонильных форм моносахаридов
- •2.2 Реакции с участием всех гидроксильных групп
- •Олигосахариды
- •1.2.1 Дисахариды
- •1.2.3 Несахароподобные полисахариды
- •1.2.3.1 Гомополисахариды
- •1.2.3.2 Гетерополисахариды
- •2. Аминокислоты
- •(Nh2)m r(cooh)n,
- •2. Получение β-аминокислот
- •3.2.Перегруппировка оксимов (перегруппировка Бекмана):
- •1,1-Амидные группы
- •Оксикислоты
- •7. Синтез из альдегидов
- •1.3 Реакции нуклеофильного замещения α-галогенкарбоновых кислот.
- •4. Гетероциклические соединения
- •4.1 Пятичленные гетероциклы с одним гетероатомом
- •6. Реакция диенового синтеза с малеиновым ангидридом
- •2. Пиролизом:
- •1. Сухой перегонкой аммонийной соли слизевой кислоты или действием аммиака на фуран в присутствии оксида алюминия:
- •3. Получают при пропускании аммиака и паров бутиндиола-1,4 над катализатором при 300с:
- •4. При перегонке сукцинимида с цинковой пылью:
- •5. Восстановление смеси кетона с изонитрозокетона даёт гомологи или замещенные пирролы:
- •3. Реакция электрофильного замещения (механизм и ориентация замещения):
- •1. Индол обладает слабоосновными свойствами и в то же время слабокислыми, образует металлические производные – индол-калий, индол-натрий:
- •4.2 Пятичленные гетероциклы с несколькими гетероатомами
- •4.3 Шестичленные гетероциклы с одним гетероатомом
- •4.4 Шестичленные гетероциклы с несколькими гетероатомами
- •1. Основные свойства:
- •2. Свойства, обусловленные функциональными группами, в том числе групповые реакции:
- •4.4 Шестичленные гетероциклы с двумя разными гетероатомами
- •Нобелевские премии по органической химии
4.2 Пятичленные гетероциклы с несколькими гетероатомами
Среди гетероциклических соединений наиболее многочисленна и разнообразна группа пятичленных гетероциклов, содержащих более одного гетероатома. Большинство этих циклических систем можно формально получить из фурана, пиррола и тиофена заменой одной или более групп — СН на гетероатом азота. Возможность варьирования числа и расположения атомов азота в кольце приводит к структурному многообразию гетероциклов.
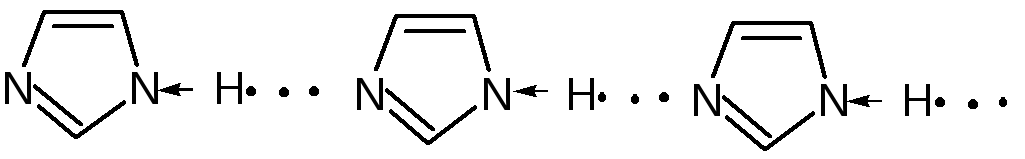
Имидазол – более сильное основание, чем пиразол, что проявляется в образовании межмолекулярных водородных связей, а, следовательно, и в более высокой температуре его кипения по сравнению с пиразолом:
Оба атома азота в имидазоле (как и в пиразоле), эквивалентны и атом водорода легко мигрирует между ними. Имидазол образует соли как с сильными кислотами, так и со щелочными и щелочноземельными металлами. Водородные связи имидазола:
Ароматическая -электронная система имидазола (как и пиразола), образована за счет трех электронов атомов углерода и трех электронов атомов азота. Однако следует отметить, что в 6-электронном сопряжении атомы азота участвуют неодинаково: один из атомов азота отдает в-электронную систему электрон (пиридиновый азот), а другой атом азота – два электрона (пиррольный азот).
Реакции электрофильного замещения в ряду имидазола могут протекать либо по атомам азота (алкилирование и ацилирование), либо по атомам углерода в положения 4 и 5 по месту наибольшей электронной плотности: нитрование, сульфирование, галогенирование. Механизм и ориентация реакции электрофильного замещения:
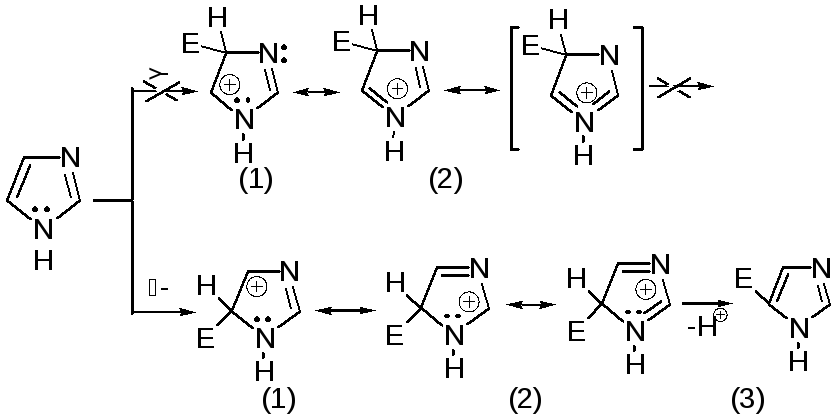
Замещенный 4,5-диметилимидазол не вступает в реакцию нитрования:
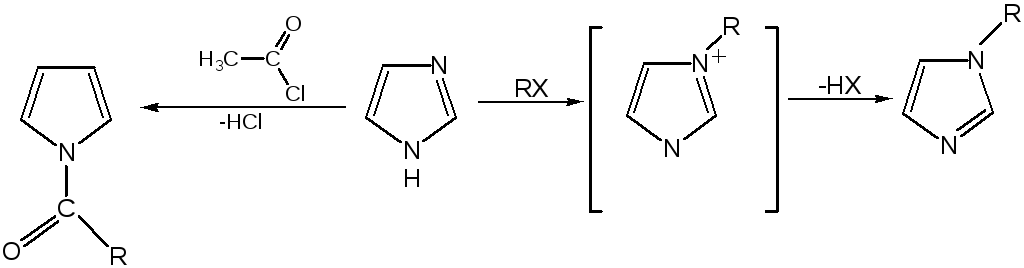
Ацилирование имидазола имеет большое биологическое значение: с помощью N-ацилимидазолов осуществляются реакции ферментативного переацилирования.
Пиразол. Введение второго атома азота в пиррол сильно стабилизирует молекулу, понижая электронную плотность в цикле, поэтому пиразол вступает в реакции электрофильного замещения намного труднее, чем пиррол:
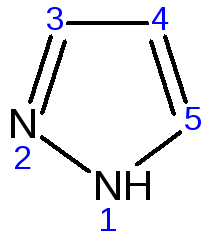
Ароматическая природа пиразола связана с наличием сопряженной 6 -электронной системы, в которую входят три электрона от атомов углерода и три электрона от атомов азота и имеют равную принадлежность протона каждому из этих атомов.
Расположенные рядом два атома азота в силу своей электро-отрицательности являются источником сильного –Iэффекта. Соседние с атомами азота углеродные атомы вследствие этого несут некоторый избыток положительного заряда. Поэтому реакции электрофильного замещения в пиразоле идут в положении 4, как наиболее удаленном от атомов азота:
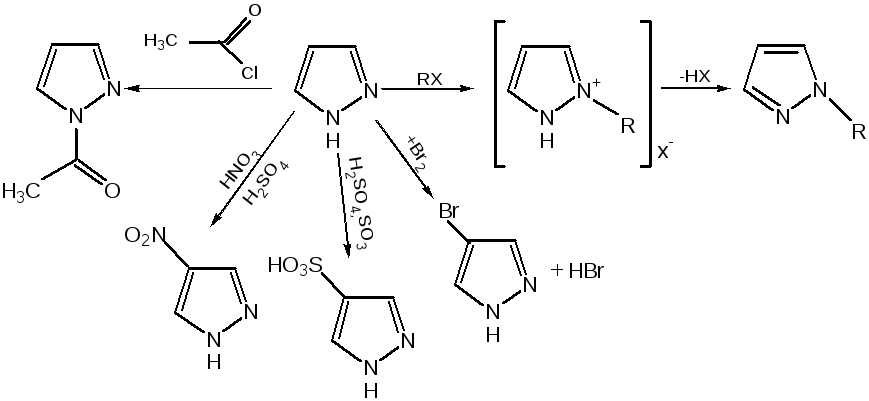
Пиразол является слабым основанием и слабой кислотой. Атом водорода при азоте довольно легко замещается на щелочные металлы, магний, серебро. Ряд производных пиразола применяются как лекарственные препараты, красители, люминесцентные вещества и др. Среди фармацевтических препаратов это - антипирин, пирамидон, анальгин:
Оксазол
Электронное строение. Ароматические свойства оксазола связаны с наличием циклической сопряженной π-электронной системы, построенной из двух π-электронов связи С=С, двух π-электронов связи N=C и неподеленной пары π-электронов атома кислорода.
Избыток положительного заряда на атоме кислорода объясняется тем, что кислород отдает НЭП в кольцевую систему электронов оксазола; положительный заряд на атоме С2 вызывается I-эффектом находящихся рядом электроотрицательных атомов азота и кислорода, причем преимущество в этом отношении одного из последних трудно определить. Наличие избытка отрицательного заряда на атоме азота связано с наличием НЭП, относительно свободной от влияния кольцевого сопряжения. Почти нейтральный заряд на С4 можно объяснить индуктивным действием соседнего атома азота; небольшой избыток электронной плотности на С5 вызывается действием нескольких факторов. Присутствие рядом электроотрицательного атома кислорода индуктивно вызывает появление положительного заряда на С5, но это влияние кислорода ослаблено вследствие его участия в кольцевом сопряжении; с другой стороны, атом С5 испытывает на себе сильный М-эффект, возникающий благодаря мета-ориентирующему влиянию атома азота. На М-эффект в оксазольном цикле накладывается сильный I-эффект атомов кислорода и азота. Только суммируя действие этих двух эффектов на каждый из атомов кольца, можно говорить о приблизительном распределении электронной плотности в оксазоле.
Химические свойства. Оксазолы являются очень слабыми основаниями. По-видимому, замена атома азота на атом кислорода в кольце увеличивает индуктивный эффект, локализующий НЭП атома N и тем самым уменьшающий основность оксазола. Соли оксазола обычно устойчивы только в кислой среде. Наличие азота пиридинового типа придает некоторую устойчивость оксазолу при кислотном гидролизе (ароматичность кольца сохраняется), но возможность образования оксониевого соединения, наоборот, снижает эту устойчивость, так как при этом нарушается ароматичность кольца.
Один из механизмов кислотного гидролиза оксазолов предполагает присоединение протона по атому азота с последующей атакой нуклеофила по С2 или С5:
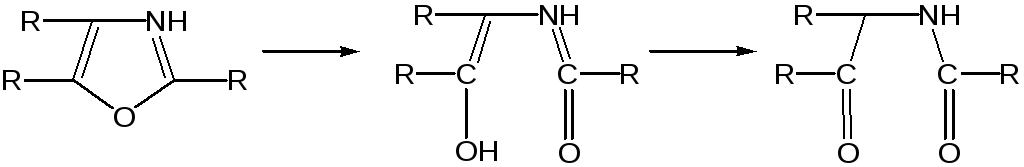
В щелочной среде оксазолы обычно устойчивы даже в очень жестких условиях.
Реакция электрофильного замещения для оксазола не характерна, и даже электрофильная атака по атому азота, обладающему НЭП, протекает с трудом. Метилирование по азоту возможно лишь при наличии в кольце электроноакцепторных заместителей, стабилизирующих цикл. Некоторые реакции электрофильного замещения были проведены с 2,5-дифенильными и 2,4,5-трифенильными производными оксазола.
При нитровании этих соединений электрофильное замещение осуществляется, как правило, в пара-положении бензольного ядра.
Заместители в положении 2 оксазола вследствии электрононена-сыщенности атома углерода довольно активны в реакциях с нуклео-фильными реагентами. Метальная группа может отщеплять протон с образованием аниона оксазола, который реагирует с электрофильными реагентами по обычной схеме:
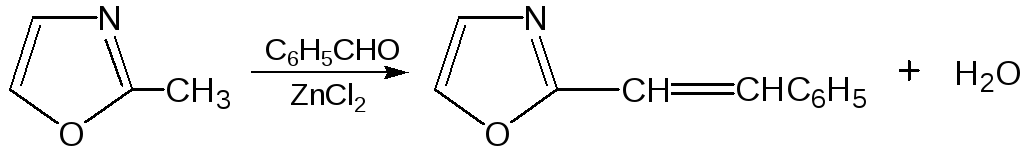
Галогены в положении 2 оксазольного цикла легко замещаются нуклеофилами, например группами NHR, OR, SH, ОН.
Заместители в положениях 4 и 5 менее активны и их поведение напоминает поведение некоторых заместителей в бензольном кольце. Метальные группы в этих положениях не вступают в конденсацию с карбонильными соединениями. 4-Аминопроизводные оксазола являются неустойчивыми соединениями и изучены меньше.
Для некоторых производных оксазола известны интересные превращения. Одно из них сопровождает реакцию оксазолов с аммиаком при нагревании. При этом оксазольные производные превращаются в имидазольные. Реакция начинается с нуклеофильной атаки по атому
Практическое использование и значение оксазола, тиофена и имидазола. Оксазолы и их производные находят пока небольшое практическое применение. 4-Алкилиден-5-оксазолоны используются в синтетической химии для получения α-аминокислот. Сделаны попытки синтезировать антибиотик пенициллинового ряда, используя в качестве одного из исходных веществ 4-алкоксиметилен-5-оксазолон. Некоторые производные оксазолонов представляют интерес для иммуно-химических реакций при аллергических заболеваниях. Отдельные представители 2-анилидооксазолинов являются эффективными местными анестезирующими средствами. Весьма перспективна реакция полимеризации.
Тиазольный цикл входит в состав витамина - тиамина, пенициллина, фермента карбоксилазы и других природных веществ. Производные тиазола используются для приготовления лекарственных веществ. Известны сульфамидные препараты, содержащие тиазольное кольцо. Бензотиазолы пока не нашли столь широкого применения в биохимии и фармакологии. Но зато они оказались важными соединениями в производстве цианиновых красителей.
Цианиновые красители бензотиазольного ряда являются красителями – фотосенсибилизаторами, часто употребляемыми в цветной и инфракрасной фотографии. Действие таких фотосенсибилизаторов состоит в том, что они активируют светочувствительный слой на пленке или пластинке, делая его более чувствительным к облучению. Бензотиазолиевые красители, будучи внесены в эмульсию пленки, не только увеличивают ее чувствительность, но и поглощают падающий свет с определенной длиной волны, придают пленке желтый и красный цвет. За последнее время они почти заменили красители – сенсибилизаторы хинолинового ряда, действие которых в этом отношении менее эффективно. Замена водорода средней метиновой группы на метиловую дает окраску от зеленого до красного цвета (панхром). Увеличение числа метиновых групп до 11 дает возможность делать снимки почти в темноте (инфракрасная фотография). К тиазолиниевым солям относится также витамин – аневрин, сведения о котором даны при рассмотрении пиримидина, поскольку его молекула включает и пиримидиновый цикл.
Производными тиазолидина (т. е. тетрагидротиазола) является группа антибиотиков пенициллинов, открытие которых в годы второй мировой войны ознаменовало вступление медицины в эпоху антибиотиков и победу человека над бактериальными болезнями. Известно пять пенициллинов, которые близки по антибиотическому действию и отличаются друг от друга ацилирующим аминогруппу ацилом. Эта группа антибиотиков была открыта Флемингом и Флори, а строение установлено химиками Оксфордского университета под руководством Р. Робинсона и рентгенографически уточнено Дороти Ходжкин-Кроуфут. Самым трудным оказалось установление наличия в пенициллине необычного лабильного и легко изомеризующегося Р-лактамного цикла. В результате щелочного гидролиза раскрывается один из гетероциклов (именно азотистый) бицикла бензилпенициллина, а меркуролиз сулемой (атака по связи S–С) разрывает второй сульфидный цикл и приводит к образованию двух осколков - пенальдовой кислоты и пеницилламина, содержащего первичную аминогруппу, тиольную и карбоксильную группы при изобутановом скелете. Пенальдовая кислота – α-фенилацетиламиномалоновый полуальдегид. Малоновое расположение карбоксила и альдегидной группы следует из легкого декарбоксилирования пенальдовой кислоты уже в растворе с превращением в фенилацетилглицин. То обстоятельство, что пеницилламин и пенальдовая кислота представляют собой действительно два фрагмента пенициллоиновой кислоты, образовавшиеся без глубоких нарушений структуры, доказывается ресинтезом пенициллоиновой кислоты из этих половинок (пенальдовая кислота взята в виде эфира).
