
- •176 Программа блока гетерофункциональные углеводороды.
- •Конспект лекций гетерофункциональные углеводороды
- •Углеводы
- •1.1 Моноуглеводы
- •Химическое строение моносахаридов
- •1. Реакции карбонильных форм моносахаридов
- •2.2 Реакции с участием всех гидроксильных групп
- •Олигосахариды
- •1.2.1 Дисахариды
- •1.2.3 Несахароподобные полисахариды
- •1.2.3.1 Гомополисахариды
- •1.2.3.2 Гетерополисахариды
- •2. Аминокислоты
- •(Nh2)m r(cooh)n,
- •2. Получение β-аминокислот
- •3.2.Перегруппировка оксимов (перегруппировка Бекмана):
- •1,1-Амидные группы
- •Оксикислоты
- •7. Синтез из альдегидов
- •1.3 Реакции нуклеофильного замещения α-галогенкарбоновых кислот.
- •4. Гетероциклические соединения
- •4.1 Пятичленные гетероциклы с одним гетероатомом
- •6. Реакция диенового синтеза с малеиновым ангидридом
- •2. Пиролизом:
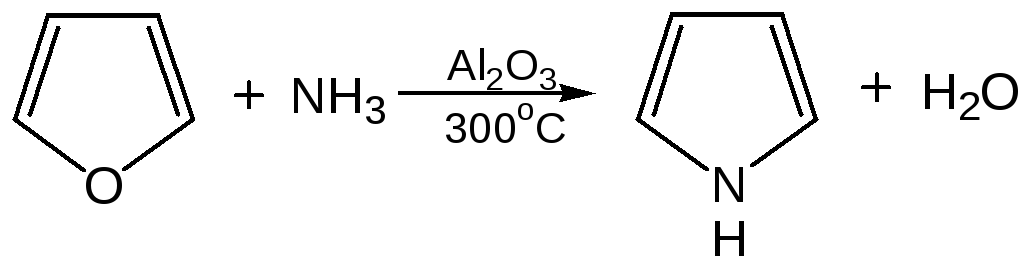
- •1. Сухой перегонкой аммонийной соли слизевой кислоты или действием аммиака на фуран в присутствии оксида алюминия:
- •3. Получают при пропускании аммиака и паров бутиндиола-1,4 над катализатором при 300с:
- •4. При перегонке сукцинимида с цинковой пылью:
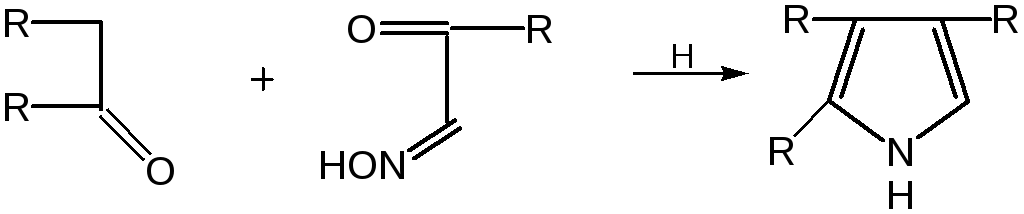
- •5. Восстановление смеси кетона с изонитрозокетона даёт гомологи или замещенные пирролы:
- •3. Реакция электрофильного замещения (механизм и ориентация замещения):
- •1. Индол обладает слабоосновными свойствами и в то же время слабокислыми, образует металлические производные – индол-калий, индол-натрий:
- •4.2 Пятичленные гетероциклы с несколькими гетероатомами
- •4.3 Шестичленные гетероциклы с одним гетероатомом
- •4.4 Шестичленные гетероциклы с несколькими гетероатомами
- •1. Основные свойства:
- •2. Свойства, обусловленные функциональными группами, в том числе групповые реакции:
- •4.4 Шестичленные гетероциклы с двумя разными гетероатомами
- •Нобелевские премии по органической химии
1. Сухой перегонкой аммонийной соли слизевой кислоты или действием аммиака на фуран в присутствии оксида алюминия:
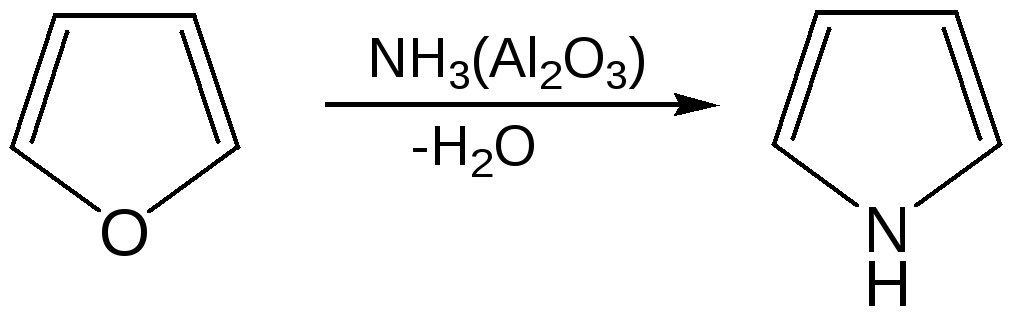
2. Из ацетилена:

3. Получают при пропускании аммиака и паров бутиндиола-1,4 над катализатором при 300с:

4. При перегонке сукцинимида с цинковой пылью:

5. Восстановление смеси кетона с изонитрозокетона даёт гомологи или замещенные пирролы:
6. Взаимодейсвие фурана с аммиаком. Пропускание паров фурана с аммиаком над окисью алюминия при 400оС дает пиррол (Ю.К. Юрьев):
Химические свойства
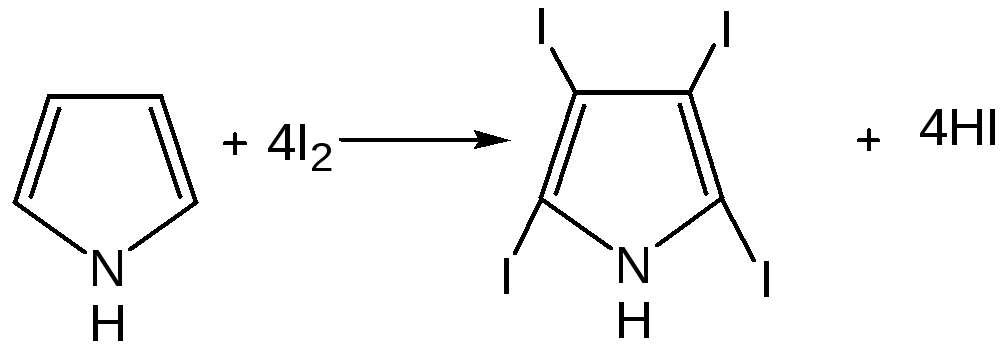
1.Галогенирование.Осуществляется с помощью хлористого сульфурила, брома в спиртовом растворе и триодид-иона (йод в растворе иодида калия), причем в результате иодирования образуется тетраиодпиррол-иодол, являющийся хорошим антисептиком:
2. Сульфирование. Пиррол осмоляются при действии минеральных кислот (проявляют ацидофобные свойства), т.е. в кислой среде протон связывает неподеленную пару электронов кислорода или азота, образуется оксониевый или аммониевый ион, обладающий свойствами диена с сопряженными двойными связями, который легко полимеризуется и осмоляется:

Поэтому сульфируют пиррол с помощью пиридинсульфотриоксида – комплекс пиридина с оксидом серы (VI) C6H5NSO3:

3. Реакция электрофильного замещения (механизм и ориентация замещения):

Пирролидин (тетрагидропиррол, тетраметиленимин) – бесцветная жидкость с резким аммиачным запахом, Ткип. = 86,6 °С. Он дымит на воздухе, хорошо растворим в воде и многих органических растворителях. Пирролидин является сильным основанием (рКа = 11,27), поэтому легко образует соли с сильными минеральными и органическими кислотами. Это соединение обладает всеми химическими свойствами вторичных аминов. Пирролидин возбуждающе действует на ЦНС, при длительном воздействии снижает уровень гемоглобина в крови, усиливает диурез. ПДКвозд 0,1 мг/м3.
Кольцо пирролидина является структурным элементом многих биологически активных соединений, например никотина, алкалоидов группы тропана, алкалоида гигрина. В небольших количествах пирролидин содержится в листьях табака и опии.
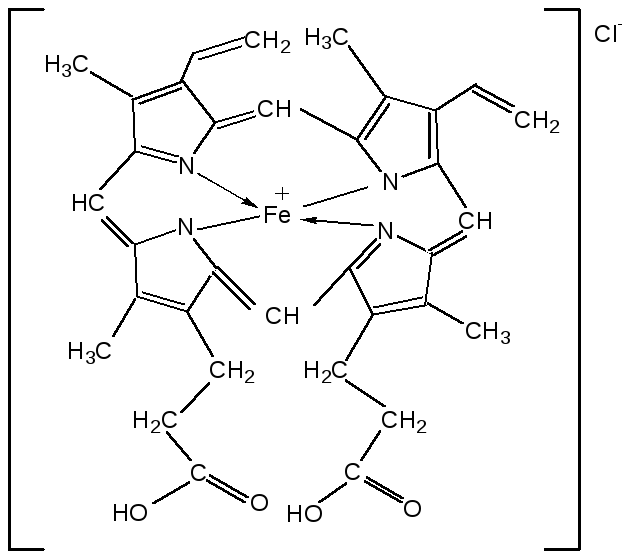
Тетрапирролы представляют собой соединения, структурными элементами которых являются четыре пиррольных кольца. Многие из этих соединений содержат в молекуле особую группировку их четырех пиррольных ядер, соединенных между собой с помощью четырех метиновых (=СН–) мостиков в 16-членное кольцо – ядро порфина. В молекуле порфина (и порфиринов) имеется непрерывное сопряжение -связей (многоконтурная сопряженная -система), при этом максимальное -электронное взаимодействие охватывает 16-членный (С12N4) цикл, в котором порядок связей С=С и С=N достигает 1,5, а в ряде случаев и превышает его. Таким образом, 16-членный макроцикл (порфина) является ароматическим с повышенной термической устойчивостью, способным к реакциям электрофильного замещения. Сам порфин, как таковой, в природе не встречается и получен лишь синтетически. Он представляет собой высокоплавкое кристаллическое вещество темно-красного цвета:

При замещении атомов водорода в -положении пиррольных колец порфина на радикалы образуются порфирины. Многие важные природные соединения являются металлическими производными порфиринов. Следует отметить, что атомы азота в ядре порфина и в порфиринах неравноценны – два из них являются пиррольными (имеют кислотный характер), а два – пирролиновыми (имеют основной характер). Такое строение является исключительно благоприятным для образования комплексов с металлами (для «хелатизации»), что существенно для проявления этими соединениями физиологической активности. Биологическое значение этих природных соединений определяется природой ионов металлов и заместителями в ядре порфина. Если комплекс образован с помощью иона железа (Fe3+), то при определенных заместителях в порфине мы получаем гемин – красное вещество крови (основная часть гемоглобина).
Порфин является устойчивой ароматической системой. Величина энергии сопряжения порфина (840 кДж/моль) также свидетельствует о его высокой стабильности.
Применение пиррола и его производных
Пиррол содержится в каменноугольной смоле. Цикл пиррола – структурный фрагмент природных пигментов (например, гема, хлорофиллов, желчи, витамина В12, некоторых антибиотиков), а также некоторых светостойких фталоцианиновых красителей.
Пиррол умеренно токсичен; его пары вызывают стойкое и упорное повышение температуры тела, ЛД50 74 мг/кг (кролики, перорально).
Пиррол используют для синтеза пирролидина и некоторых лекарственных средств. Он впервые был открыт Ф. Ф. Рунге в 1834 г. в каменноугольной смоле, в чистом виде получен Т. Андерсоном в 1858 г. при сухой перегонке рогов и копыт.
Кольцо пиррольно структурного фрагмента содержит биологически активных соединения, например никотин, алкалоиды группы тропана (атропина, кокаина, экгонина и другие), алкалоида гигрина, в небольших количествахвах пиррол содержится в листьях табака и в опии. Важнейшие производные пирролидина – пролин, 2-пирролидо, 1-винил-2-пирролидон, сукцинимид.
Пирролидин возбуждает центральную нервную систему, снижает (при длительном воздействии) содержание гемоглобина в крови, усиливает диурез ЛД50 0,3 г/кг (белые крысы, перорально), ПДК 0,1 мг/м.
Пирролидин и его производные – сырье для синтеза некоторых лекарственных средств.
Пирролизиновые алкалоиды, содержат в молекуле остаток пирролизидина. Обнаружены в 14 семействах, а также в животных организмах. Наиболее богаты этими алкалоидами растения родов бузутьник (Ligulana) и крестовник (Senecio) семейства сложноцветных, чернокорень (Cynoglossum), гелиотроп (Heliotropium) и трахелантус (Trachelanthus) семейства бурачниковых, кротолярия (Crotolana) семейства бобовых включает около 250 представителей.
Пирролизиновые алкалоиды обладают широким спектром биологической активности. Попадание в пищу растений, содержащих пирролизиновые алкалоиды, может вызвать массовые отравления людей и животных. Ряд пирролизиновые алкалоиды гепатотоксичны, оказывают канцерогенное действие, некоторые проявляют противоопухолевую активность (триходесмин, N-оксидиндицина), обнаруживают гипотензивные свойства.
Есть пирролизиновые алкалоиды применяемые в медицине. Наибольшее, значение среди них имеют платифиллин и саррацин, содержащиеся в растениях рода крестовник (Senecio).
Гемоглобин
Строение и функции гемоглобина. Гемоглобин вляется переносчиком кислорода от легких к тканям тела, представляет собою белок глобин, координационно связанный с гемом (гем – порфирин, содержащий в центре молекулы атом двухвалентного железа – Fe2+). Таким образом, гемин отличается от гема наличием трехвалентного железа (Fe3+) и аниона хлора (Cl–).
Хлорофилл, его физиологическая функция. Зеленые пигменты растений – хлорофиллы являются магнийпроизводными порфирина, в их молекуле атомы азота связаны с магнием, при этом имеются другие заместители в ядре порфирина, например, хлорофилл – сложный эфир фитола – высокомолекулярного спирта, обладающего полиизопреноидным скелетом.
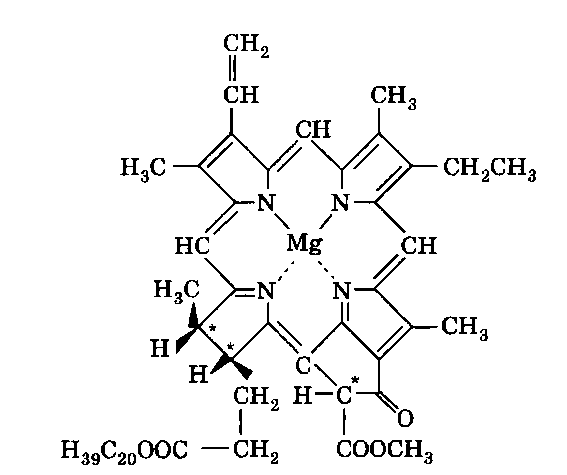
Хлорофиллу принадлежит выдающаяся роль в фотосинтезе – усвоении углекислого газа зелеными растениями за счет световой энергии с образованием органического вещества. Значительно более сложная порфириновая структура, включающая в себя ион кобальта и соединенная с гетероциклическим соединением – замещенным бензимидазолом, лежит в основе витамина В12, который участвует в работе кроветворных органов (костный мозг), а также применяется для лечения ряда заболеваний.
Известны также ферментные системы, в составе которых в качестве проететической группы участвуют так называемые В12-коферменты, или кобамидные коферменты. Порфириновые структуры играют огромную роль в окислительно-восстановительных реакциях в живых организмах, входят в состав ферментов каталазы, пероксидазы и цитохромов, участвующих в переносе электронов при окислительных процессах в клетках. Порфириновые структуры не исчерпывают всего многообразия природных соединений, в состав которых входят производные пиррола.
Индол. Одним из важнейших бензопроизводных пятичленных гетероциклов с одним гетероатомом является бензопиррол, или индол. Он сам и его производные являются биологически важными природными соединениями. Свое название индол получил в связи с тем, что впервые был получен из природного синего красителя индиго. Он найден также в каменноугольной смоле, образуется при гниении белков. Содержится в цветах жасмина, белой акации и апельсина.
Способы получения индола
1. Реакция А.Е.Чичибабинапропускание смеси анилина и ацетилена через нагретые трубы при 700С:

2.Реакция Э.Фишеранагревание фенилгидразонов с хлоридом цинка, серной или фосфорной кислотами:
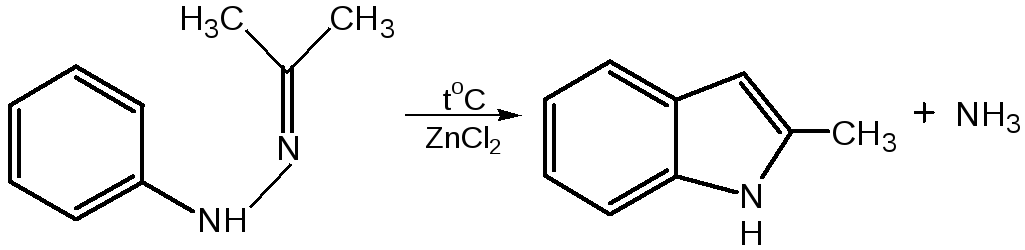
Химические свойства
Реакции индола и его простых производных сходны с реакциями пиррола.
