
- •ПРЕДИСЛОВИЕ
- •ВВЕДЕНИЕ
- •Глава 1. ЭЛЕМЕНТЫ КРИСТАЛЛОФИЗИКИ
- •1.1. Основные понятия и определения
- •1.3. Симметрия твердых тел
- •1.4. Основные типы кристаллических структур
- •1.5. Политипизм, полиморфизм и изоморфизм
- •1.6. Аморфные твердые тела
- •1.8. Дефекты структуры реальных кристаллов
- •Контрольные вопросы и задания
- •Глава 2. ЭЛЕМЕНТЫ КРИСТАЛЛОХИМИИ
- •2.1. Основные понятия и определения
- •2.2. Химическая связь. Типы химической связи
- •2.3. Основные типы кристаллов
- •Контрольные вопросы и задания
- •Глава 3. ПОЛЯРИЗАЦИЯ ДИЭЛЕКТРИКОВ
- •3.1. Характерные особенности диэлектриков
- •3.2. Полярные и неполярные молекулы. Собственный и индуцированный дипольный момент
- •3.3. Поляризация диэлектриков в постоянном поле
- •3.4. Относительная диэлектрическая проницаемость. Уравнение Клаузиуса – Мосотти
- •3.5. Виды и механизмы поляризации
- •3.8. Частотная зависимость диэлектрической проницаемости
- •3.9. Диэлектрическая проницаемость композиционных диэлектриков
- •Контрольные вопросы и задания
- •Глава 4. ЭЛЕКТРОПРОВОДНОСТЬ ДИЭЛЕКТРИКОВ
- •4.1. Особенности электропроводности диэлектриков. Основные понятия и определения
- •4.2. Виды электропроводности диэлектриков
- •Контрольные вопросы и задания
- •Глава 5. ДИЭЛЕКТРИЧЕСКИЕ ПОТЕРИ
- •5.1. Общие сведения
- •5.2. Тангенс угла диэлектрических потерь
- •5.3. Виды диэлектрических потерь
- •Контрольные вопросы и задания
- •Глава 6. ПРОБОЙ ДИЭЛЕКТРИКОВ
- •6.3. Пробой газообразных диэлектриков
- •6.4. Пробой жидких диэлектриков
- •6.5. Пробой твердых диэлектриков
- •6.6. Пробой неоднородных диэлектриков
- •Контрольные вопросы и задания
- •ЗАКЛЮЧЕНИЕ
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •ПРИЛОЖЕНИЕ
- •КРАТКИЙ ТЕРМИНОЛОГИЧЕСКИЙ СЛОВАРЬ
- •ОБОЗНАЧЕНИЯ И ЕДИНИЦЫ НЕКОТОРЫХ ФИЗИЧЕСКИХ ВЕЛИЧИН, РЕГЛАМЕНТИРОВАННЫЕ ОТЕЧЕСТВЕННЫМИ И МЕЖДУНАРОДНЫМИ СТАНДАРТАМИ
- •ОГЛАВЛЕНИЕ

Раздел 1. Основные положения физико химической кристаллографии
Орторомбическая призма составлена из двух тригональных призм. В эту тригональную призму дополнительно введены пять атомов: а) один атом Zn (светлый шар) и один атом S (маленький шар) на вертикальной линии, проходящей через центры треугольных оснований; б) три атома S на ребрах призмы. Жирными линиями показаны тетраэдрические связи между атомами цинка и серы.
Таким образом, в гексагональной призме (составленной из шести тригональных призм) атомы Zn располагаются в ее вершинах, в центрах оснований и внутри трех тригональных призм (через одну по кругу), а атомы S – в тех же трех тригональных призмах и на всех вертикальных ребрах гексагональной призмы. В структуре вюрцита катионы (атомы Zn) образуют ГПУ-решетку с плотноупакованными слоями (z = 12), параллельными плоскости базиса (0001). Анионы (атомы S) также образуют ГПУ-решетку, заполняя половину тетраэдрических пустот в ГПУ-подрешетке Zn. Результирующая сдвоенная ГПУ-решетка имеет по катионам и анионам координационное число z = 4. Если направление [0001] (подобно направлениям {111} в сфалерите) является полярным, то плоскости (0001) и (0001) заполнены разными атомами (катионами и анионами), что проявляется в анизотропии физических и химических свойств на различных гранях кристаллов.
1.5. Политипизм, полиморфизм и изоморфизм
Наряду с рассмотренными выше плотноупакованными двухслойными (АВАВАВ...) и трехслойными (АВСАВСАВС...) структурами с максимальной плотностью упаковки 74 % (см. табл. 1.2), возможно существование и n-слойных упаковок (n > 3) с меньшей, но достаточно высокой плотностью, например:
АВАСАВАСАВАС... – четырехслойная упаковка; АВСАСАВСАСАВСАС... – пятислойная упаковка; АВСАСВАВСАСВАВСАСВ... – шестислойная упаковка и др. Свойство кристаллов образовывать структуры из одних и тех же
слоев, но с разной последовательностью их чередования называется политипизмом. Параметры решетки в плоскости слоев политипов одинаковы, а по нормали к слоям различны, но всегда кратны расстоянию между ближайшими слоями. Эти кристаллические структу-
36

Глава 1. Элементы кристаллофизики
ры могут иметь различные трехмерные решетки, которые отличаются порядком построения двухмерных слоев, называемых модульными слоями. Наибольшим числом политипов (более 50) обладает карбид кремния (химическое соединение SiC высокой твердости с температурой плавления 2830 оC).
Изоморфизм заключается в способности атомов, ионов или молекул замещать друг друга в кристаллических структурах (греч. morphe – форма, вид). Закон изоморфизма был сформулирован Э. Мичерлихом:
одинаковые количества атомов, соединенные одинаковым способом, дают одинаковые кристаллические формы; при этом кристаллическая форма не зависит от химической природы атомов, а определяется только их числом и относительным положением.
При совместной кристаллизации веществ, склонных к изоморфизму, образуются смешанные кристаллы (изоморфные смеси). Это возможно лишь в том случае, если замещающие друг друга частицы мало различаются по размерам (не более 15 %). Кроме того, изоморфные вещества должны иметь сходное пространственное расположение атомов или ионов и, значит, сходные по внешней форме кристаллы. К таким веществам относится, например, соединение KAl(SO4)2 · 12H2O, в котором катионы калия могут быть частично или полностью заменены катионами рубидия или аммония, а катионы алюминия – катионами хрома или железа. В сфалерите ZnS до 20 % атомов цинка могут быть замещены атомами железа (при этом ZnS и FeS имеют разные кристаллические структуры). Изоморфное замещение определяет многие полезные свойства искусственных материалов современной техники: полупроводников, ферромагнетиков, лазерных материалов.
Изоморфизм является частным случаем более общего явления, известного как полиморфизм, под которым понимают способность твердых веществ и жидких кристаллов существовать в двух или нескольких формах с различной кристаллической структурой и различными свойствами при одном и том же химическом составе. Каждая из таких фаз, называемая полиморфной модификацией, устойчива в определенной области температур и давлений. Так, например, карбид кремния наряду с гексагональной модификацией, обозначаемой как α-SiC, встречается и в кубической модификации сфалерита β-SiC. Сульфид цинка ZnS может кристаллизоваться в виде цинковой обманки (кубический сфалерит), гексагонального вюрцита и др.
Образование различных кристаллических структур для одного соединения определяется наличием нескольких минимумов свобод-
37

Раздел 1. Основные положения физико химической кристаллографии
ной энергии, соотношение между которыми зависит от условий формирования кристалла (давление, температура, кинетические характеристики и т. п.). Чаще всего энергия перехода из одной полиморфной модификации в другую достаточно мала, поэтому фазовые переходы протекают при относительно небольших изменениях температуры или давления. Как правило, при повышении давления соседние атомы сближаются, объем элементарной ячейки уменьшается, а координационное число возрастает.
Вслучае молекулярных кристаллов полиморфизм проявляется
вразличной упаковке молекул в кристалле или в изменении формы молекул, а в ионных кристаллах – в различном взаимном расположении катионов и анионов. Некоторые простые и сложные вещества имеют более двух полиморфных модификаций. Например, диоксид кремния имеет 10 модификаций. Полиморфные модификации принято обозначать греческими буквами α, β, γ, δ, ε и т. д., начиная с модификаций устойчивых при низких температурах.
При кристаллизации из пара, раствора или расплава вещества, имеющего несколько полиморфных модификаций, сначала образуется модификация менее устойчивая в данных условиях, которая затем превращается в более устойчивую. Например, при конденсации пара фосфора образуется белый фосфор, который при нагревании превращается в красный фосфор. Переход одной полиморфной модификации в другую называют полиморфными превращениями. Эти переходы происходят при изменении температуры или давления и сопровождаются скачкообразным изменением свойств.
Процесс перехода одной модификации в другую может быть обратимым или необратимым. Полиморфные превращения могут проходить и без существенного изменения структуры. Иногда изменение кристаллической структуры вообще отсутствует. Например, при переходе α-Fe в β-Fe при 769 ºС структура железа не меняется, однако исчезают его ферромагнитные свойства.
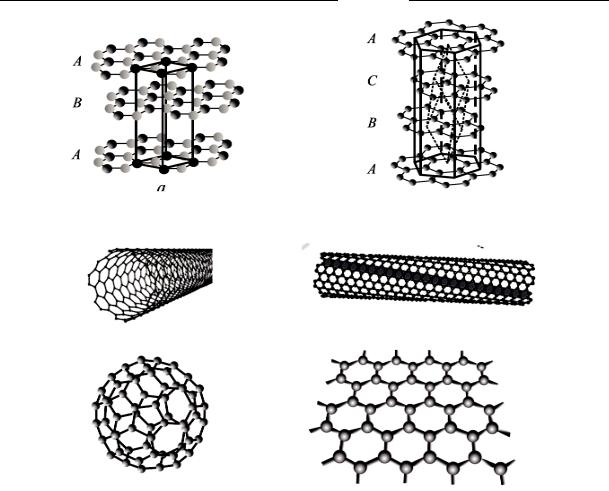
Если твердое вещество простое, то его полиморфные модификации носят название аллотропных. Среди полиморфных модификаций наиболее известны аллотропные модификации углерода в форме: кубической структуры алмаза (сдвоенная ГЦК-решетка, рис. 1.14, а); графита (рис. 1.15, а, б); в виде углеродных нанотрубок (рис. 1.15, в); фуллеренов (рис. 1.15, г) и двухмерной гексагональной кристаллической решетки – графена (рис. 1.15, д).
38
Глава 1.Элем енты кристаллофизики
|
|
|
|
|
а |
|
б |
|
|
|
|
|
|
|
|
|
|
|
|
 в
в
г |
д |
Рис. 1.15. Ал лотропные модифик ации угл ерода: а – α-графит; б – β-графит; в – нанотрубки; г – фуллерен; д – графен
Согласно идеализированной модели, предложенной Дж. Берналом, структура графита представляет собой непрерывный ряд слоев, параллельных основной плоскости и с остоящи х из гексагонально связанных друг с другом атомов углерода, удерживающихся ковалентными связями на рассто янии 1,4 2 Å. Эта связь, ф ормирующая плоскую гексагональную сетку с координационным числом z = 3, обеспечивается тремя из четырех валентных электронов углерода. Оставшийся у каждого атома электрон участвует в межслойном взаимодействии за счет б олее слабых сил (типа вандерваальсовых), при этом расстояние между слоями возрастает до 3,3 5 Å.
В природе встречаются две структурные формы графита, соответствующие двум кри сталлическим модификациям: гексагональная – α-гра фит (рис. 1.15, а) и ром боэдрическая – β-графит (рис. 1.15, б).
39

Раздел 1. Основные положения физико химической кристаллографии
У α-графита половина атомов каждого слоя располагается над и под центрами шестиугольника (укладка АВАВАВ…), а каждый слой сдвинут относительно другого в горизонтальном направлении на 0,1418 нм. У β-графита каждый четвертый слой повторяет первый (укладка АВСАВСАВС…). Ромбоэдрический графит обычно представляют в гексагональных осях, чтобы показать его слоистую структуру. В природных веществах графитовое содержание ромбоэдрической структуры доходит до 30 %, в искусственно полученных графитах наблюдается только гексагональная. Бета-модификация является метастабильной фазой и при 2 230–3 030 °С полностью переходит в гексагональную форму.
Возможность взаимного скольжения слабосвязанных слоев определяет известные свойства графита – мягкость, пластичность и малую твердость. В противоположность этому, сильные межатомные связи, тетраэдрически координированные в пространстве под жестким углом 109º 28', обеспечивают алмазу самую высокую твердость среди известных природных материалов.
В последние два-три десятилетия были открыты и синтезированы новые аллотропные (кристаллические) формы углерода:
углеродные нанотрубки – цилиндрические структуры в форме гексагональных графитовых плоскостей, определенным образом свернутых в трубку (рис. 1.15, в);
фуллерены – сфероидные структуры, представляющие собой многоатомные углеродные молекулы Сn (n = 50, 60, 70, ...) в форме замкнутых многогранников (рис. 1.15, г);
графен – планарная структура, представляющая собой двумерный кристалл, который состоит из одиночного слоя атомов углерода, собранных в гексагональные ячейки (рис. 1.15, д).
Кратко остановимся на перечисленных выше аллотропных модификациях углерода (за исключением алмаза и графита, которым посвящена многочисленная литература).
Углеродные нанотрубки. В 1991 г. И. Ииджима обнаружил длинные углеродные цилиндры, получившие название нанотрубок. Нанотрубка – это молекула из более миллиона атомов углерода, представляющая собой полый цилиндр с диаметром около нанометра и длиной несколько десятков микрон (рис. 1.15, в). В стенках трубки атомы углерода расположены в вершинах правильных шестиугольников.
Взаимная ориентация гексагональной сетки графита и продольной оси нанотрубки определяет очень важную структурную ха-
40

Глава 1. Элементы кристаллофизики
рактеристику нанотрубки, названную хиральностью. Хиральность характеризуется двумя целыми числами (m, n), которые указывают местонахождение того шестиугольника сетки, который в результате свертывания должен совпасть с шестиугольником, находящимся в начале координат. Хиральность нанотрубки может быть однозначно определена углом, образованным направлением сворачивания нанотрубки и направлением, в котором соседние шестиугольники имеют общую сторону. Имеется очень много вариантов свертывания нанотрубок, но среди них выделяются те, в результате реализации которых не происходит искажения структуры гексагональной сетки. Этим направлениям соответствует хиральность (m, 0) и (2n, n). В зависимости от конкретной схемы сворачивания графитовой плоскости, нанотрубки могут быть как проводниками, так и полупроводниками электричества.
Среди однослойных нанотрубок особый интерес представляют нанотрубки с хиральностью 10. Проведенные расчеты показали, что нанотрубки с подобной структурой должны обладать металлическим типом проводимости, а также иметь повышенную стабильность и устойчивость по сравнению с трубками других хиральностей. Некоторые уникальные свойства однослойных нанотрубок приведены в табл. 1.3.
Таблица 1.3
Некоторые свойства однослойных углеродных нанотрубок
Свойства |
Однослойные нанотрубки |
Сравнение |
|
Характерный размер |
Диаметр – от 0,6 до 1,8 нм |
Предел электронной |
лито- |
|
1,33–1,4 г/см3 |
графии – 7 нм |
|
Плотность |
Плотность алюминия – |
|
|
|
|
2,7 г/см3 |
|
Прочность на разрыв |
45 ГПа |
Самый прочный сплав стали |
|
|
|
разламывается при 2 ГПа |
|
Упругость |
Упруго изгибаются под |
Металлы и волокна лома- |
|
|
любым углом |
ются по границам зерен |
|
Плотность тока |
До 1 ГА/см2 |
Медные провода выгорают |
|
|
|
при 1 MA/см2 |
|
Автоэмиссия |
Активируются при 1–3 В |
Молибденовые иглы |
тре- |
|
при расстоянии 1 мкм |
буют 50–100 В |
|
Теплопроводность |
До 6 000 Вт/(м · К) |
Чистый алмаз – |
|
|
|
3 320 Вт/(м · К) |
|
Стабильность по |
До 2 800 °С в вакууме |
Металлизация в схемах |
|
температуре |
и до 750 °С на воздухе |
плавится при 600–1 000 °С |
|
41

Раздел 1. Основные положения физико химической кристаллографии
Нанотрубки бывают самой разной формы: однослойные и многослойные, прямые и спиральные. Многослойные нанотрубки углерода отличаются от однослойных более широким разнообразием форм
иконфигураций. Среднее расстояние между соседними слоями, как
ив графите, равно 0,34 нм.
Электронные свойства нанотрубок можно целенаправленно менять путем введения внутрь трубок атомов других веществ. Этот процесс носит название интеркаляции.
Провода для макроприборов на основе нанотрубок могут пропускать ток практически без выделения тепла, при этом ток может достигать громадного значения – 107 А · см–2.
Разработано также несколько применений нанотрубок в компьютерной электронике. На основе нанотрубок изготовлены прототипы новых элементов для компьютеров. Эти элементы обеспечивают уменьшение массы и габаритов электронных устройств (по сравнению с устройствами на основе кремния) на несколько порядков. В 2006 г. появились эмиссионные мониторы с плоским экраном, работающие на матрице из нанотрубок. Под действием напряжения, прикладываемого к одному из концов нанотрубки, другой конец начинает испускать электроны, которые попадают на фосфоресцирующий экран и вызывают свечение пикселя.
Другой пример – использование нанотрубки в качестве иглы сканирующего микроскопа: нанотрубка представляет собой идеальную иглу диаметром порядка нескольких атомов. Еще одно применение нанотрубок в наноэлектронике – создание полупроводниковых гетероструктур, т. е. структур типа «металл – полупроводник», или стык двух разных полупроводников (нанотранзисторы). Соединение двух нанотрубок, имеющих различную хиральность, а следовательно, отличающихся электронными характеристиками, представляет собой р–n-переход размером несколько нанометров. Таким образом, при уменьшении диаметра однослойная углеродная нанотрубка становится квантовым проводником, что позволяет рассматривать ее в качестве одного из основных элементов наноэлектроники.
Фуллерен. В начале 1970-х гг. Е. Осава предположил существование полой высокосимметричной молекулы С60 со структурой в виде усеченного икосаэдра, похожей на футбольный мяч. В 1985 г. молекула фуллерена была обнаружена экспериментально.
Молекулы фуллеренов могут содержать различное четное число атомов углерода. Из них наиболее стабильной является молекула С60,
42

Глава 1. Элементы кристаллофизики
в которой атомы углерода располагаются на сферической поверхности в вершинах 20 правильных шестиугольников и 12 пятиугольников (рис. 1.15, г). Располагаясь в вершинах двух шестиугольников и одного пятиугольника, атомы углерода имеют равное энергетическое состояние. Молекула С60 является высокосимметричной, имеет шесть осей пятого порядка, проходящих через 12 противоположно лежащих пятиугольников, 10 осей третьего порядка, проходящих через 20 противоположно лежащих шестиугольников, 30 осей второго порядка, проходящих через противоположно лежащие 60 ребер «шестиугольник – шестиугольник», 30 осей второго порядка, проходящих через все противоположные 60 вершин. Кроме того, имеется несколько типов плоскостей симметрии пятого, третьего и второго порядков.
При комнатных температурах кристалл С60 имеет ГЦК-решетку
спараметром а0 = 1,415 нм, но при понижении температуры происходит фазовый переход, и кристалл С60 меняет свою структуру на простую кубическую (постоянная решетки – 1,411 нм). При температуре
Т > Ткр молекулы С60 хаотично вращаются вокруг своего центра равновесия, а при ее снижении до критической две оси вращения «замораживаются». Полное «замораживание» вращений происходит при 165 К.
Молекулярный кристалл фуллерена является полупроводником
сшириной запрещенной зоны ~1,5 эВ, и его свойства во многом аналогичны свойствам других полупроводников. Под действием видимого (более 2 эВ), ультрафиолетового и более коротковолнового излучения фуллерены полимеризуются и в таком виде не растворяются органическими растворителями.
Графен (рис. 1.15, д) представляет собой двухмерную аллотропную форму углерода с гексагональной кристаллической решеткой, формируемой тремя из четырех внешних электронов атома с sp2-связями. При этом атом имеет три ближайших соседних атома. Несвязанный четвертый электрон находится на вертикальной орбитали в 2pz-состоянии и отвечает за образование энергетических зон. Расстояние между ближайшими атомами углерода в шестиугольниках – 0,142 нм. Постоянная решетки равна 0,246 нм.
Кристаллическая структура графена состоит из двух эквивалентных подрешеток, что приводит к образованию двух энергетических зон и двух точек, в которых валентная зона и зона проводимости соприкасаются. В результате носители заряда в графене ведут себя
За «передовые опыты с двумерным материалом – графеном» А. К. Гейму и К. С. Новосёлову была присуждена Нобелевская премия по физике в 2010 г.
43

Раздел 1. Основные положения физико химической кристаллографии
как фотоны. Нулевая масса носителей заряда графена обусловливает их исключительно высокую подвижность. Предельное значение подвижности носителей при комнатной температуре составляет
20 м2 · (В · с)–1 (для сравнения: подвижность носителей в Si составляет 0,15 м2 . (В · с)–1, а в GaAs – 0,85 м2 · (В · с)–1). Полученные значения
подвижности свидетельствуют о том, что электроны могут перемещаться в графене на большие расстояния баллистически (без столкновений) и при комнатной температуре. Это свойство графена делает его многообещающим материалом будущих наноэлектронных систем.
На сегодня особо перспективным представляется создание так называемых графеновых нанолент (Graphene NanoRibbon, GNR). Исследования показали, что, в зависимости от атомной структуры краев – креслоподобной (armchair) или зигзагообразной (Zigzag), нанолента графена может иметь свойства металла или полупроводника. Наноленты, формируемые путем разрезания листа графена вдоль зерен, имеют зигзагообразную структуру и характеризуются в основном свойствами металла, тогда как при разрезании листа вдоль зерен образуется креслоподобная структура. В графеновой ленте такой структуры возможно наличие запрещенной зоны и, следовательно, полупроводниковых свойств. При этом шириной запрещенной зоны можно управлять, изменяя длину наноленты.
Возможность получения лент графена с металлическими свойствами позволит отказаться от применения проводников в наноэлектронике. Это устраняет главное препятствие для применения в электронных схемах углеродных нанотрубок, сопротивление которых при присоединении металлических проводников существенно повышается. Исследования показали, что при комнатной температуре свойства наноленты не отличаются от свойств медных проводников того же размера. Поскольку параметры графеновых нанолент с неоптимизированными свойствами сравнивались с оптимистическими оценками удельной проводимости медных проводников малой ширины, считается, что в конечном итоге графен по своим характеристикам превзойдет традиционный проводящий материал. И не только по удельной проводимости, но и по более высокой подвижности носителей, теплопроводности, механической прочности и меньшей емкостной связи между соседними проводящими линиями. Благодаря этому достигается бóльшая гибкость при построении различных наноэлектронных приборов с требуемыми характеристиками.
44

Глава 1. Элементы кристаллофизики
Работы по синтезу материала с оптимальными характеристиками
исовершенствованию технологических процессов позволили создать транзисторы на основе наноленты графена шириной 20 нм и разместить их на слое термического оксида кремния толщиной 300 нм, нанесенного на высокоомную кремниевую подложку. Электродами стока
иистока служили соответственно слой палладия Pd толщиной 10 нм
ислой золота Au толщиной 50 нм, которые наносились поверх слоя титана толщиной 1 нм, выполняющего роль адгезива. Изолятором затвора служила пленка оксида алюминия толщиной 12 нм. Электроды формировались с помощью электронно-лучевой литографии и взрывного травления. Расстояние между электродами стока и истока составляло 500 нм, верхний затвор полностью не перекрывал это расстояние. Ширина затвора (или ширина обоих каналов) составляла ~ 40 мкм.
Измерения высокочастотных характеристик графеновых транзисторов с верхними электродами и затворами различной длины показали отличную частотную зависимость усиления по току в режиме короткого замыкания, что указывает на подобие графенового транзистора традиционному полевому транзистору. По мнению разработчиков, при обеспечении высокой подвижности носителей графена час-
тота отсечки при длине затвора 50 нм может достичь уровня терагерц
(1012 Гц).
Несколько слов следует сказать еще об одной аллотропной форме углерода – карбине.
Карбин – аллотропная форма углерода на основе sp-гибри- дизации углеродных атомов. Может быть линейным или образовывать циклические структуры. Карбин – линейный полимер углерода. В молекуле карбина атомы углерода соединены в цепочки поочередно либо тройными и одинарными связями (–С≡С–С≡С–) – полииновое строение, либо постоянно двойными связями (=С=С=С=С=) – поликумуленовое строение.
Карбин представляет собой мелкокристаллический порошок черного цвета (плотность – 1,9–2 г · см–3). Он обладает полупроводниковыми свойствами, причем под воздействием света его проводимость сильно увеличивается. На этом свойстве основано его первое практическое применение – в фотоэлементах. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу.
Связь анизотропии физических свойств с геометрической анизотропией структуры кристаллов определяется в конечном
45
