
- •ПРЕДИСЛОВИЕ
- •ВВЕДЕНИЕ
- •Глава 1. ЭЛЕМЕНТЫ КРИСТАЛЛОФИЗИКИ
- •1.1. Основные понятия и определения
- •1.3. Симметрия твердых тел
- •1.4. Основные типы кристаллических структур
- •1.5. Политипизм, полиморфизм и изоморфизм
- •1.6. Аморфные твердые тела
- •1.8. Дефекты структуры реальных кристаллов
- •Контрольные вопросы и задания
- •Глава 2. ЭЛЕМЕНТЫ КРИСТАЛЛОХИМИИ
- •2.1. Основные понятия и определения
- •2.2. Химическая связь. Типы химической связи
- •2.3. Основные типы кристаллов
- •Контрольные вопросы и задания
- •Глава 3. ПОЛЯРИЗАЦИЯ ДИЭЛЕКТРИКОВ
- •3.1. Характерные особенности диэлектриков
- •3.2. Полярные и неполярные молекулы. Собственный и индуцированный дипольный момент
- •3.3. Поляризация диэлектриков в постоянном поле
- •3.4. Относительная диэлектрическая проницаемость. Уравнение Клаузиуса – Мосотти
- •3.5. Виды и механизмы поляризации
- •3.8. Частотная зависимость диэлектрической проницаемости
- •3.9. Диэлектрическая проницаемость композиционных диэлектриков
- •Контрольные вопросы и задания
- •Глава 4. ЭЛЕКТРОПРОВОДНОСТЬ ДИЭЛЕКТРИКОВ
- •4.1. Особенности электропроводности диэлектриков. Основные понятия и определения
- •4.2. Виды электропроводности диэлектриков
- •Контрольные вопросы и задания
- •Глава 5. ДИЭЛЕКТРИЧЕСКИЕ ПОТЕРИ
- •5.1. Общие сведения
- •5.2. Тангенс угла диэлектрических потерь
- •5.3. Виды диэлектрических потерь
- •Контрольные вопросы и задания
- •Глава 6. ПРОБОЙ ДИЭЛЕКТРИКОВ
- •6.3. Пробой газообразных диэлектриков
- •6.4. Пробой жидких диэлектриков
- •6.5. Пробой твердых диэлектриков
- •6.6. Пробой неоднородных диэлектриков
- •Контрольные вопросы и задания
- •ЗАКЛЮЧЕНИЕ
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •ПРИЛОЖЕНИЕ
- •КРАТКИЙ ТЕРМИНОЛОГИЧЕСКИЙ СЛОВАРЬ
- •ОБОЗНАЧЕНИЯ И ЕДИНИЦЫ НЕКОТОРЫХ ФИЗИЧЕСКИХ ВЕЛИЧИН, РЕГЛАМЕНТИРОВАННЫЕ ОТЕЧЕСТВЕННЫМИ И МЕЖДУНАРОДНЫМИ СТАНДАРТАМИ
- •ОГЛАВЛЕНИЕ

Глава 2. Элементы кристаллохимии
2.2. Химическая связь. Типы химической связи
Принципиально можно описать свойства вещества с точки зрения квантово-механического взаимодействия частиц. Однако строгий подход к решению таких задач связан с весьма значительными математическими преобразованиями, анализ которых в рамках данного курса не предусмотрен. Более простой подход к изучению свойств веществ основан на макроскопических параметрах материалов, полученных, как правило, экспериментально. Одним из таких методов является анализ химических связей элементов вещества. Сопоставляя между собой расположение атомов в структуре вещества, их электронную конфигурацию и тип химической связи между ними, можно определить или оценить многие основные макроскопические свойства материалов, такие как электропроводность, способность к намагничиванию, плотность, твердость, пластичность и др.
Наиболее важным является вопрос о силах связи, удерживающих атомы вместе. В твердых телах между частицами действуют различные по своей природе силы, удерживающие эти частицы на определенных расстояниях друг от друга. Эти силы почти полностью являются силами электростатического взаимодействия между электронами и ядрами атомов. Остановимся на этом несколько подробнее.
Ядро одного из атомов поместим в начало координат, а ядро второго будем приближать к ядру первого вдоль оси абсцисс. Удаленные на бесконечно большое расстояние атомы не взаимодействуют друг
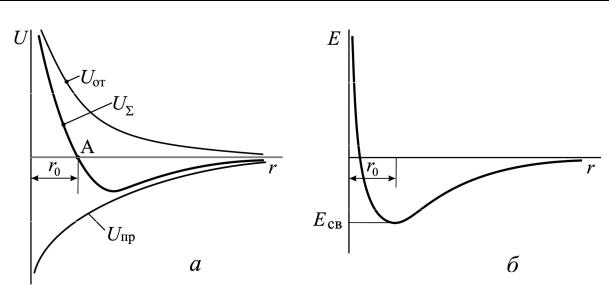
сдругом. Однако при уменьшении расстояния r между ними возникают силы взаимодействия. Во-первых, это кулоновские силы притяжения между разноименными зарядами, которые действуют на больших расстояниях (r > r0, r0 – равновесное расстояние) и непрерывно возрастают
суменьшением r (кривая Uпр на рис. 2.2, а). Во-вторых, силы отталки-
вания, которые возникают в результате перекрытия электронных оболочек атомов и взаимодействия ядер на малых расстояниях (r < r0) и резко возрастают с уменьшением r (кривая Uот на рис. 2.2, а) .
Таким образом, существует два вида сил с противоположным характером воздействия на сближающиеся частицы. Сначала преобладают силы притяжения, затем – отталкивания. Равновесие между ними достигается при r = r0 (рис. 2.2, а, точка А на кривой U∑).
Это справедливо только в случае антипараллельного расположения спиновых моментов взаимодействующих атомов (см ниже).
81
Раздел 1. Основные положения физико химической кристаллографии
а |
|
б |
|
|
|
||
|
|
||
|
|
Рис. 2.2. Зависимость силы взаимодействия (а) и полной энергии (б)
в кристалле от расстояния: Uот – сила отталкивания; Uпр – сила притяжения; U∑ – результирующая сила; r0 – равновесное расстояние; Есв – энергия связи между частицами
Это означает, что образовавшаяся молекула имеет минимальную суммарную энергию взаимодействующих атомов. Расстояние r0 называют длиной валентной связи. Обычно r0 составляет 1–2 Å. При сближении двух атомов водорода, содержащих электроны с параллельными спинами, энергия системы постоянно увеличивается и связь не образуется.
Итак, существование стабильных связей между атомами вещества предполагает, что полная энергия всех частиц, образующих кристалл, меньше суммарной энергии этого же числа атомов в свободном состоянии. Только в этом случае кристалл будет термодинамически стабильным. Разность этих двух полных энергий называется энергией химической связи или просто энергией связи Есв (кДж · моль–1 или ккал · моль–1). Это одна из важнейших характеристик химической связи. Для двухатомных молекул Eсв равна энергии диссоциации молекулы. Для многоатомных молекул, например молекул АBn с одним типом связи, средняя энергия связи равна 1/п части энергии распада молекулы на атомы (энергии атомизации). При расчетах Eсв подразумевается, что исходная молекула и продукты ее распада находятся в невозбужденном состоянии при абсолютном нуле и обладают свой-
82

Глава 2. Элементы кристаллохимии
ствами идеального газа, т. е. рассматривается стандартная энергия диссоциации молекул. В зависимости от вещества численное значение Eсв может изменяться от единиц до нескольких тысяч. В среднем
же она составляет величину ~ 250–350 кДж . моль–1. С уменьшением длины связи значение Eсв возрастает. По величине энергии связи можно судить о температуре плавления тела, упругих характеристиках, температурном коэффициенте расширения, пластичности и других свойствах.
Зависимость суммарной энергии от расстояния показана на рис. 2.2, б. Из графика следует, что:
при r >> r0 суммарная энергия взаимодействия стремится к нулю;
при r > r0 суммарная энергия отрицательна и убывает с уменьшением r , что соответствует притяжению между частицами;
при r < r0 суммарная энергия резко возрастает и изменяет знак, т. е. частицы отталкиваются друг от друга;
при r = r0 суммарная энергия минимальна и при заданных внешних условиях соответствует равновесному состоянию.
В первом приближении зависимость E(r) может быть аппроксимирована выражением
E (r)= |
A |
− |
B |
, |
(2.1) |
|
rn |
rm |
|||||
|
|
|
|
где A, B, n, m – численные коэффициенты, подбираемые согласно требованиям наилучшей аппроксимации реальной кривой.
Продифференцировав (2.1) по r и приравняв производную к нулю в точке r = r0, найдем энергию связи
dE (r ) |
|
B m |
|
|
||||
Есв = |
|
|
= |
|
|
|
−1 . |
(2.2) |
dr |
m |
n |
||||||
|
r=r |
|
r0 |
|
|
|||
|
|
0 |
|
|
|
|
|
|
Всостоянии равновесия энергия связи должна отвечать условию
Eсв < 0. Это имеет место при m < n. Следовательно, сила отталкивания изменяется быстрее, чем сила притяжения.
Вкачестве примера в табл. 2.2 приведены средние значения длины и энергии химических связей для некоторых соединений.
Втабл. 2.3 приведены основные типы химической связи и их основные характеристики.
83

Раздел 1. Основные положения физико химической кристаллографии
Таблица 2.2
Энергия и длина химических связей
|
Связь |
|
Энергия связи, |
|
Длина связи, |
|
Связь |
Энергия связи, |
Длина |
||||||||
|
|
кДж · моль–1 |
|
нм |
|
|
кДж · моль–1 |
связи, нм |
|||||||||
|
C−H |
|
|
416 |
|
0,109 |
|
|
С≡С |
813 |
|
|
0,120 |
||||
|
C−F |
|
|
|
485 |
|
0,138 |
|
|
С=O |
695 |
|
|
0,116 |
|||
|
C−Cl |
|
|
327 |
|
0,176 |
|
|
O−H |
467 |
|
|
0,096 |
||||
|
C−Br |
|
|
285 |
|
0,194 |
|
|
O−O |
146 |
|
|
0,148 |
||||
|
С−I |
|
|
|
213 |
|
0,214 |
|
|
S–H |
347 |
|
|
0,135 |
|||
|
C–C |
|
|
356 |
|
0,154 |
|
|
N−H |
391 |
|
|
0,101 |
||||
|
C=C |
|
|
598 |
|
0,134 |
|
|
As−H |
247 |
|
|
0,152 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 2.3 |
||
|
|
|
|
|
|
Основные типы химической связи |
|
|
|
|
|||||||
|
|
|
|
|
|
и их основные отличительные признаки |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Тип |
|
|
Связы- |
Характер |
Процесс в |
Образую- |
Кристал- |
|
Характер |
|
При- |
|||||
|
|
|
ваемые |
электрон- |
|
|
щиеся |
лическая |
|
|
|||||||
|
связи |
|
|
атомы |
элементов |
ной обо- |
|
частицы |
решетка |
|
вещества |
|
меры |
||||
|
|
|
|
|
|
|
|
лочке |
|
|
|
|
|
|
|
|
|
|
|
|
|
Атомы |
Электро- |
|
|
Положи- |
|
|
|
|
|
|
|||
|
Ионная |
|
|
положи- |
Переход |
|
|
|
|
|
|
|
|||||
|
|
металлов |
тельный и |
валентных |
тельные и |
Ионная |
|
Солеоб- |
|
NaCl |
|||||||
|
|
и неме- |
электро- |
электро- |
|
тельные |
|
разный |
|
CaO |
|||||||
|
|
|
|
|
|
|
|
|
|
|
отрица- |
|
|
|
|
|
|
|
|
|
|
таллов |
отрица- |
нов |
|
|
ионы |
|
|
|
|
|
|
||
|
|
|
|
|
|
тельный |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
Электро- |
Образова- |
|
|
|
Молеку- |
|
Летучий |
|
Br2 |
||
|
Ковалентная |
|
|
|
|
ние общих |
|
|
|
|
или неле- |
|
CO2 |
||||
|
|
|
Атомы |
отрица- |
электрон- |
|
|
|
лярная |
|
тучий |
|
C6H6 |
||||
|
|
|
положи- |
кулярных |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
тельный, |
ных пар, |
|
|
|
|
|
|
|
|
|
|||
|
|
|
неметал- |
редко |
заполне- |
Молекулы |
|
|
Алмазо- |
|
Алмаз |
||||||
|
|
|
|
|
лов |
электро- |
ние моле- |
|
|
|
Атомная |
|
подоб- |
|
Si |
||
|
|
|
|
|
|
тельный |
орбиталей |
|
|
|
|
|
ный |
|
|
SiC |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Металлическая |
|
|
|
|
Электро- |
Отдача |
|
Положи- |
|
|
|
|
|
|
||
|
|
|
|
Атомы |
валентных |
|
тельные |
Метал- |
|
Метал- |
|
Метал- |
|||||
|
|
|
металлов |
положи- |
электро- |
|
|
ионы и |
лическая |
|
лическая |
|
лы и |
||||
|
|
|
тельный |
электрон- |
|
|
сплавы |
||||||||||
|
|
|
|
|
|
нов |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
ный газ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
84

Глава 2. Элементы кристаллохимии
По характеру взаимодействия между частицами, составляющими вещество, различают шесть типов химической связи:
ковалентная неполярная; ковалентная полярная или гомеополярная; донорно-акцепторная; ионная или гетерополярная; металлическая;
молекулярная (связь Ван-дер-Ваальса).
Между различными видами химической связи нельзя провести четкое разграничение, однако всегда можно выделить доминирующий механизм.
2.2.1. Ковалентная связь
Ковалентная связь – химическая связь между атомами неметаллов, возникающая за счет образования нескольких общих электронных пар при объединении валентных электронов разных атомов (одного и того же или разных химических элементов). Валентность элемента равна числу общих пар (химических связей).
Первая теория ковалентной связи принадлежит Дж. Льюису. В 1916 г. он предположил, что связь между двумя атомами осуществляется обобществленной электронной парой. При этом вокруг каждого атома формируется 8-электронная оболочка (правило октета: атом стремится приобрести 8-электронную конфигурацию инертного газа, а химические элементы Н, Li, Be и B – 2-электронную, как у атома Не).
Дальнейшие исследования показали, что физическая природа этой связи является сугубо квантовой и проявляется в форме так называемого обменного взаимодействия между атомами с одинаковыми или примерно одинаковыми электронными конфигурациями внешних валентных оболочек. На языке классического описания обменное взаимодействие представляют как попарное обобществление валентных электронов с противоположными спинами, изначально принадлежащих различным атомам (простейший пример – молекула водорода H2).
Вещества с ковалентной связью имеют молекулярное строение, т. е. состоят из молекул в любом агрегатном состоянии. Действительно, например, атому галогена (VII группа) недостает одного электрона до полного октета из восьми электронов. Обобществление одной электронной пары дает полностью насыщенную ковалентную связь, когда отсутствуют электроны, которые могли бы взаимодействовать с другими ато-
85

Раздел 1. Основные положения физико химической кристаллографии
мами. Поэтому во всех агрегатных состояниях галогены состоят из двухатомных молекул (например, F2, Cl2 и т. п.), которые в конденсированном состоянии связываются за счет межмолекулярных сил (см. ниже). Аналогичным образом ведут себя атомы VI и V групп, обобществляющие в двухатомных молекулах две и триэлектронные пары соответственно.
Элементам IV группы периодической системы (C, Si, Ge, Sn) недостает четырех электронов до полного октета. Для образования одинарной ковалентной связи атом должен иметь состояние с одним неспаренным электроном, в то время как для установления четырех связей в решетке алмаза атому углерода необходимы четыре электрона. Вступая во взаимодействие, атом углерода возбуждается, создавая электронную конфигурацию, имеющую четыре необходимых валентных электрона. Для каждого атома углерода (или Si, или Ge) обобществление этих электронов в ковалентной связи с четырьмя соседними атомами, расположенными по углам правильного тетраэдра, создает кристаллическую структуру типа алмаза.
Все вещества с ковалентной связью: практически не проводят электрический ток; плохо проводят тепло; хрупкие.
В зависимости от того как происходит перераспределение электронной плотности, различают две разновидности ковалентной связи: неполярную и полярную.
Ковалентная неполярная связь образуется, если разность в значениях электроотрицательностей связанных атомов равна нулю. При неполярной ковалентной связи электронное облако, образованное общей парой электронов, распределяется в пространстве симметрично относительно ядер обоих атомов.
Метод описания химической связи, образование которой связано с общей электронной парой, называют методом валентных связей
(МВС).
При описании электронного строения химической частицы электроны, в том числе обобществленные, относят к отдельным атомам и их состояния описывают атомными орбиталями. Решая уравнения Шрёдингера, приближенную волновую функцию выбирают так, чтобы она давала минимальную электронную энергию системы, т. е. наибольшее значение энергии связи. Это условие достигается при наибольшем перекрывании орбиталей, принадлежащих одной связи. Таким образом, пара электронов, связывающих два атома, находится
86

Глава 2. Элементы кристаллохимии
в области перекрывания их атомных орбиталей. Согласно МВС химическая связь образуется только тогда, когда взаимодействуют два атома, имеющие неспаренные электроны с антипараллельным расположением спинов (при параллельных спинах электронов атомы не притягиваются, а отталкиваются и ковалентная связь не образуется). В этом случае становится возможным перекрывание электронных облаков (точнее, волновых функций) неспаренных электронов, в результате чего между атомами создается зона повышенной электронной плотности, обуславливающая химическую связь. Атомы, составляющие молекулы, стремятся приобрести устойчивую конфигурацию, состоящую из двух или восьми электронов.
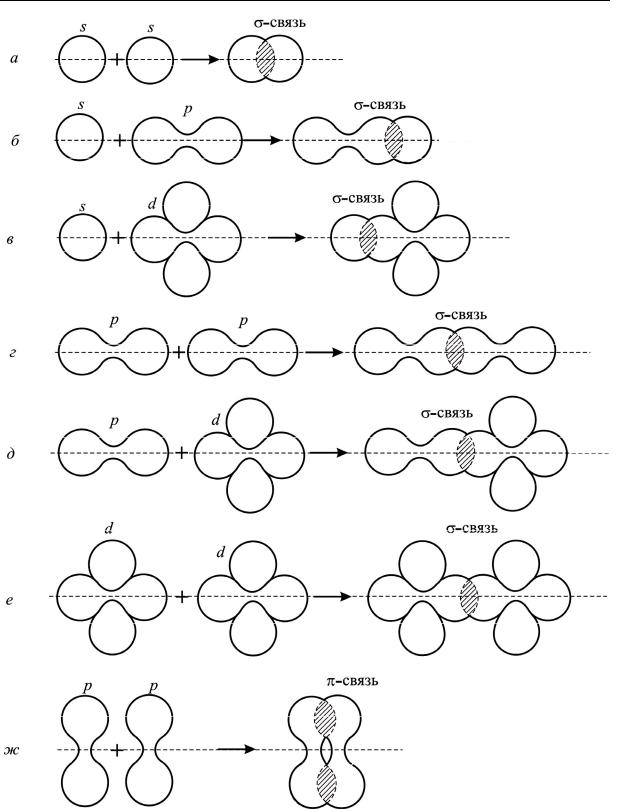
Существует несколько способов образования ковалентных связей за счет перекрывания электронных облаков. Если перекрывание происходит вдоль линии, соединяющей ядра атомов, то такую связь называют σ-связью (рис. 2.3, а–е). Она может быть образована за счет двух s-электронов (рис. 2.3, а), s- и p-электронов (рис. 2.3, б), s- и d-электронов (рис. 2.3, в), двух p-электронов (рис. 2.3, г), р- и d-электронов (рис. 2.3, д), двух d-электронов (рис. 2.3, е). Все σ-связи обладают осевой симметрией относительно межъядерной оси. Фрагменты частиц могут вращаться вокруг межъядерной оси без нарушения степени перекрывания атомных орбиталей, образующих σ-связи.
Если электронные облака перекрываются по обе стороны от линии, соединяющей центры облаков (перпендикулярно линии связи), это π-связь (рис. 2.3, ж). Возникновение π-связи между двумя атомами происходит только тогда, когда они уже связаны σ-связью. На первый взгляд может показаться, что σ-связь, ограничивая сближение атомов, не дает возможности перекрывания орбиталей по π-типу. Однако перекрывание осуществляется периферийными частями электронных облаков с меньшей электронной плотностью. Вследствие этого электронные облака перекрываются меньше, чем в случае σ-связей, и π-связи, как правило, менее прочны, чем σ-связи, образованные теми же атомными орбиталями. Не имеющая осевой симметрии, π-связь исключает свободное вращение фрагментов молекул вокруг σ-связи, так как оно должно привести к разрыву π-связи.
Химическую связь, осуществляемую одной электронной парой, называют одинарной. Одинарная связь всегда σ-связь. Орбитали типа s могут образовывать только σ-связи. Связь двух атомов может осуществляться и более чем одной парой электронов. Такая связь являет-
ся кратной.
87
Раздел 1. Основные положения физико химической кристаллографии
p–p
s–p
s–d
p–p
p–d
d–d
p–p
Рис. 2.3. Примеры некоторых σ- и π-связей
Не вдаваясь в детали, отметим, что квантово-механические представления обусловили следующие положения МВС:
88

Глава 2. Элементы кристаллохимии
•причиной связи является электростатическое взаимодействие ядер и электронов;
•связь образуется электронной парой с антипараллельными спинами;
•насыщаемость связи обусловлена образованием электронных
пар;
•прочность связи пропорциональна степени перекрывания электронных облаков;
•направленность связи обусловлена перекрыванием электронных облаков в области максимальной электронной плотности.
Ковалентная полярная связь образуется, если электронная плотность смещена в сторону одного из атомов, имеющего бóльшую электроотрицательность. Такое смещение называют степенью полярности (ионности) связи. Последняя пропорциональна разности электроотрицательностей. Так, для атомов кремния электроотрица-
тельность ХSi = 4,5 эВ, для атомов углерода ХC = 6, 25 эВ. Это свидетельствует о полярной связи между ними со смещением электронного заряда к атому углерода в тетраэдрической структуре карбида кремния SiC.
Чем больше разность электроотрицательностей связываемых атомов, тем более смещенной (полярной) оказывается связь между этими атомами. В соединениях с такой связью происходит не полная,
ачастичная отдача электронов. Если разность электроотрицательностей атомов велика, то электронная пара, осуществляющая связь, переходит к одному из атомов и оба атома превращаются в ионы. Таким образом, идеальная ковалентная связь существует лишь в частицах,
состоящих из одинаковых атомов (Н2, N2 и т. д.). Если образуется связь между различными атомами, то электронная плотность смещается к одному из ядер атомов, т. е. происходит поляризация связи. Ха-
рактеристикой полярности связи служит ее дипольный момент μ0 (см. гл. 3). Единица измерения дипольных моментов молекул – дебай (1 Д = 3,33 · 10–30 Кл · м). У большинства молекул дипольные моменты меньше этой величины. Дипольные моменты сложных молекул получаются путем сложения дипольных моментов отдельных связей по правилам сложения векторов. В случае симметричных фигур дипольный момент молекулы с полярными связями оказывается рав-
ным нулю, поэтому, например, молекула СO2 линейна. Линейны и более сложные симметричные молекулы: SiCl4, SF6, и др. По величине дипольного момента можно сделать заключение как о характере
89

Раздел 1. Основные положения физико химической кристаллографии
химической связи (ионная, ковалентная полярная или неполярная), так и о геометрической форме молекулы.
Ковалентные полярные связи образуются:
внекоторых молекулах и многоатомных ионах (ионах гидроксония Н3О, аммония NH+4 и др.);
всоединениях типа воды (H2O, H2S, NH3) и молекулах веществ, образуемых атомами элементов соседних главных подгрупп периодической системы: CO2, NO, PCl3 и т. д.;
вводородсодержащих соединениях, например HCl.
Полярные ковалентные связи обладают только им присущими свойствами – насыщаемостью и направленностью. Насыщаемость связи – это способность атома соединяться с другим атомом определенным числом связей, которое определяется числом валентных электронов. Насыщаемость проявляется в том, что одна орбиталь атома с неспаренным электроном может принимать участие в образовании только одной ковалентной химической связи.
Направленность связи определяется величиной угла между направлениями связей в пространстве (направленностью в пространстве перекрывающихся атомных орбиталей). Это свойство проявляется в примерно одинаковом строении родственных по составу молекулярных фрагментов (например, фрагмент СН2 в различных углеводородах имеет примерно одно и то же строение).
2.2.2. Донорноакцепторная связь
Донорно-акцепторная связь является частным случаем ковалентной связи. Ковалентная связь, образованная неподеленной парой электронов, принадлежащей до образования связи одному из связываемых атомов и переходящей на свободную орбиталь другого атома, называется донорно-акцепторной связью. Атом, поставляющий электронную пару, называют донором, атом, к которому эта пара переме-
щается, – акцептором.
В химических формулах донорно-акцепторная связь обозначается знаками «+» и «−» у соответствующих атомов, которые показывают, что электронная пара сдвигается к одному из атомов, или стрелкой, которая также показывает сдвиг электронной пары.
Рассмотрим пример молекулы, содержащей донорно-акцеп- торную связь. В молекуле NH3 три электронные пары образуют три
90

Глава 2. Элементы кристаллохимии
связи N−H, четвертая пара внешних электронов является неподеленной, она может дать связь с ионом водорода, в результате получается ион аммония NH+4 . Таким образом, ион NH+4 имеет четыре ковалент-
ные связи, т. е. азот здесь четырехвалентен. При этом все четыре связи N−H равноценны, т. е. электронная плотность равномерно распределена между ними.
Разные механизмы образования ковалентной и донорноакцепторной связей приводят к одинаковому результату и часто реализуются одновременно в химических соединениях типа AIIBVI и AIIIBV. Например, в кристалле сульфида цинка имеются две ковалентные связи и две донорно-акцепторные, при этом Zn – акцептор, а S – донор.
2.2.3. Ионная связь
Ионная (гетерополярная) связь осуществляется между элементами, сильно различающимися по электроотрицательности, и является частным случаем полярной ковалентной связи: электронная пара, образующая связь, полностью смещена к одному из атомов. Это, как правило, связь между атомами элементов главных подгрупп I, II и VI, VII групп периодической системы. К ионным соединениям близки только галогениды щелочных металлов.
Ионная связь обусловлена образованием электронных пар за счет перехода валентных электронов от одного атома (металла) к другому атому (неметаллу) в результате электростатического притяжения. Атомы, отдающие свои электроны, превращаются в положительно заряженные ионы – катионы (от греч. kata – вниз) и проявляют положительную валентность. Атомы, принимающие электроны, превращаются в отрицательно заряженные ионы – анионы (от греч. ana – вверх). Образовавшиеся положительные и отрицательные ионы взаимно притягиваются друг к другу. При этом возникает химическая связь и образуются химические соединения. Так как образование связи между атомами в молекуле происходит за счет возникновения общих электронных пар, то при этом атомы, обладающие большей способностью притягивать электроны на свою внешнюю оболочку (более электроотрицательные), будут приобретать избыточный отрицательный заряд, а менее электроотрицательные – положительный заряд. Сферическая симметрия таких конфигураций делает ионную связь
91

Раздел 1. Основные положения физико химической кристаллографии
ненаправленной и склонной к достаточно плотной упаковке, имеющей место, например, в кристаллах кубической сингонии.
Образование ионной химической связи, по Косселю, происходит в два этапа:
1. Отрыв электрона от менее электроотрицательного атома и присоединение его к более электроотрицательному атому с образованием соответственно катиона и аниона, например:
Na −e− |
Na+ |
Cl + e− |
Cl− |
2. Электростатическое взаимодействие ионов, ведущее к образованию молекул или кристаллов:
Na+ +Cl− |
NaCl |
Существование молекулы как единого целого в случае ионной связи обеспечивается электростатическим взаимодействием образовавшихся ионов. Резкой границы между соединениями с ионными связями и полярными ковалентными не существует. Не существует и идеально ионных соединений. Даже при химическом взаимодействии наиболее электроположительных и электроотрицательных элементов образуются сильнополярные соединения с наибольшей долей ионности.
Валентность элементов в ионных соединениях равна заряду ио-
на, который указывается вверху справа от химического знака, напри-
мер: Al3+, Ca2+, S2– и т. д.
Основными особенностями ионных связей являются их ненаправленность и ненасыщаемость. Ненаправленность ионной связи заключается в том, что каждый ион создает вокруг себя электрическое поле, силовые линии которого направлены во все стороны от него. Поэтому любой положительный ион притягивает к себе множество отрицательных ионов, образуя кристалл. Никогда нельзя определить направление ионной связи: она действует сразу во всех направлениях. Например, в кристалле NaCl каждый ион натрия окружен восемью ионами хлора и каждый ион хлора окружен восемью ионами натрия. Ненасыщаемость ионной связи заключается в том, что каждый ион способен осуществить связь с любым количеством ионов противоположного знака.
92

Глава 2. Элементы кристаллохимии
Молекулы с ионной связью существуют только в парообразном состоянии. При обычной температуре все ионные соединения – это ионные кристаллы, в которых нет отдельных молекул (например, ионы NaCl условно можно представить как одну макромолекулу, состоящую из чередующихся положительных и отрицательных ионов). Все вещества с ионной связью хрупки, плохо проводят тепло, не проводят электрический ток. Практически даже при образовании связи между такими резко отличающимися по свойствам элементами, как натрий и хлор, нет полного отрыва электронного облака: оно только в большей степени смещено к атому хлора. Для NaCl положительно заряженный ион натрия Na+ равномерно притягивается всеми отрицательными ионами хлора Cl–, окружающими его в пространстве, поэтому ионная связь менее прочная, чем ковалентная.
В структуры ионного типа кристаллизуются галогениды щелочных металлов, халькогениды щелочно-земельных металлов и бóльшая часть простых (бинарных) оксидов. Ионные кристаллы являются ярко выраженными диэлектриками с энергией ионной связи, достигающей 600–800 кДж · моль–1. Поэтому они имеют достаточно высокие значения температуры плавления и теплоты плавления (сублимации).
2.2.4. Металлическая связь
Металлическая связь – это связь между атомами (положительными ионами) в кристаллической решетке металла, осуществляемая за счет свободно перемещающихся обобществленных электронов. Она имеет место в системах с большим числом атомов, обладающих малой энергией ионизации Еи. Энергия связи внешних электронов со своими ядрами мала, поэтому небольшая часть атомов (3–5 %) теряют свои валентные электроны. Являясь практически свободными, они образуют протяженные общие орбитали (одно общее электронное облако), занимающие весь объем кристалла. Единую систему электронов в металлических веществах обычно называют электронным газом. Электронный газ, заполняя промежутки между положительными ионами, связывает их между собой своим отрицательным зарядом. Таким образом, металл можно представить в виде остова из положительных ионов, погруженного в электронный газ, который компенсирует силы взаимного отталкивания положительных ионов.
В любой момент времени существует динамическое равновесие между атомами, катионами металла и электронами (электроны, отры-
93

Раздел 1. Основные положения физико химической кристаллографии
ваясь от какого-нибудь атома, превращают его в катион, но в то же время другой катион, притягивая электроны, становится опять нейтральным). Это в целом отрицательно заряженное облако удерживает
вкристалле катионы металлов, поэтому металл всегда содержит ряд положительных ионов (расположенных в определенных положениях кристаллической решетки) и большое количество электронов (свободно перемещающихся по всему кристаллу).
Таким образом, металлическую связь можно интерпретировать как совокупность плотноупакованных атомных остовов и электронов, делокализованных по всему объему.
Металлическая связь встречается во всех металлах, а также
внекоторых карбидах. Она очень прочная (энергия связи – до 600 кДж · моль–1), что обеспечивает высокие механические свойства металлов. В силу сферической симметрии ионов в узлах решетки металлическая связь не является направленной. Поэтому подавляющее большинство металлов кристаллизуется в наиболее плотные упаковки гексагональной и кубической сингонии.
Отсутствие направленной связи между атомами в металлах делает возможным два способа их деформации при изгибе. Во-первых, может изменяться расстояние между соседними атомами в кристаллической решетке – упругая деформация; во-вторых, может происходить смещение атомных слоев относительно друг друга – пластическая деформация. Упругая деформация используется в материалах с «механической памятью» (например, пружина), пластическая деформация – в материалах, которые остаются деформированными.
Хотя металлы, как правило, характеризуются высокой кристалличностью, можно получить и аморфные сплавы, которые также называют металлическими стеклами. В качестве примера можно привести
многокомпонентный сплав Zr41Ti14Ni12Cu10Be23. Такие материалы сочетают свойства пластмасс и металлов и в настоящее время используются в трансформаторах, бронебойных снарядах и даже в спортивном снаряжении (клюшки для гольфа, теннисные ракетки и бейсбольные биты). В отличие от оконного стекла, металлическое стекло не является хрупким: при механических воздействиях оно легко деформируется и сохраняет новую форму. Причина этого свойства – множественные дефекты кристаллической решетки.
Аморфные металлические материалы получают различными методами. При этом для предотвращения кристаллизации металла
вобщем случае требуется очень высокая скорость охлаждения
94

Глава 2. Элементы кристаллохимии
(свыше 106 К · с–1), которая достигается при контакте расплавленного металла или сплава с материалом, обладающим высокой теплопроводностью (например, с медью). Этот метод называется также формо-
ванием волокна из расплава (melt spinning) или литьем расплава (melt extraction): в результате получаются металлические ленты шириной до 15 см и толщиной около 30 мкм.
Другой часто используемый способ основан на технологии осаждения тонких металлических пленок из пара. При последующей термообработке у беспорядочно расположенных в пленке атомов появляется возможность организоваться в кристаллическую решетку.
2.2.5. Молекулярная связь
Существует класс твердых веществ, построенных из молекул, которые удерживаются в кристаллической структуре слабыми межмолекулярными силами. Межмолекулярное взаимодействие имеет электрическую природу и складывается из сил притяжения (ориентационных, индукционных, дисперсионных) и сил отталкивания, называемых силами Ван-дер-Ваальса. Основу вандерваальсовых сил составляют кулоновские силы взаимодействия между электронами
иядрами одной молекулы и ядрами и электронами другой молекулы. На определенном расстоянии между молекулами силы притяжения
иотталкивания уравновешивают друг друга и образуется устойчивая система. Поскольку эти взаимодействия гораздо слабее ионных и металлических, молекулярные вещества характеризуются низкими температурами плавления.
Силы притяжения. Ориентационные силы действуют между полярными молекулами, обладающими дипольными электрическими моментами (см. гл. 3). При расположении полярных молекул на достаточно малом расстоянии друг от друга они стремятся сблизиться разноименно заряженными концами (рис. 2.4, а), уменьшая свою суммарную энергию. Притяжение между двумя полярными молеку-
лами, известное как диполь-дипольное взаимодействие, максимально в том случае, когда их дипольные моменты располагаются вдоль одной линии. Эта сила возникает благодаря тому, что расстояния между разноименными зарядами немного меньше, чем между одноименными. В результате притяжение диполей превосходит их отталкивание. Взаимодействие диполей зависит от их взаимной ориентации, поэтому
95
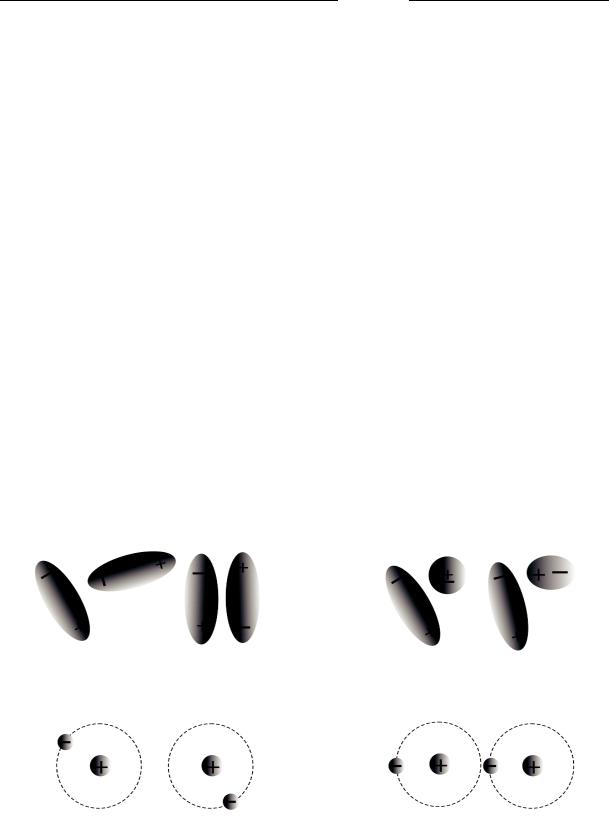
Раздел 1. Основныеположен ия физико химической кристаллографии
силы дипольного взаимодействия называют «ориентационными». Хаотическое тепловое движение непрерывно м еняет ориентаци ю полярны х молекул, однако среднее по всевозможным ори ентациям значение силы имеет определен ную величину, не равную нулю. Сила взаимодействия пропорциональна r6 и убывает с расстоянием значительно быстрее, чем кулоновская сила взаимодействия заряженных тел, пропорциональная r2. Притяжение «диполь – диполь» может осущ ествляться только тогда, когда энергия притяжения превышает тепловую энергию молекул, что об ычно имеет место в твердых и жидких веществах. Дипольдипольн ое взаимодействие проявляется в полярных жидкостях (вода, фтороводород).
Менее интенсивным является индукци онное взаимодействие
(рис. 2.4, б). О но возникает между полярной и неполярной молекулами. Полярная молекула создает электрическое поле, которое поляризует молекулу с электрическими зарядами, рав номерно распределенными по объему. Под действием заряж енных концов полярной молекулы электро нные облака неполярных молекул смеща ются в сторону полож ительного заряда. Неполярная м олекула станови тся полярной, и молекулы начинают притягиваться друг к другу, только намного слабее, чем две полярные молекулы. Дальней шее их взаимодействие развивается по дипольно-орие нтационн ому механизму.
а |
б |
в
Рис. 2.4 . Механизм образования дипольно-ори ентационных (а), индукционных (б) и дисперсионных ( в) межмолекулярн ых связей
96

Глава 2. Элементы кристаллохимии
Притяжение постоянного и наведенного диполей обычно очень слабое, поскольку поляризуемость молекул большинства веществ невелика. Оно действует только на очень малых расстояниях между диполями. Этот вид взаимодействия проявляется главным образом в растворах полярных соединений в неполярных растворителях.
Дисперсионнный механизм (рис. 2.4, в) в чистом виде наблюда-
ется лишь при взаимодействии неполярных молекул. В этом случае энергетически выгодным является такое состояние частичной синхронизации движения электронов по орбиталям, при котором кулоновская энергия взаимодействия системы атомов минимальна. Природа этого взаимодействия была выяснена полностью только после создания квантовой механики. В атомах и молекулах электроны сложным образом движутся вокруг ядер. Если бы среднее положение ядра всегда совпадало с центром окружающего его сферического электронного облака, то имела бы место полная компенсация электрических зарядов и отсутствие взаимодействия между соседними атомами. В действительности вращающиеся вокруг ядра электроны с определенной вероятностью находятся в окрестностях любой заданной точки и занимают какое-то определенное положение. Поэтому мгновенное значение дипольного момента отлично от нуля. Мгновенный диполь создает электрическое поле, поляризующее соседние молекулы. В результате возникает взаимодействие мгновенных диполей. Энергия взаимодействия между неполярными молекулами есть средний результат взаимодействия всевозможных мгновенных диполей с дипольными моментами, которые они наводят в соседних молекулах благодаря индукции. Соседние диполи притягиваются друг к другу, уменьшая при этом общую энергию системы, и образуют кристалл.
Дисперсионные силы действуют между всеми атомами и молекулами, так как механизм их появления не зависит от того, есть ли у молекул (атомов) постоянные дипольные моменты или нет.
Дисперсионная связь в чистом виде реализуется только при кристаллизации инертных газов, атомы которых, имея валентнонасыщенную и сферически симметричную оболочку, обладают нулевым сродством к электрону и нулевым дипольным моментом. При кристаллизации двухатомных и многоатомных молекул (типа N2, O2, CH4 и т. п.) к дисперсионным силам добавляются ориентационные и индукционные силы Ван-дер-Ваальса.
Силы отталкивания действуют между молекулами на очень малых расстояниях, когда в соприкосновение приходят заполнен-
97

Раздел 1. Основные положения физико химической кристаллографии
ные электронные оболочки атомов, входящих в состав молекул (см. рис. 2.2, а). Принцип Паули запрещает проникновение заполненных электронных оболочек друг в друга. Поэтому между ними возникают силы отталкивания, которые зависят в большей степени, чем силы притяжения, от природы молекул.
Общее уравнение межмолекулярного взаимодействия при постоянной температуре – уравнение Леннарда – Джонсона имеет вид
E = −a r6 +b
r6 +b r12 ,
r12 ,
где E – энергия притяжения; а, b – коэффициенты.
2.2.6. Водородная связь
Водородная связь – это связь между положительно поляризованным атомом водорода одной молекулы и сильно отрицательно поляризованным атомом другой молекулы, т. е. это взаимодействие между двумя электроотрицательными атомами одной или разных молекул по-
средством атома водорода: А−Н...В (чертой обозначена ковалентная связь, тремя точками – водородная связь). Электрон атома водорода в этом случае смещается в сторону атома другой молекулы, вследствие чего на атоме водорода возникает эффективный положительный заряд, а отсутствие внутренних электронных слоев у атома Н позволяет другому атому сближаться с ним до расстояния близкого к длине атомной связи. Наполовину заполненная орбиталь атома водорода частично присоединяет пару электронов атома другой молекулы.
Водородная связь сильнее обычного притяжения молекул, поэтому разрушить молекулы вещества с водородной связью очень трудно, а оторвать их друг от друга значительно легче. Водородная связь является промежуточной между химической и межмолекулярной. Она имеет частично электростатический, частично донорно-акцепторный характер. С повышением температуры число таких связей сокращается. Наличие водородных связей влияет на физические и химические свойства веществ и объясняет высокие температуры кипения воды
испиртов. Она может существовать как между одинаковыми, так
имежду различными молекулами, в том числе между разными частями одной и той же молекулы. Наиболее распространенной является водородная связь между молекулами, содержащими гидроксильные группы OH. В большинстве случаев она слабее ковалентной, но существенно
98

Глава 2. Элементы кристаллохимии
сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах. В отличие от межмолекулярных взаимодействий водородная связь обладает свойствами направленности и насыщаемости, поэтому ее нередко считают одной из разновидностей ковалентной химической связи. Одним из признаков водородной связи может служить расстояние между атомом водорода и другим атомом, ее образующим: оно должно быть меньше, чем сумма радиусов этих атомов. Чаще встречаются несимметричные водородные связи, в которых рас-
стояние Н...В больше, чем расстояние А−В. Угол между атомами
во фрагменте А−Н...В обычно близок к 180º. Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы, то говорят о межмолекулярной водородной связи. В последнем случае молекулы образуют довольно прочные пары, цепочки, кольца.
Водородные связи обнаружены во многих химических соединениях. Они возникают, как правило, между атомами фтора, азота и кислорода (наиболее электроотрицательные элементы), реже – при участии атомов хлора, серы и других неметаллов (наиболее сильные водородные связи образуются с участием атомов фтора). При кристаллизации водородные связи в этих веществах обычно сохраняются. Поэтому их кристаллические структуры имеют вид цепей (метанол), плоских двухмерных слоев (борная кислота), пространственных трехмерных сеток (лед).
Наличием водородных связей обусловлены уникальные свойства многих веществ, в том числе воды. Трехатомная молекула Н2О образует четыре водородные связи. В их образовании принимают участие оба атома водорода, а атом кислорода, имеющий две неподеленные электронные пары, образует две водородные связи с атомами водорода соседних молекул воды.
Если бы не было водородных связей, то температуры плавления льда и кипения воды были бы существенно ниже, как это наблюдается у других водородных соединений неметаллов.
При замерзании вода расширяется и занимает больший объем. Плотность льда (0,92 г · мл–1) меньше, чем плотность воды. В структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода – из других молекул воды. В результате образуется очень рыхлая, «ажурная» структура и лед плавает на поверхности воды. Если бы у льда была более высокая плотность,
99
