
- •Абсорбционные методы. Фотометрия
- •1.2.1 Общие теоретические положения. Электромагнитный спектр и его характеристика
- •Максимумы поглощения некоторых хромофоров и соответствующие им типы электронных переходов
- •1.2.2 Основной закон светопоглощения
- •Характеристика методов, основанных на поглощении электромагнитного излучения
- •1.2.3 Фотометрия в видимой области спектра
- •1.2.3.1 Колориметрия
- •Варианты колориметрического метода
- •1.2.3.2 Фотоколориметрия и спектрофотометрия
- •1.2.3.3 Типы реакций, применяемых в фотометрии. Требования к ним
- •1.2.3.4 Стадии фотометрического анализа
- •1.2.3.5 Применение фотометрии в видимой области в фармацевтическом анализе
- •1.2.3.5.1 Фармакопейный анализ
- •3. Расчет концентрации по величинам удельного или молярного коэффициентов поглощения.
- •1.2.3.5.2 Анализ лекарственных средств аптечного изготовления
- •1.2.3.5.2.1 Колориметрический метод
- •1.2.3.5.2.2 Фотоколориметрический метод
- •Спектрофотометрия в уф-области
- •1.3.1 Применение уф-спектрофотометрии в фармацевтическом анализе
- •Характеристика уф-спектров, используемая при идентификации некоторых лекарственных веществ в фармакопейном анализе
- •1.3.1.1 Испытание на подлинность
- •1.3.1.2 Испытание по тестам “Растворение”, “Однородность дозирования”
- •1.3.1.3 Количественное определение
- •Использование уф-спектрофотометрии в количественном анализе некоторых лекарственных средств
- •1.3.1.4 Анализ многокомпонентных лекарственных форм
- •Спектрофотометрия в ик-области.
- •1.4.1 Краткие теоретические положения
- •1.4.2 Область практического применения ик-спектрофотометрии в фармацевтическом анализе
- •1.4.2.1 Применение ик-спектрофотометрии в исследовательских целях
- •Условия получения ик-спектров некоторых лекарственных веществ
- •1.4.2.2 Установление подлинности
- •1.4.2.3 Определение чистоты и обнаружение примесей
- •1.4.2.4 Ик-спектрофотометрия в количественном анализе
- •Характеристические частоты поглощения алканов, алкенов и ароматических соединений (бензол, нафталин, фенантрен и другие аналогичные соединения)
- •Характеристические частоты поглощения иминов, аминов и их солей
- •Характеристические частоты поглощения карбонильных групп
1.3.1 Применение уф-спектрофотометрии в фармацевтическом анализе
Благодаря простоте аналитических операций и, в большинстве случаев, высокой чувствительности метод нашел широкое применение в фармацевтическом анализе.
УФ-спектрофотометрия используется при установлении подлинности (идентификации), доброкачественности, количественном определении, как индивидуальных веществ, так и компонентов лекарственных форм; испытании по тестам “Растворение” и “Однородность дозирования”.
Метод применяется на таких стадиях изучения лекарственных веществ и лекарственных форм как фармакокинетика, биодоступность, изучение стабильности и установление сроков годности.
Испытание на подлинность лекарственных веществ. В основе этой стадии фармацевтического анализа лежат следующие приемы:
а) нахождение в спектре λmax и λmin , характеризующих области максимального и минимального поглощения;
б) вычисление отношения значений оптических плотностей исследуемого раствора при разных длинах волн;
в) характеристика
интенсивности поглощения по величине
удельного показателя (Е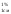 );
);
г) сравнение спектра анализируемого вещества со спектром стандартного образца этого же вещества.
Во всех случаях необходимо получение спектра в условиях, приведенных в НД – растворитель, концентрация, интервал длин волн, размер (толщина) кюветы.
Для случая (а) в полученном спектре находят λmax и λmin, сравнивают с такими же характеристиками, приведенными в НД – при идентичности веществ оба значения должны совпадать (табл.7).
Удобным приемом при испытании на подлинность является определение отношения величин поглощения при двух максимумах. Это уменьшает влияние переменных характеристик прибора на испытание и исключает необходимость использования стандартного образца. Такой способ используют в случае анализа натрия пара-аминосалицилата натрия
Таблица 7
Характеристика уф-спектров, используемая при идентификации некоторых лекарственных веществ в фармакопейном анализе
|
№ п/п |
Лекарствен-ное вещество |
Концентрация и растворитель |
Характеристика, используемая для идентификации |
|
1 |
2 |
3 |
4 |
|
1 |
Амлодипина бесилат |
0,005% в 1% растворе 0,1 М HClв метаноле |
λmax
= 360 ± 2нм; Е |
|
2 |
Аминазин |
0,0005% в 0,01 М HCl |
λmax = 254±2нм, 307±2нм |
|
3 |
Анестезин |
0,0005% в 0,1 М NaOH |
λmax = 281±2нм; λmin = 238±2нм |
|
4 |
Верапамила гидрохлорид |
0,002% в 0,01 М HCl |
D229 = 0,61 – 0,64 D278= 0,23 – 0,24 |
|
5 |
Дексаметазон |
0,001% в 95% спирте |
λmax = 240±2нм; D240нм/D263нм= 1,9 – 2,1 |
|
6 |
Дибазол |
0,002% в 95% спирте |
λmax=244±2нм, 275±2нм, 281±2нм; λmin=230±2нм, 259±2нм, 279±2нм; приведен рисунок спектра |
|
7 |
Димедрол |
0,05% в 95% спирте |
λmax=253±2нм, 258±2нм, 264±2нм; λmin=244±2нм, 255±2нм, 263±2нм |
|
8 |
Дротаверина гидрохлорид |
0,0015% в 0,1 М HCl |
λmax=241±2нм,302±2нм,353±2нм; λmin=223±2нм,262±2нм,322±2нм |
|
9 |
Зопиклон |
0,001% в 0,1 М HCl |
λmax=303±2нм; D303=0,340-0,380 |
|
10 |
Камфора |
0,0006% раствор 2,4-динитрофенилгидразона камфоры в 95% спирте этиловом |
λmax= 231±2нм, 265±2нм; плечо в области от 273 нм до 277 нм |
|
11 |
Кислота аскорбиновая |
0,001% в буферном растворе с рН 7,0 |
λmax=265±2нм |
|
12 |
Кислота никотиновая |
0,002% в 0,1 М NaOH |
λmax=258±2нм, 264±2нм, 270±2нм; λmin=240±2нм; в области от 240нм до 256нм наблюдаются два неидентифицированных плеча |
|
13 |
Кислота фолиевая |
0,001% в 0,1 М NaOH |
Полное совпадение со спектром ГСО в области от 230 до 380 нм |
|
14 |
Нитроксолин |
0,0005% раствор в смеси 95% спирт – буферный раствор с рН 9,18 (98:2) |
λmax=249±2нм, 341±2нм, 452,5±2нм; два плеча в области от 228нм до 238нм и от 258нм до 268нм |
|
15 |
Офлоксацин |
0,001% в 0,1 М HCl |
λmax= 226±2нм, 295±2нм; λmin= 265±2нм |
|
16 |
Папаверина гидрохлорид |
0,0025% в 0,01 М HCl |
λmax= 285±3нм, 309±2нм; λmin= 289±2нм |
|
17 |
Пирацетам |
1% водный раствор |
Не имеет выраженных максимумов поглощения в области от 230нм до 350нм |
|
18 |
Прогестерон |
0,001% в 95% спирте |
λmax=
241±2нм; Е |
|
1 |
2 |
3 |
4 |
|
19 |
Ранитидина гидрохлорид |
0,01% водный раствор |
λmax= 229±2нм; 315±2нм; D229нм/D315нм= 1,01 – 1,07 |
|
20 |
Сульфа-диметоксин |
0,000015% в NaOH 0,000015% в HCl |
Спектр щелочного раствора препарата, снятый относительно кислого раствора имеет λmax=253±2нм, 268±2нм; λmin= 260±2нм; Спектр кислого раствора препарата, снятый относительно щелочного раствора, имеет λmax=288±2нм |
|
21 |
Тамоксифена цитрат |
0,002% в метаноле |
λmax=237нм, 275нм |
|
22 |
Фамотидин |
0,0025% в фосфатном буфере |
Полное совпадение со спектром РСО в области от 230нм до 350нм |
|
23 |
Фуразолидон |
0,0015% в ДМФА |
λmax=260±2нм, 367±2нм; λmin=302±2нм |
|
24 |
Фурацилин |
0,0006% в ДМФА |
λmax=260±2нм, 375±2нм; λmin=306±2нм |
При испытании на
подлинность часто рекомендуется
рассчитать Е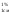 в максимуме поглощения (например, для
левомицетина, адреналина, прогестерона)
или сравнить найденное значение
оптической плотности в определенном
диапазоне длин волн со значениями,
приведенными в НД. Так спектр поглощения
раствора пиридоксина гидрохлорида в
фосфатном буферном растворе (рН = 6,9) с
концентрацией 0,5 мг/мл в области от 230
до 250 нм имеет максимумы при 254 и 324 нм, а
оптическая плотность при этих максимумах
равна соответственно 0,18 и 0,35.
в максимуме поглощения (например, для
левомицетина, адреналина, прогестерона)
или сравнить найденное значение
оптической плотности в определенном
диапазоне длин волн со значениями,
приведенными в НД. Так спектр поглощения
раствора пиридоксина гидрохлорида в
фосфатном буферном растворе (рН = 6,9) с
концентрацией 0,5 мг/мл в области от 230
до 250 нм имеет максимумы при 254 и 324 нм, а
оптическая плотность при этих максимумах
равна соответственно 0,18 и 0,35.
Некоторые испытания на подлинность с использованием УФ-спектрофотометрии требуют применение стандартных образцов (СО) лекарственных веществ. В этом случае проба СО должна быть приготовлена и одновременно определена в тех же условиях, что и испытуемое вещество. Так, УФ-спектр 0,0005% раствора этинитэстрадиола в спирте этиловом должен иметь максимумы и минимумы при тех же длинах волн, что и раствор СО одинаковой концентрации, соответствующие величины поглощения, рассчитанные на сухое вещество при λmax = 281 нм не должны отличаться более, чем на 3%. Такой прием обеспечивает более достоверные результаты, чем при анализе спектра только одного исследуемого соединения.
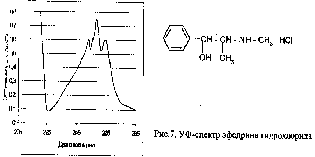
УФ-спектрофотометрия является также одним из составных комплекса спектральных методов исследования новых биологически активных веществ. Определенные полосы поглощения в спектре могут указать на наличие в структуре этого соединения тех или иных функциональных групп, фрагментов структур (хромофоров). Этим объясняется сходство спектров веществ, содержащих фенильный радикал, например, эфедрина, димедрола, атропина, бензилпенициллина. Они имеют три максимума поглощения: 251, 257 и 263 нм (рис.7).
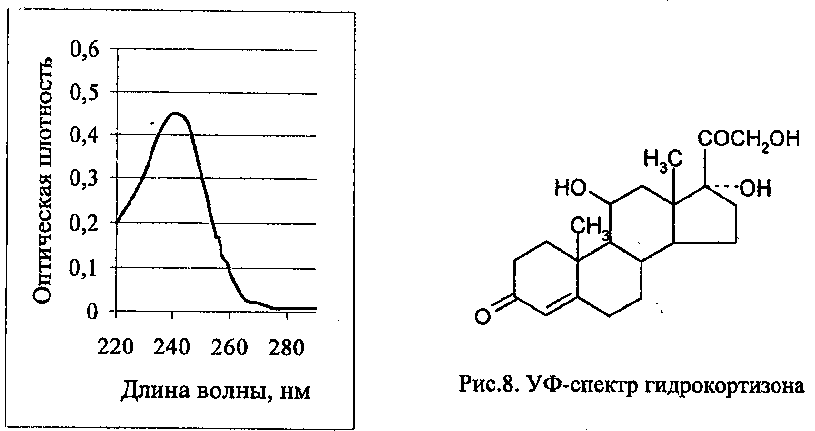
Лекарственные вещества, содержащие замещенный ароматический радикал – адреналин, морфин, эстрадиол, левомицетин и др. – имеют в спектре один максимум около 260 нм, сопряженную еноновую систему в лекарственных веществах из группы кортикостероидов – около 238 нм (рис.8).
У некоторых лекарственных веществ (производные барбитуровой кислоты, сульфаниламиды, фенолы, некоторые производные пурина и др.) характер спектра может изменяться в зависимости от рН раствора (рис. 9, 10, 11, 12, 14). При этом изменяется λmax (батохромное смещение), усиливается поглощение (увеличивается величина оптической плотности), наблюдается гиперхромный эффект. Кофеин не проявляет кислотных свойств, поэтому максимум поглощения у него в кислой и щелочной среде при одной и той же длине волны – 272 нм (рис. 13). То есть, УФ-спектрофотометрия может дать информацию об определенных свойствах исследуемого вещества.
Одназначного вывода о структуре химического соединения с помощью УФ-спектрофотометрии сделать невозможно, так как интерпретация спектра затруднена из-за присутствия в молекуле более чем одного хромофора. Тем не менее метод позволяет определить некоторые группировки – хромофоры и сделать вывод о характере и степени сопряжения (с удлинением цепи сопряжения наблюдается смещение максимума поглощения в более длинноволновую область, рис.11).





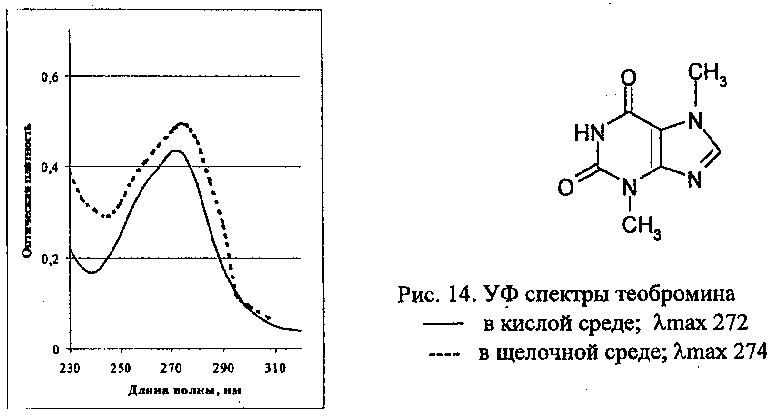
УФ-спектрофотометрия используется для изучения свойств органических соединений: способности к образованию водородной связи, определения рКа кислот и оснований, определения состава и свойств комплексных соединений лекарственных веществ, изомерии.
Цис- и транс- изомеры имеют отличные друг от друга спектры. Транс-форма обычно поглощает сильнее и полоса ее поглощения сдвинута в длинноволновую область; этот факт может служить доказательством изменения структуры в ходе реакции.
Однако, УФ-спектры не дают каких-либо сведений о строении исследуемого вещества, т.к. они позволяют установить лишь наличие хромофоров и гетероатомов.
Кроме того, УФ-спектрофотометрия дает прекрасную возможность для количественного анализа веществ, содержащих такие группировки.
При испытании на доброкачественность (чистоту) используют те же характеристики, что и при идентификации. При наличии примесей может изменяться λmax, появляться дополнительные максимумы, изменяться интенсивность поглощения.
Специфические примеси, присутствующие в лекарственных веществах, как правило, имеют близкое химическое строение с исследуемым веществом. Поэтому особый интерес представляют случаи, когда лекарственное вещество и его специфическая примесь поглощают при разных длинах волн.
Например, λmax адреналина (Ι) располагается при 278 нм, а его специфическая примесь – адренолон (ΙΙ) имеет максимум поглощения при 310 нм.
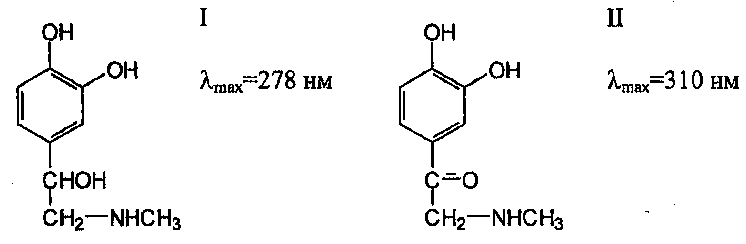
Согласно требованию фармакопейной статьи, в 0,05% растворе адреналина, приготовленном для испытания на чистоту, оптическая плотность при 310 нм не должна превышать 0,1 (т.е. в адреналине допускается строго нормируемое содержание адренолона).
Количественное определение. Принцип количественного определения методом УФ-спектрофотометрии заключается в следующем: навеску анализируемого образца (субстанция, лекарственная форма и др.) растворяют в подходящем растворителе, если необходимо, дополнительно готовят разведение полученного раствора и измеряют его оптическую плотность при длине волны, указанной в методике. Концентрацию (содержание) анализируемого вещества находят одним из описанных ранее способов (п. 1.2.3.4).
В соответствии с современными требованиями для таблеток, драже, сухих лекарственных средств для инъекций и лекарственных веществ в капсулах с содержанием действующего вещества 0,05 г и менее обязательным является испытание на однородность дозирования, т.е. содержание вещества в каждой отдельной дозе. Для такой оценки, особенно в случае содержания действующего вещества в мг или его долях (таблетки клофелина содержат 0,075 и 0,15 мг действующего вещества) требуется применение высокочувствительного метода. Таким в большинстве случаев и является УФ-спектрофотометрия.
Актуальным является исследование биодоступности лекарственных веществ. Определенной ее характеристикой является тест “Растворение” (ГФ ΧΙ, вып. 2, с.154). УФ-спектрофотометрия, отличающаяся, как правило, высокой чувствительностью является одним из наиболее часто используемых для этой цели методов (табл.8).
Ниже приводятся методики анализа некоторых лекарственных веществ спектрофотометрическим методом в УФ-области, а в табл.8 приведен ряд примеров использования метода УФ-спектрофотометрии в фармакопейном анализе.

 =
113-121
=
113-121 =
518-545
=
518-545