
- •Оглавление
- •Введение
- •Порядок проведения лабораторного практикума
- •Содержание отчёта
- •Образец титульного листа отчёта о работе
- •Пример готового отчёта
- •7.Расчёт погрешностей:
- •Вычисление погрешностей результатов измерений
- •Графическое представление результатов измерений
- •Нахождение погрешностей при графическом представлении результатов измерений
- •Правила приближённых вычислений и записи результатов измерений
- •Лабораторная работа №1 определение плотности твёрдого тела цилиндрической формы
- •Порядок выполнения работы
- •Описание метода гидростатического взвешивания
- •Порядок выполнения работы
- •Лабораторная работа №3 определение ускорения свободного паденияпри помощи оборотного маятника
- •Порядок выполнения работы
- •Задание
- •Лабораторная работа №4 изучение законов вращательного движения при помощи маятника обербека
- •Порядок выполнения работы
- •Лабораторная работа № 5 определение момента инерции тел методом крутильных колебаний
- •Порядок выполнения работы
- •Лабораторная работа № 6
- •Окончательно, формула для расчета радиуса кривизны вогнутой поверхности будет иметь вид:
- •Порядок выполнения работы
- •Лабораторная работа №7 определение коэффициента восстановления
- •Описание экспериментальной установки
- •Порядок выполнения работы
- •Лабораторная работа №8 определение продолжительности и средней силы удара
- •Порядок выполнения работы
- •Лабораторная работа № 9 определение коэффициента трения качения методом наклонного маятника
- •Описание установки
- •Порядок выполнения работы
- •Лабораторная работа № 10 определение модуля юнга металла методом одноосного растяжения
- •Описание установки
- •Порядок выполнения работы
- •Лабораторная работа №11
- •Описание установки и порядка проведения эксперимента
- •Порядок выполнения работы
- •Лабораторная работа №12-а определение коэффициента поверхностного натяжения методом отрывания кольца
- •Описание установки и методики измерений
- •Порядок выполнения работы
- •Лабораторная работа №12-б
- •Описание установки
- •Описание методики измерний и экспериментальной установки
- •Порядок проведения работы
- •Определение коэффициента теплопроводности металла
- •Описание установки
- •Порядок выполнения работы
Лабораторная работа №11
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ УДЕЛЬНЫХ
ТЕПЛОЁМКОСТЕЙ ГАЗА ПРИ ПОСТОЯННОМ
ДАВЛЕНИИ
И ПОСТОЯННОМ ОБЪЁМЕ
![]()
ПО СПОСОБУ КЛЕМАНА И ДЕЗОРМА
Теплоёмкостью тела C называется количество теплоты Q, которое нужно сообщить телу для увеличения его температуры на T=1К:
![]() или
или
![]() (1)
(1)
Под dQ здесь понимается бесконечно малое приращение количества тепла, вызывающее приращение температуры на dT.
Теплоёмкость является важной характеристикой, отражающей внутренние особенности строения вещества.
Если масса вещества равна 1 кг, теплоёмкость называется удельной Суд, если масса равна 1 молю, теплоёмкость называется молярной Смол. Далее в работе говорится об удельной теплоёмкости.
В газе различают удельную теплоёмкость при постоянном объёме Cv и удельную теплоёмкость при постоянном давлении Ср. Существование двух теплоёмкостей для газа определяется способами подачи к нему тепловой энергии Q.
По первому началу (закону) термодинамики:
![]() (2)
(2)
В этом уравнении dU – изменение внутренней энергии газа при его нагреве, p·dV – совершаемая им работа.
При постоянном объёме газа второе слагаемое в уравнении (2) равно нулю, и всё тепло, получаемое газом, идёт на увеличение его внутренней энергии. Поэтому удельная теплоёмкость газа при постоянном объёме равна:
![]() (3)
(3)
Если при нагревании газа поддерживать постоянным его давление, то тепло идёт не только на увеличение внутренней энергии, но и на совершение работы. Удельная теплоёмкость при постоянном давлении оказывается равной:
![]() (4)
(4)
Следовательно, Cp > Cv. Можно показать, что соотношение между этими теплоёмкостями имеет вид:
![]() (5)
(5)
Здесь m – масса газа, М – его молярная масса, R – универсальная газовая постоянная. Важной характеристикой газа является отношение удельных теплоёмкостей при постоянном давлении и постоянном объёме:
![]() . (6)
. (6)
Цель
работы - определение
величины
![]() для воздуха.
для воздуха.
Поставленная цель достигается использованием способа, предложенного Клеманом и Дезормом. В основе его лежит рассмотрение адиабатных процессов в газе при изменении его объёма и давления.
Адиабатным процессом называется процесс, происходящий без теплообмена с окружающей средой. Связь между объёмом и давлением газа при адиабатном процессе даётся уравнением Пуассона:
![]() (7)
(7)
Экспонента
![]() в этом уравнении определяется соотношением
(6). При адиабатном процессе работа
совершается только за счёт изменения
внутренней энергии газа. Поэтому при
адиабатном расширении температура газа
понижается.
в этом уравнении определяется соотношением
(6). При адиабатном процессе работа
совершается только за счёт изменения
внутренней энергии газа. Поэтому при
адиабатном расширении температура газа
понижается.
|
|
|
Рассмотрим газ, заключённый в закрытый сосуд с пробкой, имеющий объём V2 (рис.1). Состояние газа характеризуется параметрами p1,T1. Газ находится в термодинамическом равновесии с окружающей средой, имеющей температуру Т1. Вынем пробку, после чего часть газа выйдет из сосуда. В сосуде установится давление ро, равное внешнему |
давлению. Доля газа V1, занимавшая часть объёма сосуда (отмечена пунктиром на рис.1) расширится до объёма V2. После установления в сосуде давления ро, закроем пробку. Если процесс расширения газа происходит достаточно быстро, его в первом приближении можно считать адиабатическим. Температура газа понизится до Т2. Состояние газа в этих условиях будет характеризоваться параметрами ро, V2, T2. Затем газ, в результате теплообмена с окружающей средой, будет нагреваться, давление в сосуде повысится, и конечные параметры газа станут равными р2, V2, T1, и газ придёт в термодинамически равновесное с окружающей средой состояние.
Адиабатный переход части газа V1 из состояния (1) в состояние (2) описывается уравнением:
![]() (8)
(8)
В состояниях термодинамического равновесия (а) и (в) справедливы соотношения
![]() (9)
(9)
![]() (10)
(10)
Совместное
решение уравнений (8) – (10) приводит к
выражению для показателя адиабаты
![]() :
:
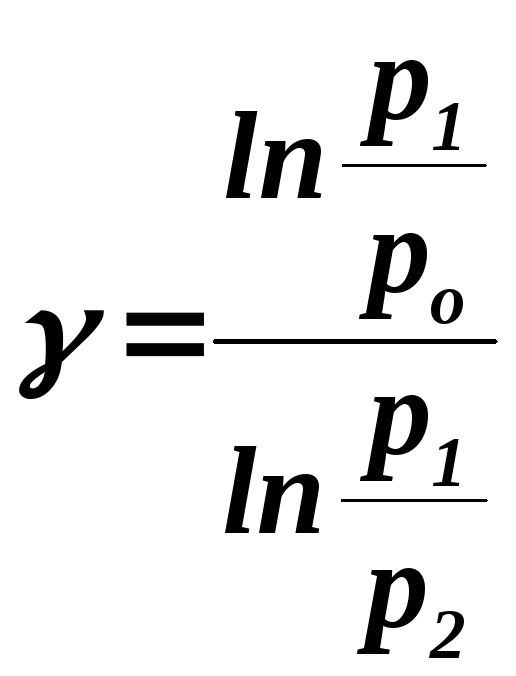 (11)
(11)
При использовании для измерения давления жидкостного манометра, давления р1 и р2 соответственно равны:
![]()
![]()
Здесь
- плотность жидкости в манометре (обычно
воды), h1
и h2-
разность уровней жидкости в коленах
манометра при измерении давления.
Подставив значения р1
и р2
в уравнение (11), при не слишком отличающихся
величинах давлений от внешнего давления
ро,
можно получить соотношение, позволяющее
вычислить величину
![]() :
:
![]() (12)
(12)

