
golovina_n_a_strelkov_yu_a_voronin_v_n_i_dr_ikhtiopatologiya
.pdfинфекционного процесса.
Клинические признаки и патогенез. Клинически заболевание проявляется в форме экссудативно-геморрагического синдрома, развитие которого обусловлено поражением гемопоэтической и экскреторной тканей заднего отдела почки, что ведет к нарушению водно-минерального баланса и выходу плазмы и клеток крови в окружающие ткани и полости тела. Септический процесс приводит к поражению практически всех органов и тканей. У лососевых рыб наиболее тяжело поражаются поджелудочная железа (выраженный некроз секреторных клеток концевых отделов экзокринной части железы), почки и пищеварительный тракт.
Первыми признаками заболевания являются анорексия и угнетение рыб. Больные особи приобретают темную окраску тела, отделяются от стаи, поднимаются к поверхности воды, перемещаются к краям пруда или канала, где течение слабее. При быстром развитии заболевания появляются рыбы с нарушением координации Движений и повышенной возбудимостью. Удар по воде или стенке бассейна вызывает у них кратковременные спиралеобразные движения, сменяющиеся угнетением рыб и опусканием их на дно. Острая вспышка начинается с внезапного появления массовой гибели рыб. У больных особей отмечают экзофтальм, увеличение передней части брюшка, иногда точечные кровоизлияния в перио-кулярной соединительной ткани глаз, у оснований и в межлучевой ткани плавников, на поверхности тела и изредка на голове. Из ануса тянутся длинные слизистые тяжи с беловатым оттенком. На голове у мальков иногда образуется припухлость в виде шапочки (гидроцефалия). При вскрытии в полости тела обнаруживают скопление прозрачного желтоватого (иногда кровянистого) экссудата, множественные петехиальные кровоизлияния на пилоричес-ких придатках, стенках кишечника, перивисцеральной жировой ткани и реже в других местах. Печень, почки и селезенка анемичны. Желчный пузырь переполнен желчью. Отмечают катаральное или геморрагическое воспаление желудочнокишечного тракта. Он свободен от пищи и наполнен слизеподобным содержимым молочно-белого цвета.
Хроническое течение характеризуется менее ярко выраженными признаками и умеренной, растянутой во времени гибелью рыб.
Диагноз. Его ставят на основании анализа эпизоотологических, клинических, патолого-анатомических данных и результатов вирусологических исследований, включающих выделение и серологическую идентификацию вируса, а при необходимости и постановку биопробы.
Меры борьбы. При установлении диагноза ИНПЖ хозяйство объявляется неблагополучным и на него накладывают карантин. Независимо от формы инфекции — вирусоносительство или клинически протекающее заболевание, — факт выделения вируса от рыб достаточен для наложения карантина.
С целью предупреждения появления очагов инфекции оздоровление карантинных хозяйств ведут методом радикальной дезинфекции и летования. Работу по оздоровлению хозяйства проводят в соответствии с разработанным
111

местным органом государственной ветеринарной службы планом, утвержденным администрацией района по аналогии с другими особоопасными вирусными инфекциями.
В Норвегии разработана генноинженерная (рекомбинантная) вакцина против ИНПЖ, применяемая методом инъекций.
5.5. ОСПА КАРПА
Оспа карпа — заразное заболевание вирусной природы.
Этиология. Первые данные, позволяющие рассматривать оспу как вирусное заболевание, появились в 1950-х годах. В дальнейшем при помощи электронной микроскопии в оспенных образованиях на коже карпов обнаружены внутриклеточные элементарные тельца округлой формы. Вирус быть отнесен к группе герпес-вирусов. Его вирионы округлой формы диаметром до 110 нм локализуются в ядре эпителиальных клеток. Нуклеид содержит ДНК и окружен капсидом, заключенным во вторую мембрану (рис. 11).
Рис. 11. Возбудитель оспы карпа
К вирусу чувствительны клеточные линии FHM, МСТ и ЕРС. Эпизоотология. Заболевание характеризуется длительностью
инкубационного периода, который растягивается иногда на год. В результате клинические признаки болезни, как правило, проявляются у двухлетков и крайне редко наблюдаются у сеголетков, хотя источником заражения молоди, несомненно, служат производители.
По мнению ряда авторов, на заболеваемость оказывает влияние наследственная подверженность отдельных стад карпа к оспе; однако эти предположения не подкреплены экспериментальными Данными.
По мнению большинства авторов, условия выращивания рыб влияют на течение болезни. Это в первую очередь искусственное Кормление кормами, бедными витаминами, и недостаток кальция в воде. Высокие плотности посадки, приводящие к замедленному Росту рыб, способствуют массовому
112
заболеванию оспой.
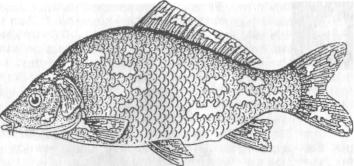
Клинические признаки и патогенез. Оспа характеризуется появлением на поверхности тела и плавниках плоских эпителиальных опухолей — эпителиом. Разрастание охватывает только поверхностную часть кожи. При тяжелой форме заболевания опухоли сливаются вместе в почти сплошной слой, но это наблюдается очень Редко. В начале болезни опухоли мягкие, в дальнейшем становятся плотнее и напоминают парафиновые пятна. Если больных рыб на ранней стадии болезни поместить на сильное течение, эпители-омы у них исчезают, но в дальнейшем могут образоваться снова
(рис. 12).
Рис. 12. Карп, пораженный оспой
Оспа не вызывает гибели, но приводит к отставанию в росте, иногда достигающему 50 %. У больных рыб наблюдается размягчение костей, а в дальнейшем различные деформации скелета. Кроме того, оспенные наросты портят товарный вид рыбы. Поэтому оспа крайне нежелательна в прудовых хозяйствах.
Меры борьбы. Для предупреждения заболевания пруды нужно поддерживать в хорошем санитарном состоянии, не допускать чрезмерно плотных посадок. При недостатке кальция в почве и воде необходимо систематическое известкование прудов, а также добавление к кормам мела (до 10 %). Очень хорошие результаты дает тщательная выбраковка всех заболевших рыб при зарыблении нагульных прудов. Особенно внимательно осуществляют выбраковку больных особей среди маточного стада как при весенней инвентаризации, так и осенью при посадке на зимовку.
5.6. ГЕРПЕСВИРУСНОЕ ЗАБОЛЕВАНИЕ КАНАЛЬНОГО СОМА
Герпесвирусное заболевание канального сома (ГВКС, Channel catfish virus disease, CCVD). Болезнь очень опасна для молоди американского пятнистого, или канального, сома (Ictalurus punctatus).
Этиология. Возбудителем является вирус, отнесенный к группе герпесвирусов. Размножается только на культурах клеток из гонад различных икталурусов при оптимальной температуре 25 "С (рис. 13). С первого пассажа дает характерное ЦПД—образование синцитиальных многоядерных, а также округлых клеток. При воспроизведении заболевания в биопробе
113

патогенным материалом от культур любого пассажа получают 100 %-ную гибель сомиков. Ви-рионы отнесены к ДНК-содержащим герпесвирусам, имеют форму икосаэдра, их диаметр 175—200 нм. Сборка вирусных нуклеокапсидов происходит в ядре, а созревание вирионов — на ядерной мембране при выходе в цитоплазму клетки. Капсид состоит из 162 капсомеров. Вирус сохраняет вирулентность при 25 °С не более 2 сут, но при замораживании (при температуре -20 °С) — до 6 мес. Выделяют его только из мальков сома с внешними симптомами болезни.
Эпизоотология. Заболевание отмечают в США при разведении сома в прудах. На Украине оно было зарегистрировано при выращивании сома в тепловодном бассейновом хозяйстве. Массовая смертность происходит на 5—7-й день после появления первых симптомов болезни. Болезни подвержены мальки и сеголетки канального сома массой до 10 г. Рыбы большей массы, включая производителей, невосприимчивы. Вспышки заболевания отмечают с июня по сентябрь при температуре выше 23 °С, смертность достигает 60 %. Факторами, способствующими возникновению заболевания, являются травмати-зация рыб, дефицит кислорода и другие стрессоры. Экспериментально рыбу заражают через воду, путем внутрибрюшинных инъекций, через рот и нанесением патогенного материала на жабры. Инкубационный период при высокой температуре воды (свыше 23 °С) длится около 3 дней, при ее понижении — удлиняется.
Клиническая картина и патогенез. Заболевшие мальки слабеют, лишь изредка совершая спиральные движения, часто почти вертикально держатся у поверхности воды, затем опускаются на дно и гибнут. Болезнь сопровождается образованием геморрагии на брюшке и плавниках, водянкой брюшной полости тела, пучеглазием и побелением жабр. При вскрытии отмечены кровоизлияния в мышцы, почку, печень, стенки кишечника. Селезенка розоватого цвета, заметно увеличена. В полости тела и в желудке иногда обнаруживается жидкость беловатого цвета.
Рис. 13. Возбудитель герпесвирусного заболевания канального сома
114
Меры борьбы. Неблагополучное хозяйство закрывают на карантин, а очаг купируют. Всю заболевшую рыбу уничтожают, водоем, пруд или бассейн спускают и подвергают дезинфекции негашеной или хлорной известью.
5.7. ГЕРПЕСВИРУСНЫЕ ИНФЕКЦИИ ЛОСОСЕВЫХ
Возбудители. Герпесвирусы выделены от лососевых рыб в Северной Америке (HPV и SHV) и Японии (NeVTA, OMV, CSTV и YTV). Выделенные вирусы подразделяют на две группы: североамериканские изоляты (менее патогенные и не обладающие онко-генными свойствами) и японские изоляты (напротив, обладающие большей патогенностью и способностью вызывать папилломы у выживших после заражения рыб). Помимо этого, вирусы двух данных групп различаются между собой в антигенном отношении и по строению генома.
Вирионы всех изолятов имеют примерно одинаковую морфологию и размер 150—250 нм. К вирусам чувствительны постоянные линии клеток лососевых RTG-2, RTF-1, KF-1, CHSE-214 и др. Цитопатогенное действие в культуре клеток характеризуется образованием симпластов, в ядрах инфицированных клеток обнаруживают включения.
Эпизоотология. HPV был выделен в одном из рыбопитомников США в начале 1970-х годов от производителей радужной форели в связи с наблюдавшейся среди них посленерестовой гибелью. Вирус патогенен для мальков и сеголетков радужной форели в возрасте до 4 мес только при внутрибрюшинном введении, вызывая заболевание и значительную гибель при температуре воды 6—10 °С. Годовики нерки были устойчивы к заболеванию. Японские штаммы вируса, выделенные от симы (OMV), патогенны для молоди лососевых. После заражения месячных мальков вирусом через воду при температуре 10—15 °С нерка оказалась наиболее чувствительной (гибель 100 % рыб). Менее чувствительными были сима и кета (гибель соответственно 87 и 83 % рыб) и еще менее чувствительными — кижуч и радужная форель (гибель соответственно 39 и 29 % рыб). Вирус выделяли из овариальной жидкости производителей и гонад неполовозрелой молоди, в связи с чем предполагается возможность вертикальной передачи инфекции.
Клинические признаки и патогенез. У производителей лососевых клинические признаки заболевания не выражены. При искусственном заражении молоди инкубационный период составляет 14—33 дня. У больных сеголетков радужной форели из анального отверстия выделяются тонкие слизистые шнуры. Затем развиваются экзофтальм, увеличение брюшка. Рыба становится вялой, не принимает корм, опускается и лежит на дне. У части рыб отмечают потемнение кожных покровов, анемию жабр, иногда — кровоизлияния в глазное яблоко. Содержание незрелых эритроцитов в периферической крови возрастает до 10—13 %, гематокрит падает до 12 %.
В брюшной полости присутствует большое количество асцит -ной жидкости, внутренние органы бледные, печень пятнистая, пищеварительный
115
тракт свободен от пищевых масс. Аналогичные изменения происходят у молоди лососевых после заражения ее вирусом симы.
В опытах на симе, кижуче и кете опухоли появились более чем у 60 % выживших рыб через 130—250 дней после заражения вирусом OMV. Они находились на голове, но в одном случае опухоль была обнаружена в почках. Гистологически поверхностные опухоли не отличались от папиллом, регистрируемых у больных рыб в естественных водоемах. Вирусные частицы не были обнаружены в тканях опухолей при электронно-микроскопическом исследовании, но при первичном культивировании опухолевых клеток вирус был реизолирован.
Меры борьбы. Для профилактики герпесвирусных инфекций лососевых рекомендуется обрабатывать оплодотворенную икру иодофорами, а в неблагополучных по заболеванию зонах подвергать подаваемую в бассейны воду ультрафиолетовому облучению.
5.8. ВИРУСНЫЕ БОЛЕЗНИ ОСЕТРОВЫХ
За рубежом у осетровых рыб выявлено 10 различных вирусов. Четыре из них — аденовирус (WSAV), иридовирус — (WSIV) и два герпесвируса (WSHV-1 и WSHV-2) у белого осетра (в США) и один иридовирус (RSIV) - у русского осетра (в Бельгии) вызывают тяжело протекающие заболевания у молоди.
Возбудители. Вирусы, выделенные от белого осетра в США, являются ДНК-геномными. Наиболее опасными и широко распространенными агентами из четырех считаются иридовирус (WSIV) и герпесвирус-2 (WSHV- 2). Герпесвирусы легко выделяются на культурах клеточных линий WSS-2, WSSK-1, WSGO. Иридовирус выделяется на культуре клеток с трудом, аденовирус выделить на клеточных культурах не удается.
Иридовирус (RSIV) от русского осетра обнаружен при электронной микроскопии в виде скопления частиц диаметром 283 нм. Они несколько крупнее, чем вирионы WSIV.
Эпизоотология. Заболевания развиваются весной, в начале лета и осенью при температуре воды 9—20 °С и осложняются миксо-бактериозом и протозойными инвазиями. Стресс является фактором, провоцирующим вспышки эпизоотии, которые сопровождаются гибелью 80—95 % выращиваемой молоди белого осетра в США. Рыбы старшего возраста не болеют, но являются вирусоносителями. Дикие производители считаются главным источником возбудителей инфекций. Вирусы передаются через воду и возможен вертикальный путь передачи вирусов от производителей потомству.
Заболевание молоди русского осетра, вызванное иридовирусом RSIV, вспыхнуло в одном из хозяйств Бельгии после завоза молоди и икры. Гибель четырехмесячной молоди достигала 50 %.
Клинические признаки и патогенез. У больных рыб отмечают
116
анорексию, истощение, угнетение, бледность жабр. Для иридо-вирусного поражения характерно увеличение брюшка и покраснение жучек. Вирус поражает эпидермис жабр и ротоглотки. Гер-песвирус локализуется в эпидермисе различных участков тела, в мышечной стенке, в жабрах. У заболевших рыб наблюдают гиперемию и изъязвления на вентральной части рострума, в области рта и ануса, очаговые скопления слизи на голове и грудных плавниках. При поражении аденовирусом у молоди отмечают истощение, бледность печени, отсутствие корма в кишечнике.
Молодь русского осетра, пораженная RS1V, не реагирует на раздражители, отказывается от корма, приобретает бледную окраску тела, плавает в вертикальном положении, теряет равновесие и погибает. В жабрах больных рыб обнаруживают мелкие кровоизлияния.
Диагноз. Его ставят на основании клинических и эпизоотических данных и подкрепляют результатами вирусологических исследований. Гистологические исследования позволяют выявить наличие большого числа гипертрофированных базофильных клеток в эпидермисе ротоглотки.
Меры борьбы. Они сводятся к созданию оптимальных условий выращивания для рыбы первого года жизни. При отсутствии стрессовых воздействий даже инфицированная молодь белого осетра, но без клинических признаков заболевания выпускается в природные водоемы Северо-Запада США.
5.9. ЛИМФОЦИСТИС
Лимфоцистис (Lymphocystis disease, LD) — вирусная болезнь морских и пресноводных костистых рыб, характеризующаяся гипертрофией соединительнотканных клеток кожи и иногда других тканей.
Возбудитель. Возбудитель лимфоцистиса имеет икосаэдри-ческую форму частиц (вирионов). Их диаметр в зависимости от вида рыб колеблется от 200 до 300 нм. Это крупный ДНК-геномный вирус, относящийся к семейству иридовирусов (рис. 14). Вирус репродуцируется в цитоплазме клеток. Его вирионы имеют внешнюю липидосодержащую оболочку. Снаружи на оболочке имеются отростки, в состав которых входят мукополиса-хариды. К вирусу чувствительны постоянные клеточные линии рыб BF-W, BF-2, МСТ и другие, в которых он размножается при температуре 15—25 °С. Вызываемый вирусом цитопатический эффект развивается медленно (до 30 дней) и проявляется в виде увеличения диаметра инфицированных клеток до 50—70 мкм.
Вирус лимфоцистиса чувствителен к эфиру и глицерину, кислоте (рН 3,0), но устойчив к замораживанию-оттаиванию и обработке ультразвуком в течение 30—90 с. Быстро инактивируется при 25 °С, но хорошо сохраняется при 4 °С и глубоком замораживании (до минус 70 0С).
117

Рис. 14. Возбудитель лимфоцистиса
Эпизоотология. Болезнь распространена очень широко и отмечена более чем у 150 видов рыб, из которых представители отрядов окунеобразных и камбалообразных составляют соответственно 75 и 10 %. Она наблюдается в Балтийском, Баренцевом, Чукотском, Беринговом, Японском и Эгейском морях.
Заболеваемость лимфоцистисом обычно низкая, но иногда может быть значительной. Так, при исследовании обыкновенного робало (Centropomus undecimalis) размером 12—60 см из оз. Мара-канбо (Венесуэла) заболевание отмечали у 36 % выловленных рыб. В Осло-фьорде он был зарегистрирован летом у 1—10 % особей европейской камбалы (Platichthys flesus), а зимой — у 57 % этих рыб.
Клинические признаки и патогенез. Поведение больных рыб не изменяется. При клиническом осмотре на поверхности тела и плавниках пораженных лимфоцистисом рыб можно обнаружить одиночные или множественные узелки (рис. 15). Каждый узелок представляет собой инфицированную вирусом клетку соединительной ткани кожи, диаметр которой увеличился в десятки раз (до 2 мм). Они проступают через покрывающий их эпителий, хорошо видны невооруженным глазом и часто образуют гроздепо-добные скопления, напоминающие ягоды малины. Вокруг них может отмечаться слабая воспалительная реакция. При сильном
118
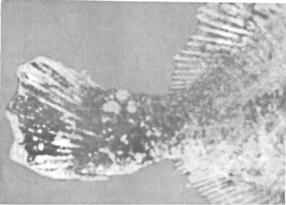
поражении такие клетки могут покрывать более половины поверхности тела больной рыбы. Иногда их находят также в глазах и внутренних органах. Под световым микроскопом видно, что клетки имеют овальную форму, у них увеличены ядро и ядрышко, по периферии цитоплазмы располагаются включения. Снаружи каждая клетка окружена толстой гиалиновой оболочкой.
Рис. 15. Камбала, пораженная лимфоцистисом
Гибели рыб от лимфоцистиса, как правило, не наблюдают. Гипертрофированные клетки разрушаются, и рыба выздоравливает, но может заболеть вновь.
Диагноз. Его ставят на основании клинических, эпизоотологи-ческих данных, электронно-микроскопических и вирусологических исследований.
Меры борьбы. Специальных мер борьбы с болезнью нет.
5.10. ВИРУСНЫЙ НЕКРОЗ ЭРИТРОЦИТОВ
Вирусный некроз эритроцитов (ВНЭ, Viral erythrocytic necrosis, VEN)
— это мягко протекающее заболевание.
Возбудитель. Болезнь вызывают несколько иридовирусов, различающихся размерами вирионов у разных хозяев и по этому признаку условно разделенных на три группы: 310—360 нм — у атлантической трески, около 145 нм — у атлантической сельди и 189—205 нм — у тихоокеанских лососей
итихоокеанской сельди. При электронной микроскопии срезов пораженных эритроцитов вирионы обнаруживаются в цитоплазме и имеют вид правильных шести- и пятиугольников, внутри которых заключен электронноплотный нуклеоид. Выделить вирус ВНЭ от больных рыб не удается.
Эпизоотология. Болезнь распространена очень широко и отмечена у нескольких десятков видов рыб, представляющих около 20 семейств морских
ианадромных рыб в районах тихоокеанского и атлантического побережий Северной Америки, Гренландии, Великобритании, Португалии и Норвегии, в Средиземном море и в прибрежных водах северной части Японии. Вероятно, на российском Северо-Западе и Дальнем Востоке возбудители ВНЭ также имеются.
119
Из лососевых рыб заболевание наблюдали у океанических и идущих на нерест кеты и горбуши, а также у атлантического лосося при выращивании в морской воде. ВНЭ-включения в эритроцитах обнаружены у производителей кеты, чавычи, кижуча и стального-лового лосося в рыбопитомниках штата Орегон (США). Болезнь обнаружена у черной кефали (Mugil cephalus) в Португалии.
Более того, включения были выявлены также в эритроцитах личинок кеты и молоди кижуча, полученных из икры инфицированных производителей. Это показывает, что заражение рыб может происходить на ранних стадиях развития, протекающих в пресной воде, и вероятно — вертикальным путем. При экспериментальном заражении в пресной воде к заболеванию были восприимчивы мальки кеты, горбуши, нерки, чавычи, кижуча, атлантического лосося, а также американской палии, кумжи и радужной форели.
В Магаданской области ВНЭ-подобные включения в мазках Крови отмечали у производителей кеты и кижуча, идущих на нерест. Во время передержки производителей на рыбозаводе число рыб-вирусоносителей и доля пораженных эритроцитов резко возрастали.
Заболевание наблюдается в разные сезоны года при температуре воды 5 —19 "С, но наиболее тяжело протекает летом. Резервуар инфекции находится в Мировом океане и, помимо естественно больных лососевых, формировать его могут и другие виды рыб, в частности тихоокеанская сельдь. Инкубационный период колеблется от нескольких дней до нескольких недель. Заболеваемость может достигать 100 %.
Клинические признаки и патогенез. Главным признаком заболевания является анемия жабр и внутренних органов, иногда наблюдается увеличение селезенки. При экспериментальном заражении отмечали также экзофтальм, петехии на поверхности тела, а в желчном пузыре скопление темно-зеленой желчи. При микроскопии мазков крови в цитоплазме эритроцитов обнаруживаются от одного до (реже) трех на клетку округлых включений размером 0,5—5 мкм (рис. 16). Доля пораженных эритроцитов колеблется от менее 1 до 100 %. Для ВНЭ характерно также повреждение ядер инфицированных эритроцитов — от маргинации хроматина до кариорексиса.
При экспериментальном заражении у молоди кеты отмечали резкое снижение содержания зрелых эритроцитов (до полного исчезновения) и увеличение содержания бластных форм клеток, наблюдали моноцитоз, сильно выраженную лейко- и лимфопению. Вирусные включения присутствовали также в эритробластах, макрофагах, гранулоцитах и лимфоцитах. Снижалась или полностью утрачивалась свертываемость крови.
120
