
2_1-2_136
.docЗАВДАННЯ КОНТРОЛЬНОЇ РОБОТИ №2
Загальні вказівки до виконання контрольних робіт.
1. За час вивчення курсу фізики студент повинен виконати та здати на кафедру фізики шість контрольних робіт. Номери задач, які студент повинен включити в свою контрольну роботу, визначаються по таблицях варіантів лаборантами кафедри при отриманні завдання.
2. Контрольні роботи треба виконувати в шкільному зошиті, на обкладинці якого привести відомості за наступним зразком:
Контрольна робота № ___ з загальної фізики. Студента групи ПЦБ - 00 – 1 Кисельова А.В.
3. Умови задач у контрольній роботі треба переписувати повністю. Рішення задач потрібно супроводити короткими, але вичерпними поясненнями. У тих випадках, коли це потрібно, обов’язково приводить креслення, що пояснюють розв’язування задачі.
4. Розв’язувати задачі треба в загальному вигляді, тобто виразити шукану величину в буквених позначеннях параметрів, що задані в умові задачі. Числові значення при підстановці їх в розрахункову формулу і отриману відповідь потрібно давати в одиницях системи СІ, за винятком випадків коли в умові задачі вказано інше. Обчислення треба проводити з дотриманням правил приблизних обчислень, до трьох значущих цифр. При запису відповіді, числові значення потрібно записувати як добуток десяткового дробу з однією значущою цифрою перед комою на відповідну міру десяти. Наприклад, замість 0,00129 треба записувати 1,29 10-3.
5. Розв’язування деяких задач потребує використовування даних про фізичні константи та властивості об’єктів, які в цих задачах згадуються. Ці дані треба брати з відповідних таблиць, що наведені у кінці цього підручника.
6. Кожна контрольна робота повинна завершуватися таблицею відповідей за наступним зразком:
|
Відповідь на задачі |
||||||
|
Варіант |
1 |
2 |
3 |
4 |
5 |
6 |
|
17 |
11 м/с |
1,2 с; 6 Н; |
, рад |
4,2 109 Дж |
у 2 рази |
15,6 Па |
Таблиця варіантів контрольної роботи № 2.
|
Варіант |
Номери завдань |
|||||
|
1 |
2.1 |
2.31 |
2.49 |
2.64 |
2.89 |
2.116 |
|
2 |
2.2 |
2.32 |
2.50 |
2.65 |
2.90 |
2.117 |
|
3 |
2.3 |
2.33 |
2.51 |
2.66 |
2.91 |
2.118 |
|
4 |
2.4 |
2.34 |
2.52 |
2.67 |
2.92 |
2.119 |
|
5 |
2.5 |
2.35 |
2.53 |
2.68 |
2.93 |
2.120 |
|
6 |
2.6 |
2.36 |
2.54 |
2.69 |
2.94 |
2.121 |
|
7 |
2.7 |
2.37 |
2.55 |
2.70 |
2.95 |
2.122 |
|
8 |
2.8 |
2.38 |
2.56 |
2.71 |
2.96 |
2.123 |
|
9 |
2.9 |
2.39 |
2.57 |
2.72 |
2.97 |
2.124 |
|
10 |
2.10 |
2.40 |
2.58 |
2.73 |
2.98 |
2.116 |
|
11 |
2.11 |
2.41 |
2.59 |
2.74 |
2.99 |
2.117 |
|
12 |
2.12 |
2.42 |
2.60 |
2.75 |
2.100 |
2.118 |
|
13 |
2.13 |
2.43 |
2.61 |
2.76 |
2.101 |
2.119 |
|
14 |
2.14 |
2.44 |
2.62 |
2.77 |
2.102 |
2.120 |
|
15 |
2.15 |
2.45 |
2.63 |
2.78 |
2.103 |
2.121 |
|
16 |
2.16 |
2.46 |
2.49 |
2.79 |
2.104 |
2.122 |
|
17 |
2.17 |
2.47 |
2.50 |
2.80 |
2.105 |
2.123 |
|
18 |
2.18 |
2.48 |
2.51 |
2.81 |
2.106 |
2.124 |
|
19 |
2.19 |
2.31 |
2.52 |
2.82 |
2.107 |
2.125 |
|
20 |
2.20 |
2.32 |
2.53 |
2.83 |
2.108 |
2.126 |
|
21 |
2.21 |
2.33 |
2.54 |
2.84 |
2.109 |
2.127 |
|
22 |
2.22 |
2.34 |
2.55 |
2.85 |
2.110 |
2.128 |
|
23 |
2.23 |
2.35 |
2.56 |
2.86 |
2.111 |
2.129 |
|
24 |
2.24 |
2.36 |
2.57 |
2.87 |
2.112 |
2.130 |
|
25 |
2.25 |
2.37 |
2.58 |
2.64 |
2.113 |
2.131 |
|
26 |
2.26 |
2.38 |
2.59 |
2.65 |
2.114 |
2.132 |
|
27 |
2.27 |
2.39 |
2.60 |
2.66 |
2.115 |
2.133 |
|
28 |
2.28 |
2.40 |
2.61 |
2.67 |
2.114 |
2.134 |
|
29 |
2.29 |
2.41 |
2.62 |
2.68 |
2.113 |
2.135 |
|
30 |
2.30 |
2.42 |
2.63 |
2.69 |
2.112 |
2.136 |
-
Визначити кількість речовини і число N молекул кисню масою m = 0,5 кг.
2.1.
Дано
m
= 0,5 кг
![]() = 32 г/моль
= 32 г/моль
![]() = ?
= ?![]() = ?
= ?
Кількість молів речовини визначається виразами
![]() , (1)
, (1)
де
![]() — кількість структурних елементів
(молекул) речовини,
— кількість структурних елементів
(молекул) речовини,
![]() — маса речовини,
— маса речовини,
![]() = 6,02∙1023 моль-1
– число Авагадро.
= 6,02∙1023 моль-1
– число Авагадро.
Звідки отримаємо вираз для розрахунку кількість речовини :
![]() = (2)
= (2)
А з виразів (1) і (2) отримаємо вираз для розрахунку число N молекул:
![]() = (3)
= (3)
Підставляємо дані умови в рівняння (2) та (3) і отримаємо відповідь:
![]() =
= ![]() =
=
-
Вода при температурі t = 4°С займає об'єм V = 1 см3. Визначити кількість речовини і число N молекул води.
2.2.
Дано
t
= 4°С V
= 1 см3
![]() = 18 г/моль
= 18 г/моль
![]() = ?
= ?![]() = ?
= ?
Масу води визначаємо через її густину при температурі 4оС, тобто
![]() , (1)
, (1)
де
![]() = 1000 кг/м3.
= 1000 кг/м3.
Кількість молів речовини визначається виразами
![]() , (2)
, (2)
де
![]() — кількість структурних елементів
(молекул) речовини,
— кількість структурних елементів
(молекул) речовини,
![]() — маса речовини,
— маса речовини,
![]() = 6,02∙1023 моль-1
– число Авагадро.
= 6,02∙1023 моль-1
– число Авагадро.
Звідки отримаємо вираз для розрахунку кількість речовини :
![]() = (3)
= (3)
А з виразів (2) і (3) отримаємо вираз для розрахунку число N молекул:
![]() = (4)
= (4)
Підставляємо дані умови в рівняння (3) та (4) і отримаємо відповідь:
![]() =
= ![]() =
=
-
Визначити концентрацію молекул кисню, що знаходиться в посудині місткістю V = 2 л. Кількість кисню дорівнює = 0,2 моля.
2.3.
Дано
V
= 2 л
=
0,2 моля
![]() = 32 г/моль
= 32 г/моль
![]() = ?
= ?
Концентрацію молекул визначають виразом
![]() , (1)
, (1)
Кількість молів речовини визначається виразами
![]() , (2)
, (2)
де
![]() — кількість структурних елементів
(молекул) речовини,
— кількість структурних елементів
(молекул) речовини,
![]() — маса речовини,
— маса речовини,
![]() = 6,02∙1023 моль-1
– число Авагадро.
= 6,02∙1023 моль-1
– число Авагадро.
Звідки отримаємо вираз для розрахунку кількості молекул речовини:
![]() .
(3)
.
(3)
А з виразів (1) і (3) отримаємо вираз для розрахунку концентрації молекул:
![]() = (4)
= (4)
Підставляємо дані умови в рівняння (4) і отримаємо відповідь:
![]() =
=
-
Визначити кількість речовини водню, що заповнює посудину об'ємом V = 3 л, якщо концентрація молекул газу в ній n = 2 1018 м-3.
2.4.
Дано
V
= 3 л n
= 2 1018
м-3
![]() = 2 г/моль
= 2 г/моль
![]() = ?
= ?
Концентрацію молекул визначають виразом
![]() , (1)
, (1)
Кількість молів речовини визначається виразами
![]() , (2)
, (2)
де
![]() — кількість структурних елементів
(молекул) речовини,
— кількість структурних елементів
(молекул) речовини,
![]() — маса речовини,
— маса речовини,
![]() = 6,02∙1023 моль-1
– число Авагадро.
= 6,02∙1023 моль-1
– число Авагадро.
З виразів (1) та (2) отримуємо формулу для розрахунку кількість речовини
![]() .
(3)
.
(3)
Підставляємо дані умови в рівняння (3) і отримаємо відповідь:
![]() =
=
-
У балоні об’ємом V = 3 л міститься кисень масою m = 10 г. Визначити концентрацію n молекул газу.
2.5.
Дано
V
= 3 л m
= 10 г
![]() = 32 г/моль
= 32 г/моль
![]() = ?
= ?
Концентрацію молекул визначають виразом
![]() , (1)
, (1)
Кількість молів речовини визначається виразами
![]() , (2)
, (2)
де
![]() — кількість структурних елементів
(молекул) речовини,
— кількість структурних елементів
(молекул) речовини,
![]() — маса речовини,
— маса речовини,
![]() = 6,02∙1023 моль-1
– число Авагадро.
= 6,02∙1023 моль-1
– число Авагадро.
Звідки отримаємо вираз для розрахунку кількості молекул речовини:
![]() .
(3)
.
(3)
А з виразів (1) і (3) отримаємо вираз для розрахунку концентрації молекул:
![]() = (4)
= (4)
Підставляємо дані умови (виражені в системі СІ) в рівняння (4) і отримаємо відповідь:
![]() =
=
-
У циліндр довжиною l = 1,6 м, що заповнений повітрям при нормальному атмосферному тиску
 =105 Па,
почали
повільно всувати поршень з площею
основи S
= 200 см2.
Визначити силу F,
діючу
на поршень, якщо
його зупинити
на відстані l1
= 10 см від дна циліндра.
=105 Па,
почали
повільно всувати поршень з площею
основи S
= 200 см2.
Визначити силу F,
діючу
на поршень, якщо
його зупинити
на відстані l1
= 10 см від дна циліндра.
2.6.
Дано
l
=
1,6 м S
= 200 см2 l1
= 10 см
![]() = 29 г/моль
= 29 г/моль
![]() = ?
= ?
З
Рис. 2.6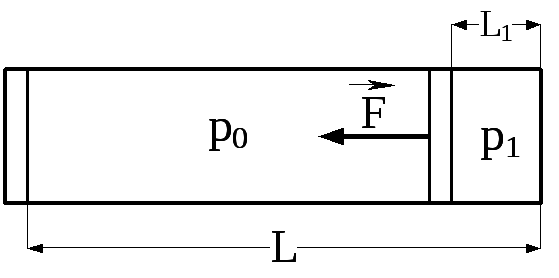
Силу знаходимо за формулою:
![]() . (1)
. (1)
Вважаємо процес стиснення повітря ізотермічним, тоді кінцевий тиск знаходимо з формули закону Бойля – Маріота:
![]() . (2)
. (2)
З рівнянь (1) і (2) отримаємо
![]() . (3)
. (3)
Підставляємо дані умови (виражені в системі СІ) в рівняння (3) і отримаємо відповідь:
![]() =
=
-
У балоні знаходиться газ при температурі T1 = 400 К. До якої температури треба нагріти газ, щоб його тиск збільшився у
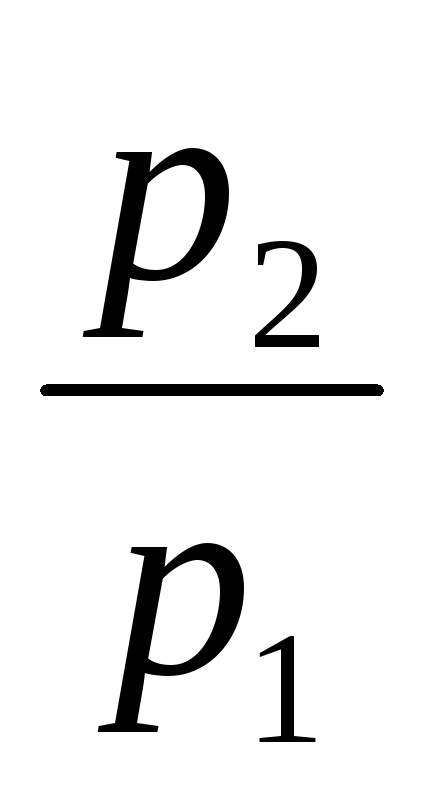 = 1,5
рази?
= 1,5
рази?
2.7.
Дано
T1
=
400 К
![]() = 1,5
рази
= 1,5
рази
![]() = ?
= ?
Нагрівання газу можна вважати ізохорним процесом:
![]() = const. (1)
= const. (1)
З рівняння (1) отримаємо
![]() .
(2)
.
(2)
Підставляємо дані умови в рівняння (2) і отримаємо відповідь:
![]() =
=
-
Балон місткістю
 = 20
л заповнений азотом при
температурі Т
= 400 К. Коли частину
газу витратили, тиск
в балоні знизився на
= 20
л заповнений азотом при
температурі Т
= 400 К. Коли частину
газу витратили, тиск
в балоні знизився на
 = 200 кПа. Визначити масу
= 200 кПа. Визначити масу
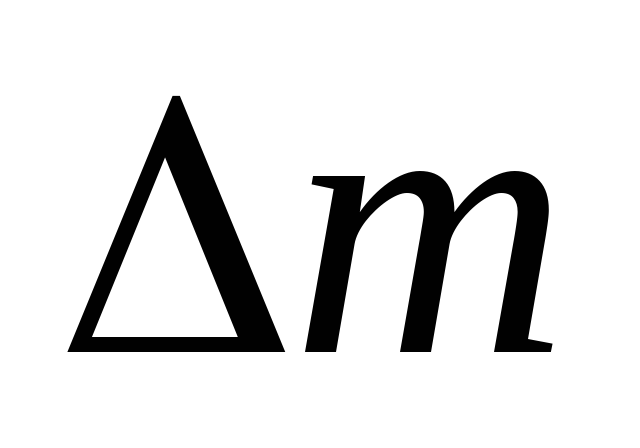 витраченого газу. Процес ізотермічний.
витраченого газу. Процес ізотермічний.
2.8.
Дано
![]() = 20
л
= 20
л![]() =
400 К
=
400 К![]() =
200 кПа
=
200 кПа![]() = 28 г/моль
= 28 г/моль
![]() = ?
= ?
Запишемо рівняння Менделєєва-Клапейрона для двох станів газу:
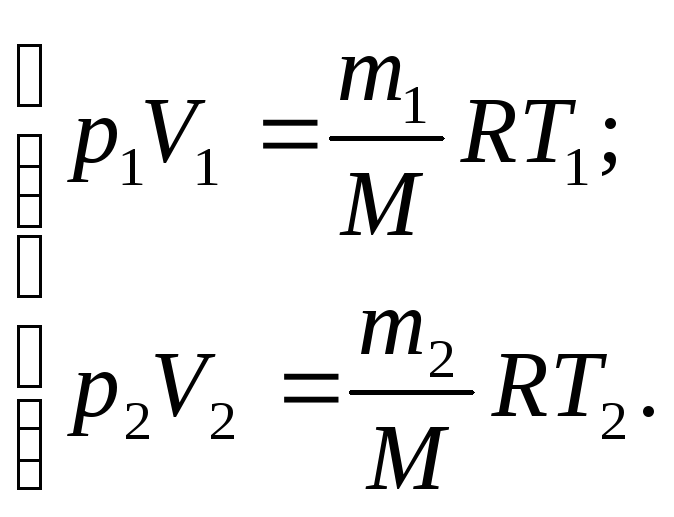 (1)
(1)
Використаємо умову задачі тоді система (1) прийме вигляд
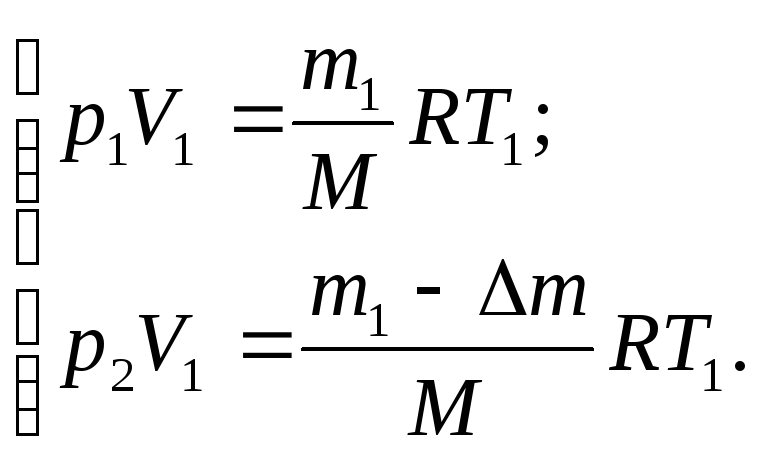 (2)
(2)
Розв’яжемо кожне рівняння системи (2) відносно маси газів:
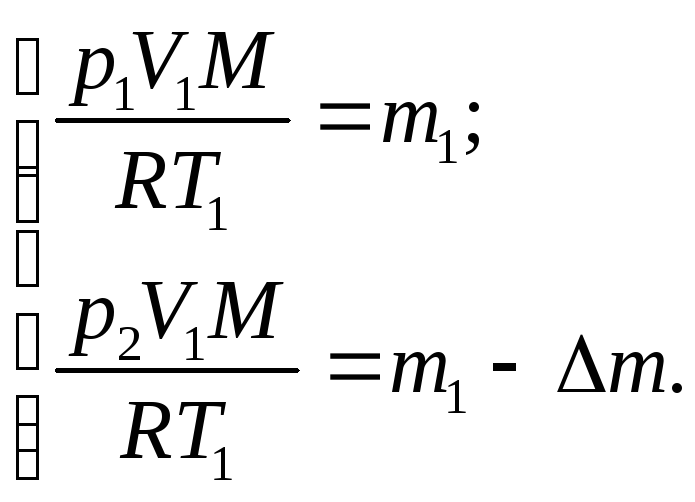 (3)
(3)
Виключаючи
з системи (3) масу газу
![]() ,
отримаємо вираз для розрахунку:
,
отримаємо вираз для розрахунку:
![]() = (4)
= (4)
Підставляємо дані умови в рівняння (4) і отримаємо відповідь:
![]() =
=
-
У балоні місткістю V = 15 л знаходиться аргон під тиском
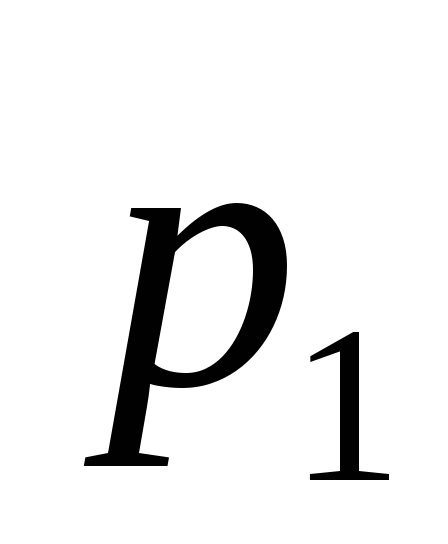 = 600 кПа і при
температурі Т1
=
300 К. Коли з
балона була взята
деяка кількість газу, тиск
в балоні знизився до
= 600 кПа і при
температурі Т1
=
300 К. Коли з
балона була взята
деяка кількість газу, тиск
в балоні знизився до
 = 400 кПа, а температура встановилася T2
= 260 К. Визначити масу
= 400 кПа, а температура встановилася T2
= 260 К. Визначити масу
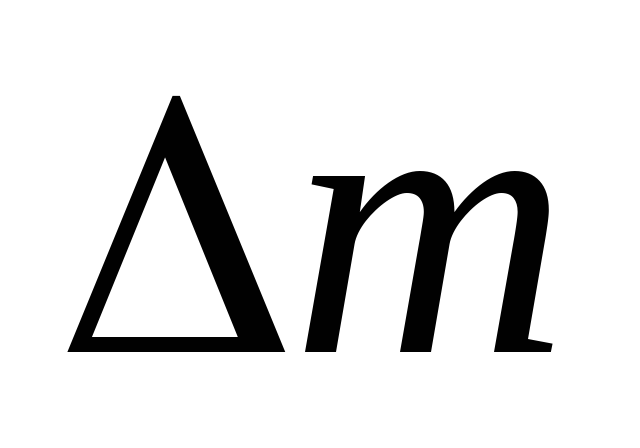 аргону, взятого
з
балону.
аргону, взятого
з
балону.
2.9.
Дано
![]() = 15
л
= 15
л![]() =
600 кПа
=
600 кПа![]() =
400 кПа
=
400 кПа![]() =
300 К
=
300 К![]() = 260 К
= 260 К![]() = 40 г/моль
= 40 г/моль
![]() = ?
= ?
Запишемо рівняння Менделєєва-Клапейрона для двох станів газу:
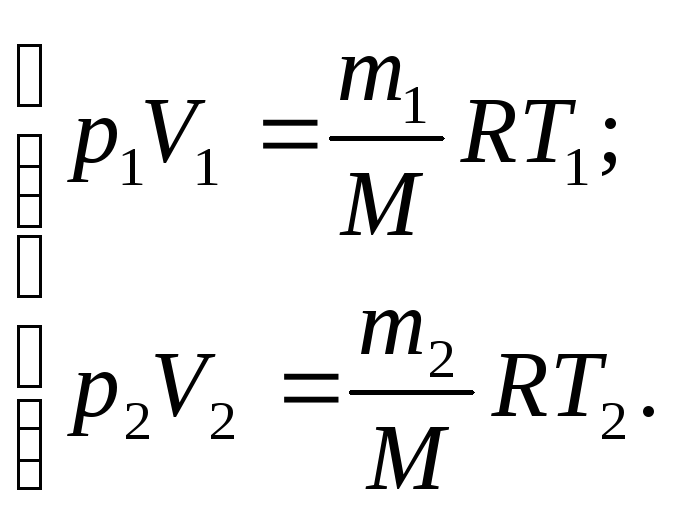 (1)
(1)
Використаємо умову задачі тоді система (1) прийме вигляд
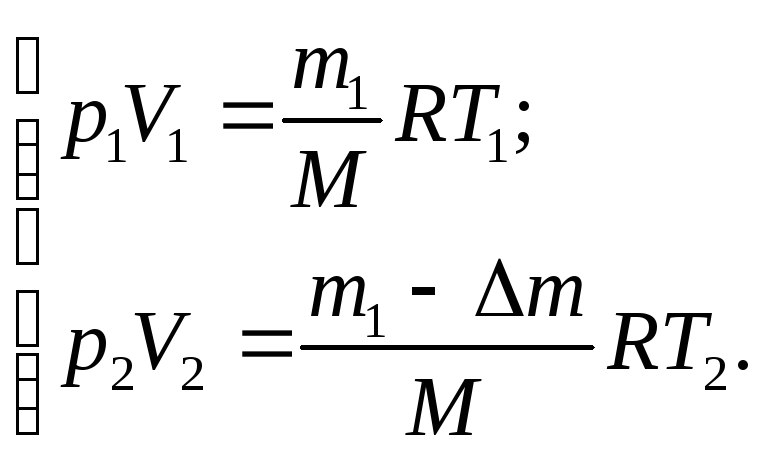 (2)
(2)
Ділимо
друге рівняння системи (2) на перше і
розв’яжемо його відносно масу
![]() аргону, взятого
з
балону:
аргону, взятого
з
балону:
![]() . (3)
. (3)
З
першого рівняння системи (2) визначаємо
![]() :
:
![]() , (4)
, (4)
та підставляємо цю масу в рівняння (3) і отримаємо вираз для розрахунку:
![]() = (5)
= (5)
Підставляємо дані умови в рівняння (5) і отримаємо відповідь:
![]() =
=
-
Д
Дано
 =
2 МПа,
=
2 МПа,
 = 800 К,
= 800 К,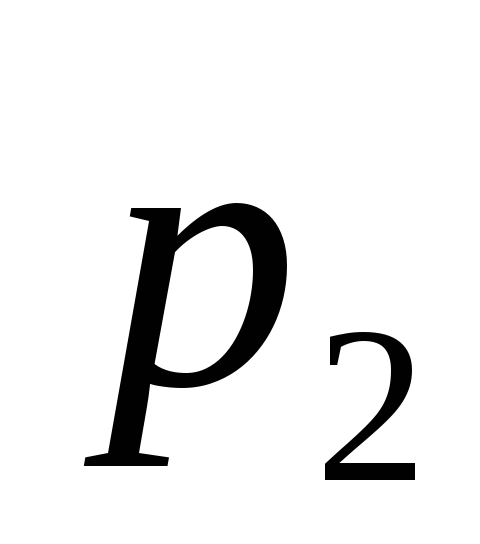 =
2,5 МПа
=
2,5 МПа
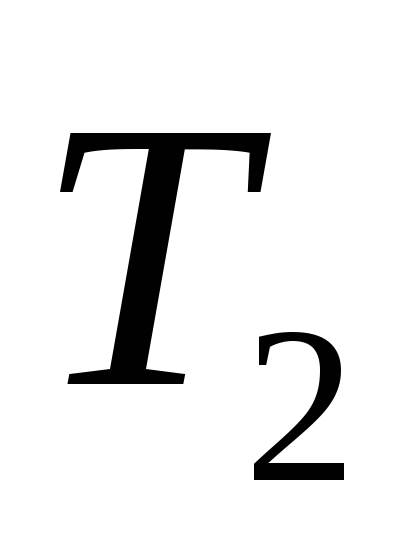 = 200 К
= 200 К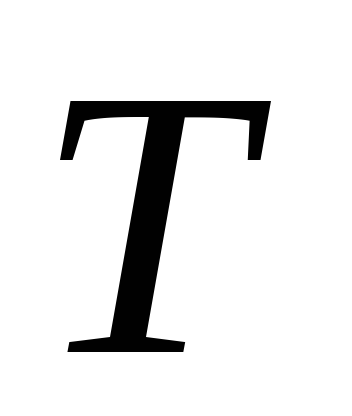 = 200 К,
= 200 К,
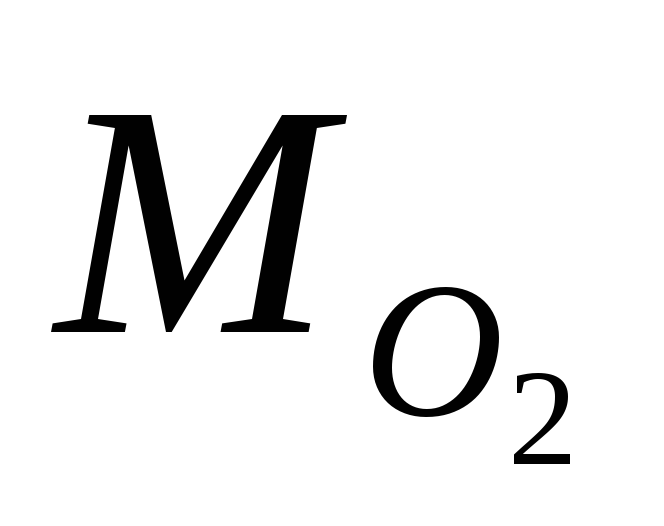 = 32 г/моль
= 32 г/моль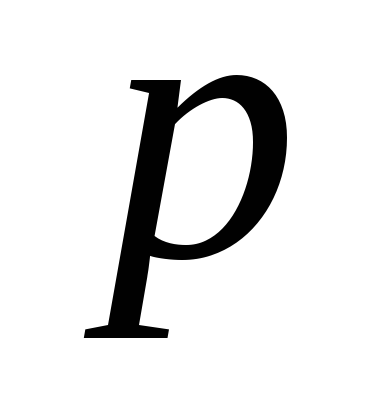 = ?
= ?
ві посудини однакового об'єму містять кисень. У одній посудині тиск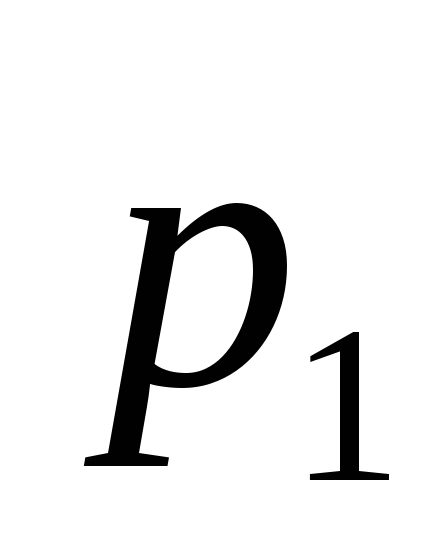 =
2 МПа і температура T1
= 800 К, в іншій
=
2 МПа і температура T1
= 800 К, в іншій
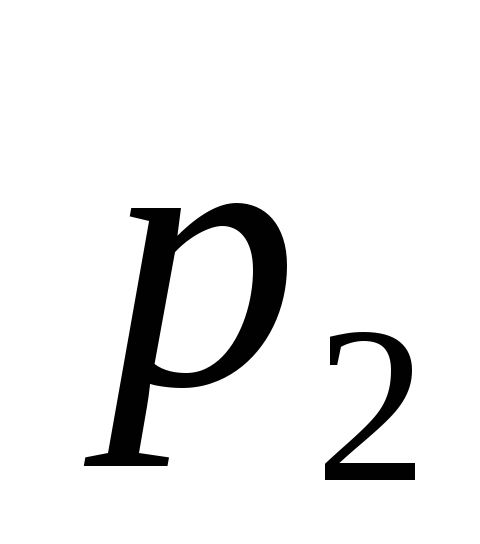 =
2,5 МПа, T2
= 200 К. Посудини
з'єднали трубкою
і охолодили кисень до температури Т
= 200 К. Визначити встановлений у посудинах
тиск
=
2,5 МПа, T2
= 200 К. Посудини
з'єднали трубкою
і охолодили кисень до температури Т
= 200 К. Визначити встановлений у посудинах
тиск
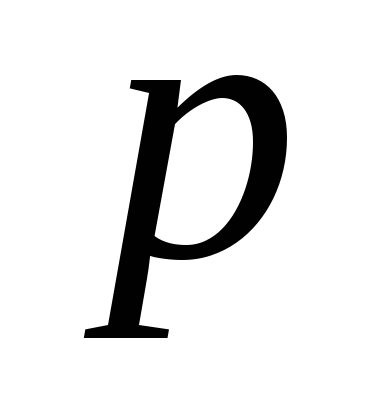 .
.
2.9.
Розв’язок.
Тиск суміші газів (закон Дальтона):
![]() , (1)
, (1)
![]() -
парціальний тиск
-
парціальний тиск
![]() -ї
компоненти суміші;
-ї
компоненти суміші;
![]() - число
компонентів;
- число
компонентів;
![]() - маса
- маса
![]() компоненти суміші;
компоненти суміші;
![]() - кількість молів
- кількість молів
![]() -ї
компоненти суміші.
-ї
компоненти суміші.
Парціальний тиск визначаємо з рівняння Менделєєва-Клапейрона:
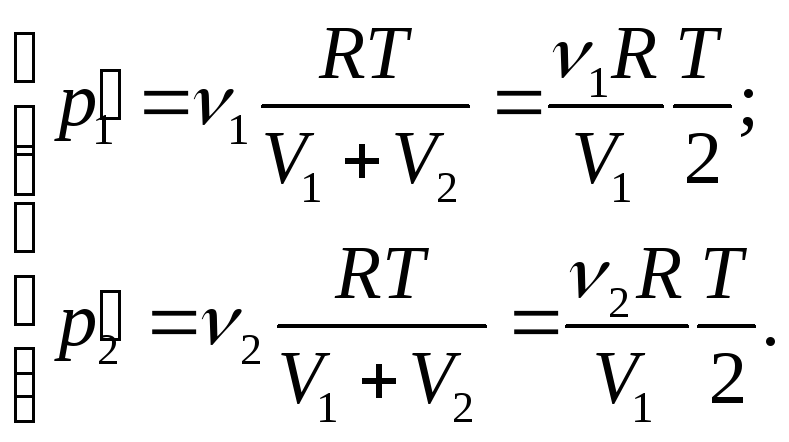 (2)
(2)
Запишемо рівняння Менделєєва-Клапейрона для станів газу в двох посудинах:
